Генитальный эндометриоз
Определение понятия.Понятие эндометриоз включает наличие эндометриоподобных разрастаний, развивающихся вне пределов обычной локализации эндометрия — на влагалищной части шейки матки, в толще мышечного слоя матки и на ее поверхности, на яичниках, тазовой брюшине, крестцово-маточных связках и т.п. В связи с тем что анатомически и морфологически эти гетеротопии не всегда идентичны слизистой оболочке матки (так, например, мелкие и крупные эндометриоидные кисты яичника не содержат эндометри-альных желез), одним из основных условий для верификации диагноза служит наличие обязательного сочетания двух компонентов — эпителиального и стромального. Ряд исследователей рассматривают отдельные формы эндометриоза яичника как доброкачественные опухоли. Термином «эндометриома», в частности, иногда обозначают большие по размеру эндометриоидные разрастания, хотя по гистогенезу подобные образования, независимо от их размеров, следует рассматривать как эндометриоз, а не опухоль. В пояснительных замечаниях экспертов ВОЗ к Международной гистологической классификации опухолей яичников [149] подчеркивается, что несмотря на то, что эндометриодные гетеротопии макроскопически и могут иметь признаки опухоли и/или образовывать узелки, напоминающие полипы эндометрия, при подобных поражениях отсутствуют многие черты истинного новообразования. В связи с этим поражение эндометриозом следует классифицировать как опухолевидный процесс. Первые упоминания о заболевании с характерной симптоматикой эндометриоза и описанием его лечения найдены в египетском папирусе Эберта.
Классификация.В зависимости от места локализации эндоме-триоидных гетеротопии различают генитальный и экстрагениталь-ный эндометриоз.
Генитальный эндометриоз (ГЭ) делится на внутренний (развивается в матке и интрамуральной части маточных труб) и наружный. Последний включает эндометриоидные поражения яичников, маточных связок и труб, шейки матки, влагалища, вульвы и др. Экс-трагенитальный эндометриоз топографически не связан с тканями и органами репродуктивной системы — это эндометриоз ЖКТ, мочевыводящих путей, кожи, пупка, послеоперационных рубцов, легких, плевры, диафрагмы и других отдаленных локализаций. Во-
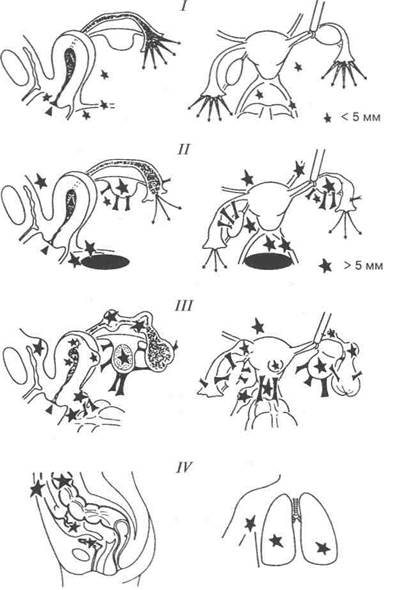
Рис. 4.16. Эндоскопическая классификация эндометриоза: I-IV— степени распространения наружного ГЭ
Глава 4. Патология репродуктивной системы в период зрелости
прос о классификации и выделении отдельных клинических форм генитального эндометриоза, несмотря на интенсивный интерес к проблеме в течение последних лет, продолжает оставаться дискуссионным, особенно в отношении наружного эндометриоза. С внедрением лапароскопической техники классификации были во многом расширены и дополнены. Один из подобных вариантов эндоскопической классификации эндометриоза [95] представлен на рис. 4.16. Более детальное представление о классификациях эндометриоза можно получить в соответствующих руководствах [2,73,180]. В 1984 г. на основе данных эндоскопического исследования было предложено выделение малых форм наружного эндометриоза, к которым относят эндометриоидные гетеротопии, не превышающие 0,5 см в диаметре и обычно не сопровождающиеся выраженными клиническими проявлениями, за исключением бесплодия [34, 180].
В табл. 4.8 представлена классификация эндометриоза, предложенная Американским обществом фертильности в 1985 г. (R-AFS classification), основанная на балльной оценке степени распространения наружного ГЭ [2, 73, 97]. Эта классификация составлена таким образом, чтобы при подсчете суммы баллов имелась возможность прогнозировать восстановление фертильности после проводимого лечения. Основным недостатком этой классификации является ограничение ее визуальной оценкой анатомических повреждений без учета инфильтративных форм при поражении ректовагинальной клетчатки и параметриев, а также целого ряда других признаков. Многими исследователями высказаны соображения о необходимости дальнейших изысканий в области терминологии и классификации ГЭ.
Таблица 4.8
Классификация эндометриоза (1985) (по [180])
| Локализация | Характеристика эндометриоза | Размеры эндометриоидных гетеротопии, см | ||
| < 1 | 1-3 | >3 | ||
| Оценка, баллы | ||||
| Брюшина | поверхностный | |||
| глубокий | ||||
| правый | поверхностный | |||
| глубокий |
4.5. Генитальный эндометриоз
Окончание табл. 4.8
| Локализация | Характеристика | Размеры эндометриоидных гетеротопий, см | |||
| эндометриоза | < 1 | 1-3 | >3 | ||
| Оценка, баллы | |||||
| Яичники | левый | поверхностный | |||
| глубокий | |||||
| Облитерация позадиматочного пространства | частичная | полная | |||
| Спайки (объем поврежденной ткани) | < 1\3 запаяно | 1\3-2\3 запаяно | > 2\3 запаяно | ||
| Яичники | правый | нежные | |||
| плотные | |||||
| левый | нежные | ||||
| плотные | |||||
| Трубы | правая | нежные | |||
| плотные | 4* | 8* | |||
| левая | нежные | ||||
| плотные | 4* | 8* |
* Полностью запаянный фимбриальный отдел трубы следует оценивать >16.
В НЦ АГиП РАМН используются клинические классификации эндометриоидных гетеротопий различной локализации с выделением 4 стадий распространения патологического процесса [2].
Для диффузной формы внутреннего эндометриоза матки (аде-номиоза) выделены следующие стадии патологического процесса:
I — ограничение патологического процесса подслизистой обо
лочкой матки;
II — распространение на мышечные слои матки;
III — распространение на всю толщу мышечного слоя до серозного покрова матки;
IV — вовлечение в патологический процесс (помимо матки) париетальной брюшины малого таза и соседних органов.
Стадии распространения патологического процесса при эндоме-триозе яичников характеризуются следующим образом:
Глава 4. Патология репродуктивной системы в период зрелости
I — мелкие точечные эндометриоидные образования на поверх
ности яичников, брюшине прямокишечно-маточного пространства
без образования кистозных полостей;
II — эндометриоидная киста одного яичника диаметром < 5—
6 см с мелкими эндометриоидными включениями на брюшине ма
лого таза. Незначительный спаечный процесс в области придатков
матки без вовлечения кишечника;
III — эндометриоидные кисты обоих яичников (различной величины — диаметр одного яичника > 5—6 см и небольшая киста другого). Эндометриоидные гетеротопии небольших размеров на серозном покрове матки, маточных труб и на париетальной брюшине малого таза. Выраженный спаечный процесс в области придатков матки с частичным вовлечением кишечника;
IV — двусторонние эндометриоидные кисты яичников больших размеров (> 6 см) с переходом патологического процесса на соседние органы — мочевой пузырь, прямую и сигмовидную кишку. Распространенный спаечный процесс.
Наиболее тяжелой формой ГЭ является эндометриоз ретроцер-викальной локализации. При данной локализации патологического процесса выделяют также 4 стадии распространения:
I — эндометриоидные очаги располагаются в пределах ректо-
вагинальной клетчатки;
II — прорастание эндометриоидной ткани в шейку матки и вла
галище с образованием мелких кист;
III — распространение на крестцово-маточные связки и серозный покров прямой кишки;
IV — вовлечение в патологический процесс слизистой оболочки прямой кишки, распространение его на брюшину прямокишечного пространства с образованием спаечного процесса в области придатков матки.
Частота.Согласно данным последних лет, ГЭ относится к числу наиболее распространенных гинекологических заболеваний у женщин репродуктивного возраста и поражает около 10 % общей популяции женщин. Частота ГЭ особенно значительна среди женщин, страдающих бесплодием и болью в области малого таза — от 15 до 50%, по приводимым отдельными исследователями данным [109, 162, 203]. Вместе с тем эндометриоз нередко не диагностируется или, наоборот, служит поводом для ошибочных диагнозов [186]. В связи с этим в современных условиях наиболее реальное пред-
4.5. Генитальный эндометриоз
ставление о частоте эндометриоидных гетеротопий дают результаты, получаемые в основном при целенаправленном комплексном обследовании отдельных контингентов женщин, в частности при гистеро- и лапароскопическом обследовании по поводу бесплодия, при гистологическом исследовании удаленных во время оперативного вмешательства препаратов и т.д.
Так, например, в НЦ АГиП РАМН (в то время — ВНИИАГ МЗ СССР) за период с 1972 по 1982 г. ГЭ был выявлен и гистологически верифицирован у 1258 (27,4 %) из 4584 больных, подвергшихся чревосечению. Среди них (от общего числа оперированных) внутренний эндометриоз матки был диагностирован в 14 % наблюдений, наружный — в 13,4%. В это число не были включены больные эндоме-триозом шейки матки, влагалища и других локализаций, которые чревосечению не подвергались и диагноз у которых был подтвержден при гистологическом исследовании биопсийного материала, полученного в процессе эндоскопии [37]. В исследовании, по материалам 4554 чревосечений у гинекологических больных за период 22 лет в одной из университетских клиник Японии, ГЭ был выявлен в 11 % наблюдений. По литературным данным, относительная частота выявления ГЭ возросла в среднем от 2,2 % в 1965 г. до 20,6 % в 1986 г. (при диапазоне колебаний по отдельным годам от 2,2 до 21 %).
Не меньший интерес представляют данные о частоте обнаружения внутреннего эндометриоза матки при гистерэктомии, которая, по данным отдельных исследований, колеблется в значительных пределах, что связано с различиями в критериях включения пациенток в то или иное исследование. Так, по данным одной из клиник Японии, за 4 года (при среднем возрасте подвергшихся гистерэктомии больных 44,8 года) частота выявления внутреннего эндометриоза составила в среднем 12,2%. Согласно другому исследованию, проведенному во Франции, на 214 гистерэктомии (с 1979 по 1987 г.) для контингента женщин моложе 40 лет она составила 33 %, в возрасте 40-44 лет — 50%, 45-49 лет — 54%, 50-54 лет — 61 %, 55—59 лет — 66 %, старше 60 лет — 22 %. Средняя же частота выявления внутреннего эндометриоза у женщин из числа подвергшихся гистерэктомии в репродуктивном возрасте составила 51 %, в перименопаузальном периоде — 51 %, при продолжительности постменопаузы в пределах 1-10 лет — 72 %, а свыше 10 лет — 12 %. Отмечены отдельные случаи внутреннего эндометриоза матки и у женщин старше 80 лет [125].
Глава 4. Патология репродуктивной системы в период зрелости
Частота эндометриоза, выявляемого в процессе диагностической лапароскопии, колеблется в пределах 12—26%. Средний возраст больных, подвергающихся оперативному вмешательству по поводу наружного эндометриоза, составляет 35—37 лет. Что же касается частоты выявления эндометриоза при бесплодии, то данной проблеме посвящено значительное количество исследований, с помощью которых было показано, что у женщин с бесплодием она в несколько раз превышает таковую в общей популяции. Установлено, что 30—40 % больных эндометриозом женщин страдают бесплодием; с другой стороны, у 6—25 % женщин с бесплодием выявляется эндометриоз.
Патобиология.Многофакторная и сложная патобиология ГЭ до сих пор служит причиной суждений о загадочной природе этого заболевания. Между тем предпринимаемые в течение последних десятилетий многочисленные попытки уточнения его этиологии послужили не только основой для формулирования разнообразных патогенетических концепций, но способствовали также выявлению ряда кофакторов, вовлекающихся в патологический процесс на различных этапах развития заболевания [2, 16, 47, 104].
Приступая к изложению современных представлений о патогенезе ГЭ, следует прежде всего отметить, что, несмотря на общность ряда этиологических факторов, отдельные клинические формы заболевания — внутренний эндометриоз матки (аденомиоз), наружный генитальный (эндометриоз брюшины и яичников) и ретро-цервикальный эндометриоз — характеризуются гетерогенностью. Поскольку развитие их происходит с участием различных патогенетических механизмов, они представляют собой, следовательно, различные заболевания [182].
В соответствии с современной концепцией о природе ГЭ, в па-тобиологии заболевания рассматривается участие разнообразных факторов: наследственность, феномен ретроградной менструации и имплантация на поверхности брюшины клеточных элементов менструального содержимого, целомическая метаплазия, дефекты клеточного и гуморального иммунитета, роль избыточной экспрессии энзима ароматазы и развитие в связи с этим феномена локальной гипергормонемии, ауто- и паракринные влияния (факторы роста), оксидативный стресс, ятрогенные влияния, воздействие токсикантов внешней среды, избыточное потребление алкоголя, кофеина и курение (потенциальный источник диоксина). Больший риск разви-
4.5. Генитальный эндометриоз
тия ГЭ отмечен у женщин с ранним менархе, регулярным менструальным циклом и запоздалым наступлением первой беременности. Детальному рассмотрению этих факторов посвящен ряд систематических обзоров, основывающихся на материалах, опубликованных в литературе в течение нескольких последних лет [16, 159, 205, 213].
Роль наследственного фактора и генетическая предрасположенность к заболеванию ГЭ была установлена в процессе проведения ряда целенаправленных исследований [175, 201]. Среди ближайших родственниц пробандов — больных ГЭ различной локализации — выявлена большая склонность к развитию этого заболевания нежели в популяции. Семейный риск заболевания ГЭ был продемонстрирован в сравнительном исследовании, основанном на опросе 515 пробандов больных эндометриозом и 149 женщин с лапаро-скопически верифицированным отсутствием эндометриоза (контроль), относительно состояния здоровья ближайших их родственниц. Заболевание наружным или внутренним эндометриозом было отмечено у 3,9 % матерей (0,7 % в группе контроля) и 4,9 % сестер пробандов (0,6 % в контроле). Относительный риск возникновения эндометриоза у родственниц I степени родства по показателю СШ составил, таким образом, 7,2 (95% ДИ 2,1—24,3), а риск заболеть эндометриозом оказался в 7 раз выше среди матерей и сестер пробандов, что не исключает, вместе с тем, аналогичную степень риска и для их дочерей в сравнении с единичными случаями заболевания у женщин с неотягощенным семейным анамнезом.
Особый интерес вызывает выявление семейных форм заболевания с поражением ГЭ нескольких поколений женщин в одной и той же семье. Так, в одной из ранних работ были опубликованы данные 15-летнего наблюдения, касающегося 7 семей, в которых верифицированное гистологически заболевание внутренним эндометриозом матки (аденомиозом) было выявлено в процессе оперативного вмешательства у матерей и дочерей одновременно. Внедрение в клиническую практику такого неинвазивного метода диагностики, как MP, существенно расширило возможности подобных исследований. С помощью полученных при MP данных было, в частности, впервые описано заболевание аденомиозом в 3 поколениях женщин в одной семье. В этой семье пробанд была оперирована по поводу аденомиоза в возрасте 34 лет, ее мать — в 58 лет. Кроме того, в процессе обследования с помощью MP аденомиоз был выявлен у сестры (32 лет) и у бабушки (74 лет) пробанда. По данным MP, толщина
Глава 4. Патология репродуктивной системы в период зрелости
пограничной зоны между эндо- и миометрием составила 40 мм у пробанда, 20 мм у сестры и 12 мм у бабушки.
В литературе нам удалось встретить описание еще одного примера семейной формы гистологически верифицированного адено-миоза с поражением этим заболеванием матери и 4 ее дочерей [168]. Отчетливая склонность к развитию ГЭ отмечена также и у монозиготных близнецов. В литературе представлено описание особого генетического фенотипа при ГЭ и высказано предположение о вовлеченности в развитие этого заболевания гена 9р21 [99].
Наиболее принятой к настоящему времени теорией происхождения наружного ГЭ с поражением брюшины является теория ретроградной менструации с последующей имплантацией элементов менструального содержимого, предложенная еще в 1927 г. [192]. Несмотря на ряд противоречий, выявившихся в ходе дальнейших исследований, правомочность этой теории подтверждается в клинической практике многочисленными наблюдениями. К ним прежде всего относится обнаружение уникального (физиологического?) феномена ретроградной менструации у подавляющего большинства практически здоровых женщин, В брюшной полости примерно у 90 % женщин происходят фагоцитоз и апоптоз клеточных элементов, а у -10—15 % последние прикрепляются к брюшине и обусловливают в дальнейшем развитие эндометриоидных гетеротопий.
В развитии патологического процесса участвует ряд кофакторов, среди которых в патофизиологии ГЭ особое место занимает дисфункция иммунной системы. Угнетение иммунокомпетентных механизмов, в частности естественных киллеров перитонеальной жидкости у больных эндометриозом брюшины в сравнении со здоровыми женщинами, подтверждено рядом многочисленных исследований [159], тогда как прикрепление к брюшине разбросанных по брюшной полости эндометриальных клеточных элементов связано с экспрессией молекул адгезии и их рецепторов. Благодаря наличию в брюшине микроскопических дефектов клетки эндометрия вступают в контакт с субмезотелиальным матриксом, подвергаются в последующем пролиферации, росту и иногда глубоко проникают в подбрюшинное пространство [186].
В процессе изучения природы ГЭ довольно часто используется сопоставление ряда характеристик экто- и эутопического эндометрия. Так, в частности, между ними выявлены различия по клональ-ности клеточных популяций, энзиматической активности, белково-
4.5. Генитальный эндометриоз
му спектру, гистологическим и морфологическим характеристикам. Тем самым, в противовес первоначальным представлениям, в ткани эндометриоидных гетеротопий брюшины было продемонстрировано отсутствие типичных свойств аутотрансплантатов. Вместе с тем в развитии эндометриоза брюшины определенную роль играет и объем ретроградной менструации, и, как указывалось выше, иммунные резервы брюшины. В одном из наблюдений отмечена также склонность к развитию эндометриоза брюшины у подвергавшихся оперативному вмешательству 64 женщин с аномалиями развития маточных труб и наличием гематометры и/или гематокольпоса. В данном исследовании эндометриоз брюшины был обнаружен при функционирующем эндометрии у 10 (89%) из 13 женщин с нарушенной проходимостью маточных труб и только у 18 (38 %) из 47 женщин при отсутствии гематокольпоса или гематометры (р < 0,01). Полученные результаты явились дополнительным свидетельством того, что повышенный риск ретроградной менструации повышает риск развития эндометриоза [185].
Таким образом, современные представления относительно па-тобиологии наружного ГЭ основываются на сочетанном воздействии ряда факторов, среди которых одно из центральных мест занимают феномен ретроградной менструации и некомпетентность локального иммунитета. Что же касается патогенеза заболевания ГЭ в целом, то для этого заболевания, по мнению исследователей, характерны два фенотипа с различными клинико-патогене-тическими характеристиками. Один из них соответствует развитию наружного ГЭ (с преобладанием геморрагического компонента), а другой — развитию узловатой или аденомиотической формы (в том числе и приретроцервикалъном эндометриозё) [111, 112]. С помощью клинико-физиологических исследований было установлено, что поражение брюшины и яичников ГЭ связано в значительной степени с патофизиологическими особенностями функционального слоя эутопического эндометрия тех же больных. Использование же метода MP позволило выявить наличие гиперплазии мышечных элементов в пограничном слое матки и тем самым подтвердить узловатую природу патологического процесса у больных внутренним эндометриозом.
Согласно распространенной точке зрения, для эндометриоза характерно аутоиммунное состояние [168], признаками которого служат повышенная концентрация цитокинов, соответствующие из-
Глава 4. Патология репродуктивной системы в период зрелости
менения в состоянии Т- и В-системы и снижение апоптоза в ткани эндометриоидных гетеротопий, что аналогично таковым при типичных аутоиммунных состояниях. Выявление сходства патобиологии ГЭ с аутоиммунными состояниями способствовало попыткам использования иммуномодуляторов для его лечения.
Участие цитокинов в иммунобиологии ГЭ было продемонстрировано с помощью открытого сравнительного исследования гомогенатов ткани эндометриодных гетеротопий и эутопического эндометрия, проведенного у 26 больных ГЭ и 22 здоровых женщин. Результаты исследования выявили существенное возрастание концентрации всех трех исследованных цитокинов — ИЛ-1(3, ИЛ-6а и ФНО-а — в ткани эндометриоидных гетеротопий и эутопического эндометрия со значимыми различиями в зависимости от морфотипа заболевания. У больных ГЭ в ткани гетеротопий и эутопического эндометрия обнаружено существенно более высокое содержание ИЛ-6а, тогда как содержание ФНО-а в ткани гетеротопий оказалось ниже, чем в эутопическом эндометрии здоровых женщин [104]. Потенциальными источниками цитокинов в перитонеальной жидкости у больных ГЭ являются активированные макрофаги. С помощью исследований in vitro у больных эндометриозом брюшины выявлены нарушения со стороны ответа ИЛ-6ос по отношению к перитоне-альным макрофагам, клеткам стромы эндометрия и макрофагам периферической крови, а также резистентность эндометриоидных имплантов к попыткам подавления процессов роста вследствие снижения экспрессии ИЛ-6ос на клеточной мембране. Одновременно отмечено снижение концентрации соответствующих рецепторов в перитонеальной жидкости. Вместе с тем, однако, не все результаты проведенных в этом направлении исследований оказались идентичными, что, по-видимому, обусловлено различной специфичностью антител [159].
Среди различных кофакторов в развитии заболевания, как уже отмечалось, важную роль играет ФНО. В физиологических условиях ФНО-а образуется в нейтрофилах, активированных лимфоцитах, макрофагах, клетках естественных киллеров и ряде других негемо-поэтических клетках, а ФНО-в — в лимфоцитах. В эутопическом эндометрии человека наибольшая экспрессия ФНО-а имеет место в лютеиновой фазе цикла; присутствие же этого фактора в перитонеальной жидкости может способствовать прикреплению эктопической ткани эндометрия к брюшинному покрову и формированию
4.5. Генитальный эндометриоз
имплантов. Степень повышения концентрации ФНО-а в перито-неальной жидкости больных эндометриозом соответствует стадии развития заболевания. Как известно, данный фактор принимает участие в развитии воспалительных процессов и другой этиологии.
В патобиологии ГЭ важную роль играет СЭФР, который способствует новообразованию сосудов вокруг эндометриоидных гетерото-пий, особенно красных имплантов; в перитонеальной жидкости обнаруживается повышенная концентрация этого фактора. В условиях in vitro перитонеальная жидкость, получаемая от больных наружным ГЭ, обладает способностью повышать пролиферативную активность клеток стромы эндометрия и стимулировать образование новых кровеносных сосудов в хорион-аллантоидной мембране.
Несмотря на отсутствие убедительных данных относительно места образования этого фактора (так же как и ряда других цитокинов), считается, что способность к их синтезу и секреции свойственна, наряду с активированными перитонеальными макрофагами, также и ткани эндометриоидных гетеротопий. Как известно, объем перитонеальной жидкости и содержание ее компонентов зависят от активности фолликулов, кровоснабжения желтого тела и уровня гормональных влияний и у здоровых женщин достигает ко времени овуляции 20 мл. По данным сравнительного изучения перитонеальной жидкости (в зависимости от результатов диагностической лапароскопии, дня цикла и наличия или отсутствия бесплодия), у больных ГЭ отмечено существенно большее содержание макрофагов, чем у фертильных женщин и у женщин с необъяснимым бесплодием. Активацию макрофагов в перитонеальной жидкости расценивают в качестве одного из ключевых моментов в этиологии бесплодия у больных ГЭ. Клинический эффект используемых с успехом для лечения ГЭ медикаментозных препаратов, в частности противовоспалительных средств и даназола, связывают отчасти с иммунодепрессивными их свойствами. Результаты многолетних наблюдений, посвященных изучению роли иммунного фактора в патобиологии ГЭ, послужили основанием для рекомендаций относительно использования данных о состоянии иммунобиологического фактора для обоснования прогноза течения заболевания и эффективности его лечения [159].
Выявление ряда аномальных свойств эутопического эндометрия у больных ГЭ способствовало существенному расширению представлений о патобиологии заболевания [213]. В сравнении с эндо-
Глава 4. Патология репродуктивной системы в период зрелости
метрием здоровых женщин эти аномальные свойства обеспечивают возможность защиты от повреждающего эффекта специфических антигенов, вырабатываемых иммунными клетками. К их числу относятся:
• специфические антигенные свойства;
• способность к накоплению различных популяций иммунных клеток и синтезу иммуномодулирующих факторов;
• возможность создания локальной гиперэстрогении;
• способность к клеточной пролиферации, повреждению брюшины, имплантации и пенетрации в подлежащие ткани;
• аутозащита от физиологического апоптоза;
• способность продуцировать в избыточных количествах специфические белки и модулировать активность макрофагов и избыточный ангиогенез.
В условиях нормальной внутренней среды при ретроградных менструациях образования эндометриоидных гетеротопий в брюшной полости не происходит, тогда как при наличии некоторых из рассмотренных выше аномалий могут развиваться те или иные клинико-патогенетические формы заболевания. Феномен ретроградной менструации обнаруживается в брюшной полости чаще в фолликулиновой фазе цикла, нежели в лютеиновой. Прикрепление к брюшине, процессы пролиферации и инвазии клеточных элементов в подлежащие ткани происходят с участием молекул адгезии (интегринов) благодаря проявлению своеобразной их «агрессивности» по отношению к брюшине, аномальной экспрессии белков теплового шока и способности ангиогенного фактора стимулировать избыточный ангиогенез. Наряду с этим имплантация эндометрия может быть обусловлена микроскопическими или минимальными повреждениями брюшины, имеющими красный цвет, для характеристики которых иногда используется термин «физиологический эндометриоз» [186].
В патобиологии ГЭ определенную роль могут играть и некоторые контаминанты внешней среды, в том числе такой токсикант, как диоксин 2,3,7,8-тетрахлородибензола, что подтверждено экспериментальными исследованиями и клиническими наблюдениями. Было показано, что указанные соединения обладают потенциальным модулирующим влиянием на иммунную и эндокринную системы, что может в свою очередь способствовать развитию эндометриоза [191]. Эти данные перекликаются с наблюдениями о более частом
4.5. Генитальный эндометриоз
развитии эндометриоза у приматов на фоне ионизирующей радиации, оказывающей аналогичный иммунодепрессивный эффект.
В понимании природы ГЭ важную роль сыграло изучение особенностей гистогенеза заболевания при различной его локализации. Как уже указывалось, общепринятой точкой зрения в современных условиях является представление о том, что наружный эндометриоз (брюшины и яичников), внутренний эндометриоз матки (аденоми-оз) и ретроцервикальный эндометриоз являются тремя различными патологическими состояниями с различным пато- и морфогенезом [181, 182]. Подобное заключение было основано на результатах исследования, проведенного у женщин, страдавших бесплодием и/или тазовой болью на фоне лапароскопически подтвержденного эндометриоза, путем сопоставления морфологических, морфометрических и гистохимических данных при каждом из перечисленных вариантов локализации ГЭ.
Среди очагов эндометриоза брюшины выделяют: типичные (синие, фиолетовые, черные), пигментированные (в виде бугорков желто-коричневого цвета), непигментированные (белесоватые пузырьки) и красные (железистые) очаги. При морфологическом и морфометрическом анализе выявлено сходство между эутопическим эндометрием и красными очагами на брюшине малого таза, что дает основание считать их ранней стадией имплантации желез и стромы эндометрия. В дальнейшем возникает воспалительная реакция, стимулирующая рубцевание, и очаги эндометриоза приобретают черную окраску. Происходящее затем фиброзирование сопровождается появлением неактивных очагов белого цвета. Морфометрическое изучение особенностей васкуляризации перитонеальных очагов наружного ГЭ различного вида дало возможность установить связь между степенью васкуляризации и активностью перитонеальных имплантов. Наибольшая степень васкуляризации и митотической активности обнаружена в очагах красного цвета, что позволило предположить высокую активность подобных очагов, которые представляют собой раннюю стадию имплантации желез и стромы эндометрия. В секреторной фазе цикла отмечается возрастание степени васкуляризации в строме и эутопического и эктопического эндометрия. Среди 12 % красных имплантов брюшины выявлены очаги гиперплазии с повышенным содержанием эндометриальных желез в сравнении со стромой. Очаги белого цвета характеризуются слабой васкуляризацией и отсутствием митозов. Следовательно, типичные
Глава 4. Патология репродуктивной системы в период зрелости
красные и белые очаги эндометриоза брюшины представляют собой различные стадии патологического процесса [181].
В соответствии с рассматриваемыми в литературе концепциями, развитию эндометриоза яичников в значительном большинстве случаев (около 90 %) способствует целомическая метаплазия инва-гинированных эпителиальных включений. Под влиянием неиденти-фицированных пока еще ФР эти включения путем метаплазии могут трансформироваться в эндометриоз яичника. Покрывающий яичник эпителий, являющийся производным целомического, обладает значительным метапластическим потенциалом и при инвагинации может индуцировать образование эпителиальных псевдокистозных образований. Вследствие накопления отделяемого активными им-плантами менструального содержимого и последующей прогрессирующей инвагинации при типичном поражении эндометриозом у 93 % больных формируются псевдокисты яичников [112].
Что касается глубокого ретроцервикального эндометриоза, то он представляет собой узелки аденомиоза, гистогенез которых связан не с регургитацией клеток эндометрия, а с метаплазией находящихся в ректовагинальной перегородке остатков мюллеровой ткани. Эти метапластические превращения остатков мюллеровой ткани в эндометриоидные железы с выраженной пролиферацией гладкой мускулатуры во многом идентичны очагам внутреннего эндометриоза матки. В таких образованиях отсутствует чувствительность к уровню эстрогенных и прогестероновых влияний, что может быть обусловлено или дефицитом ЭР и ПР, или отсутствием биологической их активности [100, 182].
В связи со значительным разнообразием эндометриодных ге-теротопий при их визуализации, по мнению подавляющего большинства исследователей, гистологическая верификация считается облигатным условием постановки диагноза ГЭ. Вместе с тем в повседневной клинической практике типичная гистологическая картина, например эндометриоза брюшины, обнаруживается далеко не во всех случаях лапароскопической визуализации макроскопически характерных очагов заболевания. В этом направлении заслуживают особого внимания данные проспективного исследования, которое было посвящено гистологическому изучению различных по виду и локализации очагов поражения брюшины — пигментированных, Рубцовых, красных, с выраженным сосудистым компонентом, из карманов брюшины, желтых и спаечных и макроскопически не-
4.5. Генитальный эндометрием
измененной брюшины. Биоптаты ткани указанных очагов диаметром около 5 см были получены у 44 пациенток в возрасте от 14 до 48 лет, подвергшихся лапароскопическому вмешательству по поводу ХТБ, дисменореи и/или диспареунии, с последующим параллельным гистологическим их исследованием несколькими независимыми экспертами. В результате проведенных исследований было выявлено некоторое несоответствие между данными гистологии и клиническими проявлениями заболевания. Так, согласно общепринятой классификации, 0 стадия была установлена в 19 наблюдениях,
I — в 6, II — в 9, III — в 5, IV — в 5, а при гистологическом ис
следовании наличие 0 стадии было отмечено в 7 случаях, I — в 10,
II — в 11, III — в11 , IV — в5 наблюдениях соответственно. В целом
же частота подобного рода отклонений при типичной визуализации
очагов эндометриоза брюшины во всех 9 локализациях была вы
явлена в 36 % наблюдений данной серии исследований, тогда как
гистологически эндометриоз был подтвержден лишь в половине из
их числа (18%). Таким образом, положительная прогностическая
значимость визуальной лапароскопической характеристики эндо
метриоза брюшины составила, в сравнении с данными гистологиче
ского исследования, 45 %, чувствительность — 97 %, отрицательная
прогностическая значимость была равна 99 % при специфичности
77%. Вместе с тем для пигментированных очагов положительная
прогностическая значимость визуальной характеристики составила
76 %, тогда как для Рубцовых — всего 22 % [215].
Рассмотренные данные следует принимать во внимание при окончательном установлении диагноза и, особенно, разработке терапевтической стратегии. Этот вопрос широко обсуждался на страницах периодической печати, и высказывалась, в частности, точка зрения о том, что лапароскопическая и гистологическая верификация не должны быть во всех случаях обязательными для назначения больным медикаментозного лечения. По мнению большинства оппонентов, эмпирическое назначение аГнРГ может оказаться целесообразным на начальных этапах обследования и лечения у больных с выраженными симптомами заболевания, что может в последующем облегчить проведение дифференциального диагноза до лапароскопического исследования. С другой стороны, при обнаружении в ходе лапароскопии атипических картин проведение гистологического исследования биоптатов приобретает особо важное значение для исключения нередко сопутствующих развитию наружного ГЭ
Глава 4. Патология репродуктивной системы в период зрелости
лютеиновых кист, злокачественного процесса, туберкулеза, эндо-сальпингита и реакции на инородные тела [112, 215].
Гистологическое исследование биоптатов эндометриоидных ге-теротопий может способствовать определению не только морфологических критериев очагов эндометриоза брюшины различной локализации, но также и прогнозированию эффективности лечебного, в том числе медикаментозного, воздействия. Так, при исследовании 412 биоптатов брюшины, полученных от 241 больной в ходе лапароскопического или лапаротомного вмешательства, были установлены особенности гистологических характеристик очагов ГЭ различной локализации, в том числе и при сравнении с эутопическим эндометрием (табл. 4.9):
1. Эндометриоидная ткань с эпителиальным компонентом состоит из клеточных элементов, подобных эутопическому эндометрию в различные фазы менструального цикла, недифференцированных клеток и иногда серозных или муци-нозных клеток мюллерового происхождения.
2. В одном и том же очаге может быть обнаружено сочетание хорошо дифференцированной и недифференцированной ткани.
3. Недифференцированные железистые структуры с наличием поверхностного эпителия или сформированных железистых и/или кистозных структур отличаются от эутопического эндометрия, но напоминают мезотелий брюшины.
4. Слабо выраженный стромальный компонент характеризуется изменениями, аналогичными эутопическому эндометрию в различные фазы менструального цикла.
5. При железистом строении смешанной дифференциации имеет место одновременное сочетание недифференцированных и хорошо дифференцированных клеточных элементов эндометрия иногда с обнаружением клеток мюллерова происхождения (серозных или муцинозных).
Согласно приведенным данным, недифференцированное строение наружного эндометриоза в сравнении с дифференцированным и стромальным вариантами чаще встречается при III—IV стадии заболевания. Смешанный и недифференцированный гистологические типы обычно обнаруживаются у пациенток с ретроцервикальным эндометриозом. По отношению же к эффективности последующего лечения болевого синдрома прогностически более благоприятными,
4.5. Генитальный эндометриоз
в сравнении с остальными, являются хорошо дифференцированный и стромальный гистотипы. Различий же в плане выраженности фактора бесплодия у больных с различными гистотипами наружного ГЭ в этом исследовании отмечено не было.
Таблица 4.9
Гистологическая характеристика наружного ГЭ различной локализации (по [94])
| Локализация | Стромальный | Хорошо дифференцированный | Смешанный | Недифференцированный | Всего |
| Брюшина | 88(34%) | 78(35%) | 43(19%) | 15(12%) | 224(100%) |
| Яичник | 21(13%) | 78 (49 %) | 44 (27 %) | 18(11%) | 161(100%) |
| Ректоваги-нальная перегородка | 4(15%) | 9(33%) | 8(30%) | 69 (22 %) | 90(100%) |
| Всего | 113(27%) | 165 (40 %) | 95 (23 %) | 39(10%) | 412(100%) |
Потенциал прогрессирования и агрессивности роста очагов эндометриоза зависит от концентрации цитокинов и простаглан-динов, которые, как известно, контролируются секрецией эстрогенов. Результаты отдельных исследований позволили установить различия в экспрессии рецепторов половых гормонов в интактной тазовой брюшине у женщин с эндометриозом и без него и, наряду с этим, отсутствие циклических изменений в экспрессии рецепторов половых гормонов при ГЭ.
Регулируемый в физиологических условиях процесс программированной клеточной гибели — апоптоз — при микроскопическом исследовании характеризуется сморщиванием клеток, конденсацией хроматина и образованием маленьких сферических окруженных мембранами органелл, апоптотических телец с фрагментацией ДНК. В железистом эпителии эндометрия человека апоптоз обнаруживается преимущественно в секреторной фазе цикла. Регуляция процесса апоптоза связана с экспрессией ряда генов — с-тус, р53 и apo-lifa. Однако более полное представление о механизме апопто-тической клеточной гибели дают результаты изучения экспрессии специфического семейства онкогенных белков-репрессоров этого процесса, кодируемых геном Ьс12, который отчасти блокирует апоптоз, обеспечивая выживание клеточных элементов в различных
Глава 4. Патология репродуктивной системы в период зрелости
тканях. Изучение роли апоптоза в патобиологии различных форм ГЭ проводится обычно путем сравнения степени его выраженности в экто- и эутопическом эндометрии. Одно из подобных сравнительных исследований было осуществлено в образцах гистологически верифицированной ткани, полученной от 25 женщин с наружным эндометриозом (37,9 ± 8,1 лет) и 31 больной старшей возрастной группы с аденомиозом (52,1 ± 10,9 года). Значимых различий в частоте обнаружения ьс/2-положительного белка в ткани аденомиоза и эндометриоза яичников обнаружено не было, вместе с тем при отсутствии различий в экспрессии его в различные фазы цикла у больных наружным эндометриозом различия между фолликулино-вой и лютеиновой фазами цикла при аденомиозе были существенно значимыми (р < 0,001). Полученные данные подтвердили различный патогенез сравниваемых форм ГЭ и позволили высказать предположение о том, что наличие постоянной экспрессии Ьс12 и Ьах в ткани эндометриоидных гетеротопий в яичниках на протяжении всего менструального цикла может способствовать сохранению и выживанию ткани эндометриоидных имплантов в этой области [139].
Сравнение количественных характеристик апоптоза в эу- и эктопическом эндометрии при аденомиозе было проведено путем определения показателей апоптотического индекса (по числу выявленных при одновременном подсчете его двумя независимыми специалистами в 1000 клеток в > 10 рандомизированно выбранных полях зрения в каждом случае), выраженного с помощью балльной шкалы при определении экспрессии Ьс12 или в процентах при определении Ki-67. Приведенные в табл. 4.10 данные свидетельствуют об отличии биологических свойств эктопического эндометрия в ткани аденомиоза от таковых в эутопическом эндометрии тех же больных. Экспрессия ингибитора апоптоза Ьс12 увеличена в эктопическом эндометрии и в перитонеальной жидкости у женщин с эндометриозом по сравнению с эутопическим эндометрием и перитонеальной жидкостью женщин без эндометриоза. Эндометрий здоровых женщин восприимчив к апоптозу в большей степени, чем эндометрий страдающих эндометриозом женщин [170].
При ГЭ, так же как и при других гиперпластических процессах репродуктивной системы женщины, была изучена экспрессия ряда факторов ауто- и паракринной систем [168, 169]. Молекулярно-био-логические характеристики биоптатов наружного ГЭ, полученных
4.5. Генитальный эндометриоз
на 18—21-й день менструального цикла, были изучены у 4 женщин с эндометриоидными кистами яичников, у 2 с эндометриоидным раком яичников, у 7 с эндометриозом тазовой брюшины и у 3 с ретроцервикальным эндометриозом. Общим патогномоничным феноменом для всех рассмотренных локализаций, так же как и для эу-топического эндометрия, явилась экспрессия ИПФР-1 и его рецепторов (в 100 % наблюдений). В то же время ИПФР-2 был выявлен в 3/4 наблюдений в цитоплазме и реже в ядрах эпителиальных клеток, цитогенной строме очагов эндометриоза, фибробластах и эндотелии сосудов. Полученные данные явились отражением общности процессов гистогенеза эндометриоидных очагов и эутопического эндометрия данной группы больных. Концентрация рецепторов ИПФР-1 в фолликулиновой фазе цикла выше в очагах аденомиоза и миометрии в сравнении с эутопическим эндометрием, тогда как концентрация ядерных ЭР и ПР характеризуется наиболее высоким их содержанием в течение и фолликулиновой, и лютеиновой фазы цикла.
Таблица 4.10
Корреляция показателей апоптотического индекса (баллы, М ± SD)
Дата добавления: 2016-07-09; просмотров: 1045;
