Синдром поликистозных яичников 10 страница
В современных условиях при обследовании больных ЛМ используется широкий спектр специальных методов исследования — ультразвуковых, рентгенологических, эндоскопических и др. Наиболее распространенным (практически облигатным) стал ультразвуковой метод, который открывает возможности для определения размера опухоли, динамического контроля за темпом ее роста и эффективностью адъювантного лечения. УЗИ с помощью влагалищного датчика принято производить в целях одновременной и объективной оценки состояния эндометрия в пределах 5—7-го дня менструального цикла. Метод наиболее информативен при межмышечной и подбрюшинной локализации опухоли, причем изменения внутренних структур миометрия при таких дегенеративных процессах, как гиалиновая дегенерация, некроз, обызвествление, способствуют появлению неравномерно расположенных отражений акустических сигналов. Метод УЗИ оказывает существенную помощь в выявлении внутреннего эндометриоза матки. Следует однако помнить, что УЗ-сканирование, будучи ценным диагностическим методом, является вместе с тем только вспомогательным методом исследования. В связи с этим рациональное его применение требует предварительной клинической ориентации в отношении локализации, формы и консистенции узлов опухоли и состояния придатков матки. Только в этих условиях удается получить исчерпывающую информацию, необходимую для решения вопросов стратегии и тактики.
В последние годы, особенно после введения в клиническую практику с лечебной целью метода эмболизации маточных сосудов, большое значение приобрело УЗИ маточного кровотока, которое используется и для диагностики, и для оценки эффективности
4.4. Лейомиома матки
лечебного воздействия. Одним из вариантов метода является УЗИ с дуплексным ангиосканированием, позволяющее получать одновременное изображение сосуда в двухмерной проекции и доппле-ровских кривых скоростей кровотока с цветным допплеровским картированием на мультичастотном аппарате Acuson 128 (Р/10) при использовании влагалищного датчика частотой 7 МГц.
Сравнение диагностической значимости метода трансвагинального УЗИ и все больше входящего в клиническую практику метода магнитного резонанса (MP) при обследовании больных со сравнительно небольшим размером опухоли показало сходные результаты. По результатам сопоставления точности последовательного использования этих методов перед гистерэктомией в рамках двойного слепого исследования 106 женщин пременопаузального возраста, узлы ЛМ были обнаружены с одинаковой точностью при использовании каждого из этих методов: для MP чувствительность метода составила 0,99, специфичность 0,86; для трансвагинального УЗИ — 0,99 и 0,91 соответственно. Результаты оказались идентичными при наличии в матке от 1 до 4 узлов опухоли и общем ее объеме < 375 мл. При использовании УЗ-контроля с целью объективной оценки размера матки используются формулы, предложенные для вычисления размеров эллипсовидных опухолей [87]. При сопоставлении величины матки в см3 с общепризнанными размерами, соответствующими срокам беременности в неделях, как уже указывалось, может быть использована специальная таблица [66].
УЗ-сканирование может быть использовано и непосредственно в процессе оперативного вмешательства (интраоперационная уль-трасонография) с целью выявления макроскопически не определяемых узлов опухоли, что имеет значительную ценность особенно у страдающих бесплодием женщин, так как макроскопически во время операции не всегда идентифицируются узлы опухоли диаметром около 2 см межмышечной и межмышечно-подбрюшинной локализации [4, 88]. Объективную информацию о локализации и размерах ЛМ позволяют получить также и разнообразные методы рентгенологического исследования, детальное описание которых можно найти в более ранних наших руководствах. Вместе с тем в последние годы рентгенопельвиография, флебография и гистерогра-фия все чаще уступают место более совершенным методам — ядерному магнитному резонансу, различным малоинвазивным методам эндоскопического исследования и др.
Глава 4. Патология репродуктивной системы в период зрелости
Схематическое изображение контуров полости матки при различной локализации узлов ЛМ представлено на рис. 4.12 [55], а на рис. 4.13 — при внутреннем эндометриозе, представление о которых играет важную роль в процессе проведения дифференциального диагноза. При подслизистом или межмышечном расположении узлов с центрипетальным ростом, исходящих из передней или задней стенки матки ближе к одному из трубных ее углов, полость матки асимметрична, с удлинением, расширением и закруглением одного из углов, иногда с участками просветления. При центральном расположении подслизистого узла, исходящего из передней или задней стенки матки, контуры полости имеют округлую форму с участками просветления или дефектами наполнения, которые более четко выявляются при нетугом заполнении полости матки контрастным веществом. Чашеобразная форма полости с неровными контурами в дне, дефектами наполнения или участками просветления более характерна для подслизистого узла опухоли, исходящего из передней или задней стенки ближе к дну матки. При расположении подслизистого узла ближе к области внутреннего зева полость матки приобретает треугольную форму с закругленными боковыми контурами. Вытянутая форма полости матки со смещением в сто-
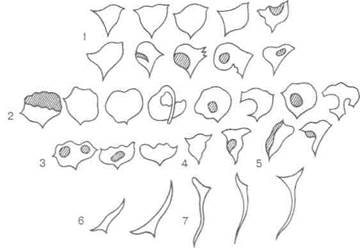
Рис. 4.12. Схематическое изображение контуров полости матки при различной локализации миоматозных узлов
| 4.4. Лейомиома матки |
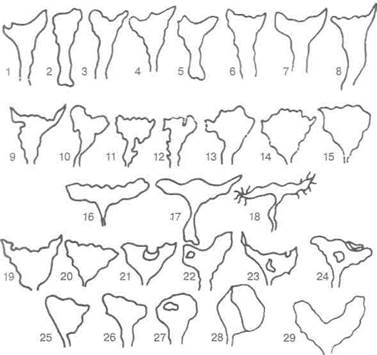
Рис. 4.13. Схематическое изображение контуров полости матки при внутреннем эндометриозе матки
рону и дефектом наполнения по боковому контуру с выпячиванием и закруглением противоположного контура характерна для узлов подслизистой локализации, исходящих из ребра матки, тогда как серповидная или в виде полумесяца форма отмечается при межмышечных узлах большого размера, располагающихся в дне матки.
Для уточнения состояния репродуктивной системы при ЛМ все чаще прибегают, как уже указывалось, к использованию метода MP, дающего возможность количественного определения интенсивности сигналов и, тем самым, размеров исследуемого объекта. Метод получил распространение при обследовании пациенток после артериальной эмболизации a. uterinae, так как при этом характеристика интенсивности сигналов дает возможность оценить кровоснабжение узлов опухоли и прилежащего миометрия. Изменение сигналов
Глава 4. Патология репродуктивной системы в период зрелости
свидетельствует о развитии геморрагических инфарктов и снижении интенсивности кровоснабжения в ткани опухоли и миометрия.
Краткий перечень патологических состояний и клинических признаков, характерных для ЛМ, так же как и сопутствующих ее развитию других патологических состояний репродуктивной системы, и необходимость дифференциации с угрожающими жизни онкологическими заболеваниями требуют детальной оценки состояния всех отделов репродуктивной системы женщины, особенно яичников и эндометрия, как в периоде выявления опухоли, так и в ходе динамического наблюдения и/или в периоде предоперационного обследования. Особо важное практическое значение имеет адекватное проведение дифференциального диагноза между ЛМ, внутренним эндометриозом и саркомой матки.
Основанием для предположения о сочетании ЛМ с внутренним эндометриозом матки (аденомиозом) может служить выявление на фоне типичной для ЛМ картины заболевания характерных для эндометриоза клинических проявлений, которые представлены в разд. 4.5.
Все большее распространение при обследовании состояния различных отделов репродуктивной системы у больных ЛМ получают эндоскопические методы исследования — лапаро-, кульдо-, гистеро- и кольпоцервикоскопия. Что касается гистероскопии, то целесообразность и эффективность ее использования в целях диагностики и лечения при ЛМ убедительно продемонстрирована многими исследователями [85]. Применение гистероскопии в комплексе с другими методами позволяет существенно снизить процент диагностических ошибок и своевременно выбрать рациональный метод лечебного воздействия. Учитывая, что гистероскопическому исследованию подвергаются лишь отдельные больные с ЛМ, которые страдают главным образом кровотечениями, в общий план обследования больных, особенно при консервативно-выжидательной тактике ведения, рекомендуется включать систематическое исследование состояния эндометрия (цитологическое исследование содержимого полости матки, гистологическое исследование соскоба слизистой оболочки шейки и тела матки, полученного как с помощью обычного выскабливания под гистероскопическим контролем, так и путем вакуум-кюретажа).
Вариабельность клинического течения заболевания при ЛМ и нередкая необходимость длительного наблюдения за использо-
4.4. Лейомиома матки
ванием различных методов адъювантного медикаментозного воздействия с целью торможения роста опухоли делают особенно значимым соблюдение принципа онкологической настороженности с адекватным проведением дифференциального диагноза. Одной из наиболее острых проблем в этом направлении является необходимость исключения лейомиосаркомы матки, при которой отмечается сходство ряда клинических проявлений с симптомами, обусловленными ЛМ матки.
Результаты клинических наблюдений на протяжении последних десятилетий свидетельствуют о том, что саркома матки встречается у 1 из 250—400 женщин, наблюдающихся по поводу ЛМ; среди же всех злокачественных опухолей матки частота сарком равна 3— 5 %, или 1,7:100 000, женщин от 20 лет и старше. В последние годы появились отдельные сообщения относительно парадоксального (эстрогенного) эффекта тамоксифена — в виде развития ЛМ — при длительной адьювантной терапии больных раком молочной железы в постменопаузальном периоде. Проведению дифференциального диагноза между ЛМ и лейомиосаркомой матки может способствовать использование ангиографии, пункционной биопсии, доппле-рометрии, ядерного магнитного резонанса и, особенно, позитрон-ной эмиссионной томографии, а среди иммуногистохимических маркеров — определение Ki-67, p53 и ПР.
Соответствующий алгоритм обследования для определения стратегии и тактики при различных формах и моделях ведения больных ЛМ с позиций доказательной медицины приведен в пособии для врачей [87] соответственно четырем формам этого заболевания по Международной классификации болезней 10-го пересмотра:
D25.0 — подслизистая лейомиома.
D25.1 — интрамуральная лейомиома.
D25.2 — субсерозная лейомиома.
D25.3 — лейомиома матки неуточненная.
Таким образом, эффективность лечения больных ЛМ определяется рациональным построением диагноза, который, кроме непосредственного выявления опухоли и основных ее характеристик, требует уточнения формы роста, определения размера и темпа ее развития. Важное значение имеет оценка состояния всех отделов репродуктивной системы и сопутствующих развитию опухоли гинекологических и общесоматических заболеваний. В каждом конкретном случае должен быть определен минимальный спектр диагности-
Глава 4. Патология репродуктивной системы в период зрелости
ческих тестов, необходимый для постановки диагноза, осуществления динамического контроля за течением патологического процесса и оценки эффективности проводимых лечебно-профилактических мероприятий.
Адъювантная терапия.Становление адъювантной терапии при ЛМ имеет длительную историю, хронология которой совпадает с созданием лекарственных соединений, способных оказывать воздействие на различные структуры репродуктивной системы женщины — от гормонально-чувствительных тканей органов-мишеней до гипоталамических центров. Этот широкий спектр лекарственных соединений включает агонисты и/или антагонисты половых гормонов — гестагены, антигестагены, антиэстрогены, антигонадотропи-ны и аГнРГ. Общим патофизиологическим феноменом, воспроизведение которого необходимо для достижения эффекта торможения роста и/или уменьшения размеров опухоли, являются временное и обратимое угнетение функции яичников и, в большинстве случаев, десенситизация гипофиза и наступление псевдоменопаузы. Определение гормональной чувствительности опухоли позволяет определить перспективы использования разнообразных препаратов на уровень содержания ЭР и ПР в ткани опухоли и служит основой антигормональной стратегии при ЛМ.
Современная терапевтическая концепция требует особого внимания к периоду раннего выявления опухоли. Успех назначения адъювантного медикаментозного воздействия в раннем периоде развития опухоли как в отношении симптомов заболевания, так и тормозящего влияния на рост опухоли определяется своевременным выявлением сопутствующей гинекологической и экстрагенитальной патологии, коррекцией нарушенных гормональных соотношений и волемических и метаболических нарушений.
Прогестагены. С этим классом гормональных препаратов связаны первые попытки адъювантного воздействия при ЛМ. По химической структуре вошедшие в клиническую практику прогести-ны являются производными С21 (прогестерон, ретропрогестерон и эфиры 17а-ОП), С19 (лишенные метильной группы в 19-м положении производные тестостерона) и эфиры нороксипрогестерона (норэтиндрон, примолют-нор, норколют, норэтистерона ацетат) и С18 (производные нортестостерона и дезоксинортестостерона) стероидов. Два вида фармакодинамического эффекта прогестинов привлекают к себе внимание в связи со стремлением оказать путем
4.4. Лейомиома матки
их применения тормозящее влияние на рост опухоли — это свойственные им антиэстрогенный и антифиброматозный эффекты.
Наш опыт применения прогестагенов основан на анализе наблюдений 434 пациенток 22—44 лет (средний возраст— 34,6 ± 0,-6 лет), из которых 209 больных имели ЛМ небольшого размера, 57 — гиперплазию или полипы эндометрия. Различными сочетаниями указанных гиперпластических процессов эндо- и миометрия, включая и начальные стадии внутреннего эндометриоза матки, страдали 168 пациенток. Клинический эффект норэтистерона (НЭТ) был изучен у 317 женщин, который назначался в дозе 5 мг с 16-го по 25-й день цикла в 1-6, 10-15, 20-25-м менструальных циклах в сочетании с другими воздействиями. В дни приема препарата больным назначали средства, защищающие желудочно-кишечно-печеноч-ный комплекс (подогретые минеральные воды, свежеприготовленные овощные соки, а также мочегонные препараты на день отмены норколута на фоне общего соблюдения диетического режима), а в перерывах между курсами гормонотерапии — комплекс витаминов группы В в первой и группы А и С во второй половине цикла. В комплекс лечебных мероприятий также был включен 3-месячный цикл приема микродоз нейролептических препаратов [23].
Положительное влияние различных аналогов норстероидов (норколут, примолют-нор) обусловлено их многосторонним биологическим эффектом, включающим воздействия не только на отдельные звенья репродуктивной системы женщины, но и на ми-нералокортикоидную функцию надпочечников. Тенденция к торможению роста была отмечена в 41 % наблюдений, а уменьшение объема опухоли — в 46 %. В процессе лечения у всех женщин имел место стабильный менструальный цикл продолжительностью от 27 до 30 дней. Кровотечения отмены во всех случаях, кроме 4 наблюдений, наступали в течение 48—72 ч после отмены препарата, а характер и продолжительность менструальноподобных кровотечений не отличались от параметров нормальной менструации. На фоне приема НЭТ отмечено существенное снижение содержания в плазме периферической крови трех основных стероидных гормонов (Э2, прогестерон, тестостерон), секретируемых тканью яичников, со сдвигом гормональных соотношений в сторону относительного преобладания андрогенов, причем снижение концентрации Э2 и прогестерона происходило преимущественно у пациенток с высоким содержанием их в исходном цикле обследования (рис. 4.14). Вместе
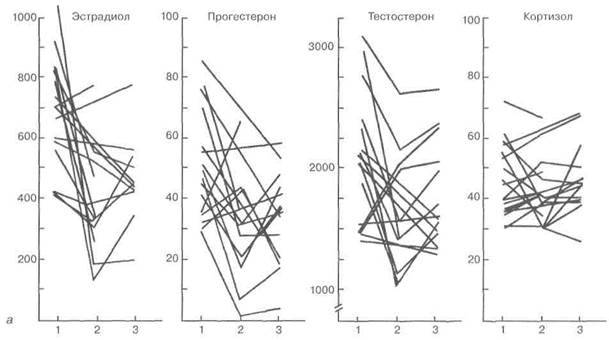
Рис. 4.14. Влияние НЭТ на секрецию половых стероидов (а) (1 — до лечения; 2 — цикл лечения; 3 — цикл отмены) и концентрацию Э2 в крови и Э2 и его рецепторов в цитозоле эндометрия (б) (/ — до лечения; 2 — цикл
отмены) больных миомой матки репродуктивного возраста

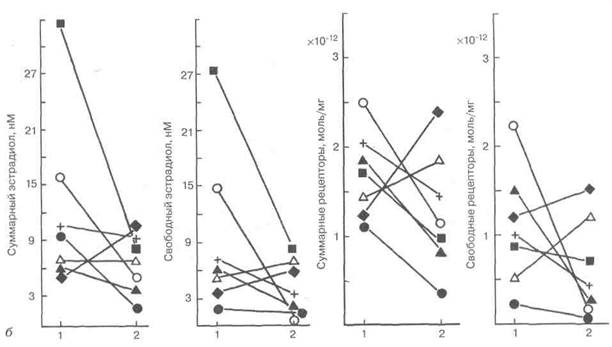
Рис. 4.14. Окончание
Глава 4. Патология репродуктивной системы в период зрелости
с тем практически у всех пациенток с недостаточностью лютеиновой фазы цикла и у части больных с ановуляцией произошло восстановление свойственных нормальной циклической гормональной секреции яичников и строения эндометрия [23]. Чувствительность ткани ЛМ к гормональным воздействиям, в частности после предоперационного назначения НЭТ, была показана при изучении образцов ткани узлов ЛМ у 22 пациенток с опухолью, подвергшихся операции во второй половине цикла за 1—2 дня до ожидаемой менструации (рис. 4.15). У больных, не получавших гормонального лечения, ЭР+ оказались 50 % исследованных образцов, ПР+ и ГР+ — свыше 60 %, АР+ — 16,7 %. Все 4 вида рецепторов обнаружены одновременно в 16,7 % исследованных образцов опухоли [55].
Кроме описанных выше клинических эффектов НЭТ, наш практический опыт позволяет отнести к числу наиболее существенных результатов воздействие на состояние матки при ЛМ под влиянием этого препарата. В процессе достаточно длительного назначения НЭТ (до 6—8 мес.) в циклическом режиме и в умеренных дозах нередко удается наблюдать изменения консистенции и конфигурации матки. Постепенно выявляется пальпаторно более четкая дифференциация узлов опухоли от окружающего неизмененного миометрия, а также нередко и их миграция на фоне нормализации морфофункциональных особенностей миометрия. Соответственно этому меняются и клинические проявления заболевания: эксцентрическое смещение узлов сопровождается сокращением объема менструальной кровопотери, уменьшением анемии и исчезновением болевых ощущений. Феномен более четкой дифференциации опухоли перед оперативным вмешательством существенно облегчает выполнение миомэктомии и делает ее более эффективной. Отсутствие эффекта чаще наблюдается при срединном расположении узлов опухоли в миометрии или центрипетальном их росте и требует изменения врачебной тактики. Благоприятное воздействие на волемические параметры кровообращения и показатели водно-минерального обмена являются дополнительным свидетельством целесообразности применения прогестинов норстероидного ряда как в процессе диспансерного наблюдения, так и в ходе подготовки к миомэктомии пациенток репродуктивного возраста при умеренных размерах узлов опухоли и неизмененной конфигурации полости матки [21]. У женщин переходного возраста, страдающих дисфункциональными маточными кровотечениями, предпочтение отдается
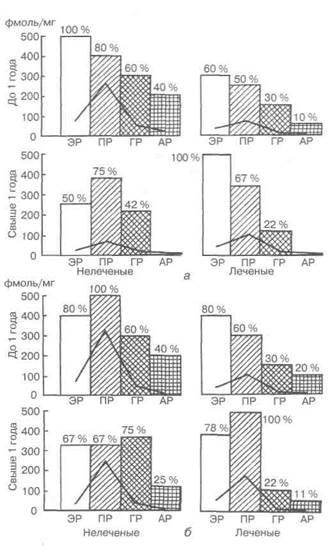
Рис. 4.15.Среднее содержание рецепторов стероидных гормонов (сплошная линия) и доля рецепторположительных опухолей и мио-метрия у больных, получавших и не получавших гормональное лечение
(по [55]):
а — без опухоли матки; б— при наличии миомы матки; ЭР— эстрогенные рецепторы; ПР— прогестероновые рецепторы; ГР— глюкокортикоидные рецепторы; АР— андрогеновые рецепторы
Глава 4. Патология репродуктивной системы в период зрелости
кратковременному назначению прерывистых курсов (в пределах 3 мес.) комбинированных эстроген-гестагенных соединений.
Антипрогестагены. Несмотря на клинический эффект, достигаемый при применении прогестинов, так же как и аГнРГ, у пациенток с ЛМ матки, длительное применение этих препаратов ограничено из-за риска развития разнообразных побочных эффектов, обусловленных развивающейся гипоэстрогенией и, соответственно, повышением риска метаболических нарушений, сердечно-сосудистых заболеваний и остеопороза. Попытки преодоления и предупреждения симптомов развивающейся гипоэстрогении путем дополнительного назначения препаратов половых стероидных гормонов по типу ЗГТ в значительной степени нивелируют желаемый клинический эффект и существенно снижают степень уменьшения размеров опухоли. Между тем признание прогестероновой гипотезы в инициировании каскада молекулярно-генетических процессов, свидетельствующей о существенной роли прогестерона и его рецепторов в процессе роста и развития опухоли, послужило основанием для использования антипрогестинов в целях воздействия на ЛМ. Как известно, первым препаратом этого ряда из числа вошедших в клиническую практику явился мифепристон (RU-486), что явилось важным этапом в развитии репродуктивной эндокринологии. В последующем были запатентованы и другие аналоги антипрогестагенных препаратов (онапристон, лилопристон, пенкрофтон).
В клинической практике мифепристон, представляющий собой 1 ip-диметил-амино-фениловое соединение с высокой степенью сродства к ПР и ГР, являющийся поэтому потенциальным антагонистом этих гормонов и, как известно, часто используемый для медикаментозного прерывания беременности, получил широкое применение. Побочные эффекты мифепристона выражены слабо и обусловлены преимущественно антиглюкокортикоидными воздействиями. Клинический же эффект мифепристона нашел применение в качестве адъювантного средства при лечении гормонозави-симых опухолей и нарушений репродуктивной системы женщины, которые резистентны к химиотерапевтическим и радиационным воздействиям.
Большинство исследователей пришли к выводу, что оптимальной дозой мифепристона, позволяющей уменьшить в течение 12 нед. объем опухоли на 50 %, является доза 25 мг/сут. При целенаправленном сопоставлении эффективности меньших доз мифе-
4.4. Лейомиома матки
пристона (10 и 20 мг), назначаемых больным с симптомной ЛМ с 1-3-го дня менструального цикла (одновременно с возникновением нарушений функции яичников), у пациенток обеих групп исчезли болевые ощущения внизу живота и отмечалось повышение гемоглобина. Степень уменьшения величины матки после приема исследованных двух доз мифепристона в течение 12 нед. оказалась практически одинаковой: 41,4% при приеме 10 мг/сут и 43,0% — 20 мг/сут. Однотипными оказались и побочные явления. На основе этих исследований было сделано заключение о целесообразности назначения 10 мг мифепристона в качестве суточной дозы для лечения больных со значительным размером опухоли, для предоперационной подготовки анемизированных больных и/или в качестве основного метода лечения женщин перименопаузального возраста с симптомной лейомиомой. Наряду с этим в литературе встречаются упоминания о положительном эффекте использования на протяжении 3 мес, наоборот, более высоких дозировок препарата — до 50 мг/сут, что свидетельствует о необходимости индивидуального подбора суточных доз препарата.
При сопоставлении клинического эффекта мифепристона (25 мг/сут) и леупролида ацетата (3,75 мг/мес. внутримышечно) при оценке воздействия на размер опухоли методом цветной допплеро-метрии было отмечено более значимое повышение индекса резистентности в a. uterinae под влиянием мифепристона в сравнении с леупролида ацетатом — на 40 и 21 % соответственно. Полученные данные позволили сделать заключение о том, что снижение кровотока в a. uterinae является одним из основных патогенетических механизмов, способствующих под влиянием лечебного воздействия уменьшению величины матки и объема кровопотери у больных ЛМ во время операции. В другом сравнительном исследовании, продолжавшемся также 3 мес, была продемонстрирована эффективность меньших доз мифепристона (12,5 мг/сут) в сравнении с агонистами ГЛ (150 мкг аГнРГ подкожно ежедневно). Количество пациенток с уменьшением размеров ЛМ в пределах > 20 % было идентичным в каждой из этих когорт — 90 и 91,1 %. Однако по прекращении медикаментозного воздействия исходная величина узлов опухоли восстановилась у заметно большего числа пациенток, получивших аГнРГ, нежели мифепристон — в 40 и 17,8% наблюдений соответственно.
Клинический эффект мифепристона у больных ЛМ реализуется на фоне снижения гормональных влияний до уровня фазы роста
Глава 4. Патология репродуктивной системы в период зрелости
и созревания фолликула (р < 0,001) и более существенного снижения содержания ЭР и ПР в ткани опухоли экспериментальной группы больных в сравнении с группой контроля. В этой серии исследований под влиянием назначения мифепристона в дозе 25 мг/сут в течение 90 дней 20 больным с ЛМ, в сравнении с идентичной по основным клиническим параметрам контрольной группой также из 20 человек, было установлено снижение величины ЛМ на 37,3 ± 19,0%, а общего объема матки — на 27,4 ± 21,9%. У большей части пациенток уменьшение размеров опухоли сочеталось с существенным снижением уровня содержания ПР [216].
Агонисты гонадолиберина. Как известно, ГЛ (или ГнРГ) является декапептилом и секретируется в гипофизиотропной зоне гипоталамуса в цирхоральном пульсирующем ритме с интервалом в 90 мин. Достигая передней доли гипофиза через систему портальных сосудов, ГнРГ связывается со специфическими рецепторами на мембране гонадотрофов и стимулирует синтез и освобождение гонадотроп-ных гормонов, которые в свою очередь стимулируют стероидогенез в яичниках. В то время как пульсирующие выбросы ГЛ поддерживают секрецию гонадотропных гормонов, длительное применение производных ГЛ, обладающих свойствами агонистов, приводит к утрате чувствительности рецепторов гипофиза с последующей его десенситизацией, быстрым снижением интенсивности секреции гонадотропных гормонов и развитием обратимого гипоэстрогенного состояния — псевдоменопаузы. Медикаментозная псевдоменопауза после начала приема данной группы препаратов наступает в течение первых 2—6 нед., что и используется в гинекологической клинике для лечения различных гормонозависимых состояний — ЛМ, эндо-метриоза, ППС, СПКЯ и предменструального синдрома.
Последние два десятилетия характеризуются пристальным вниманием к изучению особенностей фармакодинамического эффекта аГнРГ при ЛМ. Разнообразные препараты аГнРГ назначаются при ЛМ как с целью обратного развития сопутствующих клинических проявлений, так и, главным образом, для уменьшения величины опухоли. Достигаемый при этом эффект имеет преимущества для производства миомэктомии любым хирургическим доступом в связи с уменьшением объема опухоли и улучшением обзора операционного поля вследствие снижения кровотока в a. uterinae и уменьшения объема кровопотери во время операции. Данная группа препаратов используется не только в качестве адъювантного воздействия перед
4.4. Лейомиома матки
хирургическим вмешательством, но также (с определенными ограничениями) и в виде длительной монотерапии. Последняя может быть назначена пациенткам при наличии абсолютных противопоказаний к оперативному вмешательству или при стремлении избежать его у женщин репродуктивного возраста. Однако к настоящему времени одним из основных показаний для клинического применения аГнРГ является предоперационная подготовка, которая существенно облегчает производство гистер- и миомэктомии.
После установления структуры эндогенного ГЛ было синтезировано большое количество аналогов с различными модификациями его молекулы путем замещения аминокислот в различных положениях. В результате преобразований в пептидной цепи в положении
6 или 10 аминокислотной структуры ГЛ были созданы аналоги, ха
рактеризующиеся большей активностью с усилением специфиче
ских его свойств в 40—200 раз в сравнении с нативным (эндогенным)
гормоном. Образующийся после связывания с рецепторным белком
комплекс, являющийся аГнРГ, проникает в гонадотропные клетки
гипофиза и включается в механизмы, обеспечивающие основу его
десенситизации и развивающегося в последующем гипогонадизма.
После внутримышечного введения 3,75 мг депо-формы аГнРГ концентрация ЛГ и ФСГ в крови стремительно возрастает, достигая максимума через 4 ч с постепенным снижением ее ниже нормального уровня в течение последующих 2 нед. Концентрация ЛГ остается ниже порога чувствительности метода определения в течение
7 нед., уровень содержания ФСГ в плазме периферической крови
восстанавливается до уровня ранней фолликулиновой фазы цикла.
Биологическая же активность гормона, судя по распространенной
точке зрения, при этом не меняется. Повышенное высвобождение
гонадотропинов сопровождается возрастанием концентрации Э2 в
середине и конце фазы роста и созревания фолликула, после чего
последняя снижается до уровня, наблюдающегося в постменопаузе,
и сохраняется таковой после введения однократной дозы препарата
до 6-й недели. Полная же деградация одной полимерной микросфе
ры большинства депо-препаратов происходит в течение 30—35 дней.
Повторное введение препарата в депо-форме вызывает устойчивое
подавление функции гипофиза.
Основным компонентом в механизме клинического эффекта аГнРГ является гипоэстрогения, на фоне которой проявляется сочетание ряда воздействий: среди них преобладают уменьшение кровос-
Глава 4. Патология репродуктивной системы в период зрелости
набжения матки вследствие прямой блокады находящихся в стенке a. uterinae гормональных рецепторов и связывание активного соединения со специфическими рецепторными белками непосредственно в ткани опухоли. В клинической практике используются различные способы введения препаратов аГнРГ — подкожный, внутримышечный, интраназальный. В большинстве препаратов агонист растворен в полимерных сферических микрочастицах [поли(DL-лактид-когликолиле)], которые разлагаются в организме. Определенные преимущества имеют депо-препараты, которые обеспечивают высвобождение активного ингредиента в основном на протяжении 4 нед., хотя следы препарата обнаруживаются и в более поздние сроки после его введения. Этот уровень ЛГ сохраняется, судя по данным литературы, в течение 7 нед., тогда как концентрация ФСГ имеет тенденцию к восстановлению до уровня, характерного для ранней фазы роста и созревания фолликула. Лечение начинают со 2—5-го дня менструального цикла, а методом выбора является назначение депо-форм аГнРГ в дозе 3,75 мг каждые 4 недели.
Дата добавления: 2016-07-09; просмотров: 766;
