Опишите физико – химические свойства белковых молекул. 2 страница
2. Дайте определение коферментов и простетических групп:
Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента. Комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента. Роль коферментов нередко играют витамины или их метаболиты (чаще всего — фосфорилированные формы витаминов группы B). Например, коферментом фермента карбоксилазы является дифосфотиамин, коферментом многих аминотрансфераз — пиридоксаль-6-фосфат.
Простетическая группа — небелковый (и не производный от аминокислот) компонент, связанный с белком, который выполняет важную роль в биологической активности соответствующего белка. Простетические группы могут быть органическими (витамины, углеводы, липиды) или неорганическими (например, ионы металлов). Простетические группы прочно связаны с белками и даже могут быть присоединены ковалентными связями. Часто играют важную роль в функционировании ферментов. Белок без простетической группы называется «апобелок», а белок с присоединенной группой — «холобелок» (или, соответственно, в случае ферментов — апофермент и холофермент). Примером может являться гем, который является простетической группой в молекуле гемоглобина. Простетические группы — это подкласс кофакторов. Они отличаются от коферментов тем, что простетические группы постоянно связаны с ферментами, в то время как коферменты связаны с ферментами непостоянно.
3. Как устроен активный центр ферментов?
Активный центр — особая часть молекулы фермента, определяющая её специфичность и каталитическую активность. Активный центр непосредственно осуществляет взаимодействие с молекулой субстрата или с теми её частями, которые непосредственно участвуют в реакции. Характер взаимодействия фермента и субстрата говорит о наличии в активном центре ряда структурных групп, соединяющихся с различными участками субстрата. Взаимодействие между активным центром фермента и молекулой субстрата осуществляется при их сближении на расстояние порядка 15—20 ангстрем, с увеличением расстояния оно быстро ослабевает (хотя среди различных ферментов могут иметь место вариации).
Активный центр фермента (схема) (по Малеру и Кордесу).
4. Напишите схему механизма ферментативного катализа. Одно время считалось, что ферментативный катализ принципиально отличается от небиологического Катализа, широко используемого в химическом производстве. Такое представление основывалось на трёх отличительных особенностях ферментативного катализа: исключительно высокой эффективности (увеличение скорости реакции в 1010–1013 раз) и специфичности, т. е. избирательности (способности каждого фермента катализировать превращение строго определённых биологических субстратов, иногда лишь единственного вещества, в единственном направлении), не достижимых в небиологическом катализе. Особенностью ферментативного катализа является также его регулируемость – способность биокатализатора – фермента – увеличивать или уменьшать свою активность в зависимости от потребностей организма. Однако исследование механизма ферментативного катализа показывает, что к нему применимы законы и принципы, на которых основаны обычные химические реакции. Отличие реакций ферментативного катализа определяется сложностью структуры ферментов и химических превращений, которые совершают вещества в ходе катализа.
5. Опишите свойства ферментов.
1. Влияние на скорость химической реакции: ферменты увеличивают скорость химической реакции, но сами при этом не расходуются. Скорость реакции – это изменение концентрации компонентов реакции в единицу времени. Если она идет в прямом направлении, то пропорциональна концентрации реагирующих веществ, если в обратном – то пропорциональна концентрации продуктов реакции. Отношение скоростей прямой и обратной реакций называется константой равновесия. Ферменты не могут изменять величины константы равновесия, но состояние равновесия в присутствии ферментов наступает быстрее.
2. Специфичность действия ферментов. В клетках организма протекает 2-3 тыс. реакций, каждая из которые катализирутся определенным ферментом. Специфичность действия фермента – это способность ускорять протекание одной определенной реакции, не влияя на скорость остальных, даже очень похожих.
Различают:
· Абсолютную – когда Ф катализирует только одну определенную реакцию (аргиназа – расщепление аргинина)
· Относительную (групповую спец) – Ф катализирует определенный класс реакций (напр. гидролитическое расщепление) или реакции при участии определенного класса веществ.
Специфичность ферментов обусловлена их уникальной аминокислотной последовательностью, от которой зависит конформация активного центра, взаимодействующего с компонентами реакции.
Вещество, химическое превращение которого катализируется ферментом носит название субстрат (S).
3. Активность ферментов – способность в разной степени ускорять скорость реакции. Активность выражают в:
1) Международных единицах активности – (МЕ) количество фермента, катализирующего превращение 1 мкМ субстрата за 1 мин.
2) Каталах (кат) – количество катализатора (фермента), способное превращать 1 моль субстрата за 1 с.
3) Удельной активности – число единиц активности (любых из вышеперечисленных) в исследуемом образце к общей массе белка в этом образце.
4) Реже используют молярную активность – количество молекул субстрата превращенных одной молекулой фермента за минуту.
Активность зависит в первую очередь от температуры. Наибольшую активность тот или иной фермент проявляет при оптимальной температуре. Для Ф живого организма это значение находится в пределах +37,0 - +39,0 °С, в зависимости от вида животного. При понижении температуры, замедляется броуновское движение, уменьшается скорость диффузии и, следовательно, замедляется процесс образования комплекса между ферментом и компонентами реакции (субстратами). В случае повышения температуры выше +40 - +50 °С молекула фермента, которая является белком, подвергается процессу денатурации. При этом скорость химической реакции заметно падает (рис.).
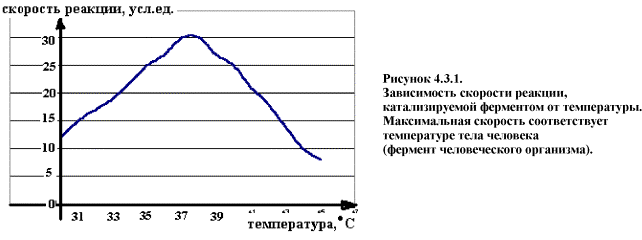
Классификация и номенклатура ферментов
1. На чем основана классификация ферментов?
Классификация ферментов основана на механизме их действия и включает 6 классов.
2. Дайте характеристику каждого класса ферментов: Оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы:
Оксидоредуктазы - отдельный класс ферментов, катализирующих лежащие в основе биологического окисления реакции, сопровождающиеся переносом электронов с одной молекулы (восстановителя — акцептора протонов или донора электронов) на другую (окислитель — донора протонов или акцептора электронов). Ускоряют реакции окисления — восстановления.
Трансферазы - отдельный класс ферментов, катализирующих перенос функциональных групп и молекулярных остатков от одной молекулы к другой. Широко распространены в растительных и животных организмах, участвуют в превращениях углеводов, липидов, нуклеиновых и аминокислот. Ускоряют реакции переноса функциональных групп и молекулярных остатков.
Гидролазы - это класс ферментов, катализирующий гидролиз ковалентной связи. Ускоряют реакции гидролитического распада.
Лиазы - тдельный класс ферментов, катализирующих реакции негидролитического и неокислительного разрыва различных химических связей (C—C, C—O, C—N, C—S и других) субстрата, обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур. Ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи).
Изомеразы - ферменты, катализирующие структурные превращения изомеров (рацемизация или эпимеризация). Изомеразы катализируют реакции, подобные следующей: A → B, где B является изомером A. Ускоряют пространственные или структурные перестройки в пределах одной молекулы. 6. Лигазы — ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей.
Лигазы - фермент, катализирующий соединение двух молекул с образованием новой химической связи (лигирование). При этом обычно происходит отщепление (гидролиз) небольшой химической группы от одной из молекул.
3. Рассмотрите значение и применение ферментов: ферментативные процессы являются основой многих производств: хлебопечения, виноделия, пивоварения, сыроделия, производства спирта, чая, уксуса. С начала 20 в. по предложению япон. учёного Д. Такамине в спиртовой и др. отраслях промышленности началось применение ферментных препаратов, получаемых из плесневых грибов или бактерий. В ряде стран этот способ широко используется для осахаривания с помощью амилаз крахмалистого сырья с целью получения кристаллической глюкозы или его сбраживания на спирт. Концентрированные амилолитические препараты Ф. из плесневых грибов при добавке в тесто приводят к улучшению качества хлеба и ускорению технологического процесса. Препараты протеолитических Ф., получаемых из микроорганизмов, употребляются в кожевенной промышленности для удаления волос и мягчения сырья, а в сыродельной промышленности – для замены дефицитного сычужного фермента (реннина). Препараты микробных пектолитических Ф. широко используют при производстве соков (выход плодового сока повышается на 10–20%). Всё большее применение очищенные ферментные препараты находят в медицине. В научных исследованиях и в клинической практике высокоочищенные ферментные препараты служат в качестве специфических средств биохимического анализа. Весьма перспективно применение т. н. иммобилизованных Ф., которые связываются каким-либо носителем, образующим с данным Ф. нерастворимый комплекс. При подборе соответствующего носителя можно получить иммобилизованный Ф. с высокой активностью, устойчивый по отношению к денатурирующим агентам. Колонка, заполненная иммобилизованным Ф., может быть многократно использована для проведения соответствующей реакции. Иммобилизованные Ф. находят всё более широкое применение в аналитической практике и биохимической технологии.
Тема 3. Углеводы.
1. Рассмотрите строение моносахаридов. Какие моносахариды называются альдозами и какие кетозами? Приведите примеры.
а) моносахариды
Моносахариды - производные многоатомных спиртов, содержащие карбонильную группу. В зависимости от положения в молекуле карбонильной группы моносахариды подразделяют на альдозы и кетозы.
Альдозы содержат функциональную альдегидную группу -НС=О, тогда как кетозы содержат кетонную группу >С=О. Название моносахарида зависит от числа составляющих его углеродных атомов, например альдотриозы, кетотриозы, альдогексозы, кетогексозы и т.д.
Моносахариды по строению можно отнести к простым углеводам, так как они не гидролизуются при переваривании, в отличие от сложных, которые при гидролизе распадаются с образованием простых углеводов.
2. Какие виды изомерии характерны для моносахаридов?
Для моносахаридов, содержащих n асимметричных атомов углерода, возможно существование 2n стереоизомеров.
3. Дайте характеристику оптических изомеров.
Это изомеры молекул, содержащих хиральный центр симметрии (напр., асимметричный атом углерода, относительно которого атомы могут располагаться двумя зеркально противоположными способами). Такие молекулы называются хиральными. Физические и химические свойства оптических изомеров одинаковы, различие проявляется только при их взаимодействии с плоско поляризованным светом или с другими хиральными молекулами. Так, оптические изомеры вращают плоскость поляризации в противоположные стороны. Один из оптических изомеров молекулы считают правым (D-dexter), другой - левым (L -laevus), что обычно не связано с направлением вращения плоскости поляризации. Правые и левые оптические изомеры одной молекулы иногда, соединяясь друг с другом, образуют довольно прочные соединения - рацематы; такие соединения (а также смеси D- и L –изомеров в равном отношении) оптически неактивны, другие физические свойства рацематов также отличны от свойств энантиомеров, из которых они образовались.
4. Какой атом углерода называется асимметрическим?
На примере молочной кислоты, существующей в виде двух оптических изомеров – мясомолочной кислоты и молочной кислоты брожения можно показать, что если четыре заместителя различны, то возможны два различных расположения, которые относятся друг к другу как предмет к своему зеркальному изображению. Таким образом, тетраэдрический углеродный атом можно рассматривать как центр дисимметрии, и его часто называют асимметрическим атомом углерода или (по современной терминологии) хиральным центром (от греческого слова сheir – рука). Два различных расположения представляют собой право- и левовращающие энантиомеры (зеркальные изомеры) хиральной молекулы; смесь равных количеств двух энантиомеров представляет собой рацемат.
5. Опишите биологическую роль и применение моносахаридов.
Углеводы наряду с белками и липидами являются важнейшими химическими соединениями, входящими в состав живых организмов. У человека и животных углеводы выполняют важные функции: энергетическую (главный вид клеточного топлива), структурную (обязательный компонент большинства внутриклеточных структур) и защитную (участие углеводных компонентов иммуноглобулинов в поддержании иммунитета).
Углеводы (рибоза, дезоксирибоза) используются для синтеза нуклеиновых кислот, они являются составными компонентами нуклеотидных ко-ферментов, играющих исключительно важную роль в метаболизме живых существ. В последнее время все большее внимание к себе привлекают смешанные биополимеры, содержащие углеводы: гликопептиды и глико-протеины, гликолипиды и липополисахариды, гликолипопротеины и т.д. Эти вещества выполняют в организме сложные и важные функции.
С нарушением обмена углеводов тесно связан ряд заболеваний: сахарный диабет, галактоземия, нарушение в системе депо гликогена, нетолерантность к молоку и т.д.
Следует отметить, что в организме человека и животного углеводы присутствуют в меньшем количестве (не более 2% от сухой массы тела), чем белки и липиды; в растительных организмах за счет целлюлозы на долю углеводов приходится до 80% от сухой массы, поэтому в целом в биосфере углеводов больше, чем всех других органических соединений вместе взятых.
6. Напишите схему окисления глюкозы в различных условиях и назовите образующиеся соединения.
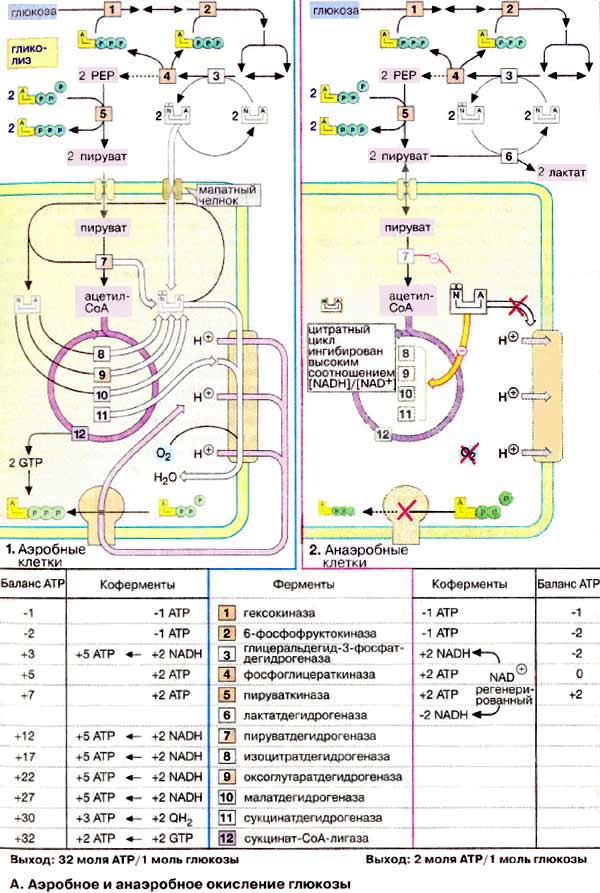
7. Напишите уравнение реакций спиртового и молочнокислого брожения.
Химическое уравнение спиртового брожения: C6H12O6 ® 2C2H5OH + 2CO2 было дано французскими химиками А. Лавуазье (1789) и Ж. Гей-Люссаком (1815).
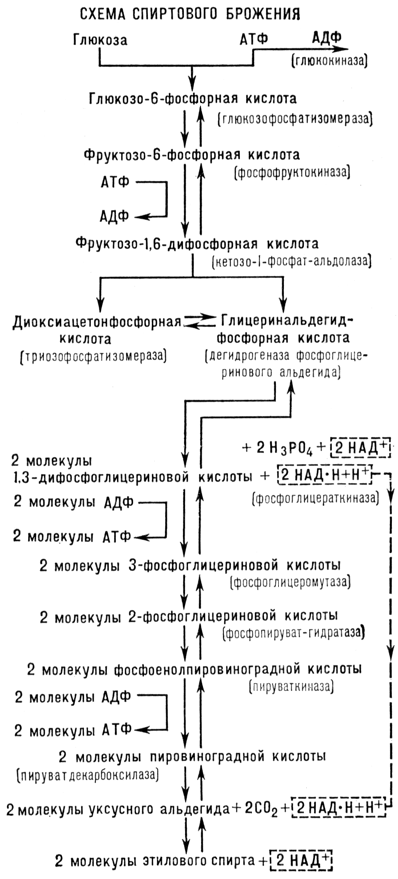
Суммарно уравнение спиртового брожения может быть представлено в следующем виде:
C6H12O6 + 2H3PO4 + 2АДФ ® 2CH3CH2OH + 2CO2 + 2АТФ.
Молочнокислое Б. Молочнокислые бактерии подразделяют на 2 группы — гомоферментативные и гетероферментативные. Гомоферментативные бактерии (например, Lactobacillus delbrückii) расщепляют моносахариды с образованием двух молекул молочной кислоты в соответствии с суммарным уравнением: C6H12O6 = 2CH3CHOH·COOH.
б) олигосахариды:
1. Рассмотрите строение и свойства восстанавливающих и не восстанавливающих дисахаридов.
Дисахариды представляют собой О-гликозиды моносахаридов и при гидролизе образуют два одинаковых или различных моносахарида. Дисахариды делятся на не восстанавливающие и восстанавливающие. К не восстанавливающим относятся, например, трегалоза:
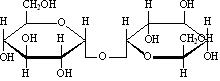
1-[-D-глюкопиранозил]--D-глюкопиранозид
и сахароза:
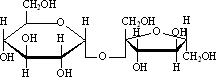
1-[-D-фруктофуранозил]--D-глюкопиранозид
В образовании гликозидной связи участвуют оба гликозидных гидроксила,поэтому невосстанавливающие дисахариды не способны к таутомерии с образованием открытой формыи свободной оксо-группы. Поэтому не восстанавливающие дисахариды не дают реакций, характерных для открытойформы моносахаридов, т.е. не взаимодействуют с гидроксидом диамминсеребра, гидроксидом меди, фенилгидразином,гидроксиламином, циановодородной кислотой. У восстанавливающих дисахаридов остается один свободный гликозидный гидроксил (на рисунках он подчеркнут двумя красными черточками), например:
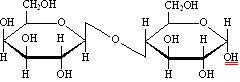
лактоза, 4-[-D-галактопиранозил]--D-глюкопираноза
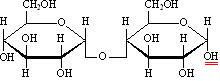
мальтоза, 4-[-D-глюкопиранозил]--D-глюкопираноза
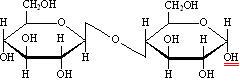
целлобиоза, 4-[-D-глюкопиранозил]--D-глюкопираноза
Химические свойства
Восстанавливающие дисахариды способны к таутомерии, поэтому остаток моносахарида, сохранивший свой гликозидный гидроксил может переходить в открытую форму (не теряя при этом связи с остатком второго моносахарида):
Дисахариды:
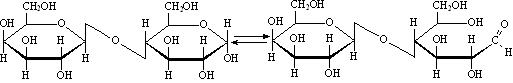
По этой причине восстанавливающие дисахариды способны к мутаротации и эпимеризации. Они окисляются (отсюда иназвание - восстанавливающие):
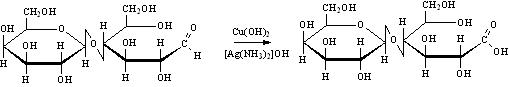
Восстанавливаются амальгамой натрия или комплексными гидидами металлов:
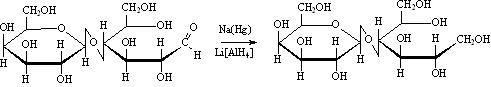
Алкилируются спиртами в кислой среде (обычно в присутствии HCl), образуя гликозиды дисахаридов:
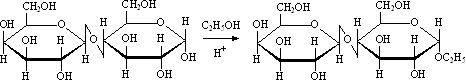
И восстанавливающие и не восстанавливающие дисахариды алкилируются галогеналкилами:
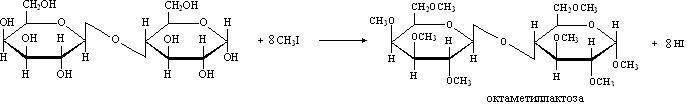
и ацилируются ангидридами или галогенангидридами кислот:
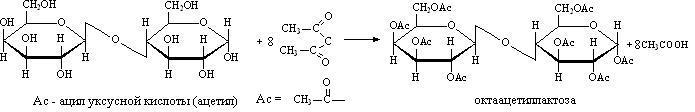
При гидролизе, который происходит при нагревании водного раствора дисахарида в присутствии кислоты (обычно серной) образуются моносахариды, например при гидролизе сахарозы - смесь глюкозы и фруктозы, а при гидролизе лактозы - смесь галактозы и глюкозы.
2. Напишите формулы мальтозы, лактозы и сахарозы и дайте их систематические названия.
Мальтоза (солодовый сахар) содержится в солоде, т.е. в проросших зернах злаков. Мальтозу получают при неполном гидролизе крахмала ферментами солода. Мальтоза выделена в кристаллическом состоянии, она хорошо растворима в воде, сбраживается дрожжами. Мальтоза состоит из двух звеньев D-глюкопиранозы, соединенных гликозидной связью между углеродом С-1 (аномерным углеродом) одного звена глюкозы и углеродом С-4 другого глюкозного звена. Такую связь называют  -1,4-гликозидной связью. Показанная ниже формула Хеуорса
-1,4-гликозидной связью. Показанная ниже формула Хеуорса  -мальтозы обозначается префиксом
-мальтозы обозначается префиксом 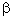 -, потому что ОН-группа при аномерном углероде расположенного справа глюкозного звена является
-, потому что ОН-группа при аномерном углероде расположенного справа глюкозного звена является 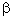 -гидроксилом. Мальтоза – восстанавливающий сахар. Ее полуацетальная группа находится в равновесии со свободной альдегидной формой и может окисляться в карбоновую мальтобионовую кислоту.
-гидроксилом. Мальтоза – восстанавливающий сахар. Ее полуацетальная группа находится в равновесии со свободной альдегидной формой и может окисляться в карбоновую мальтобионовую кислоту.
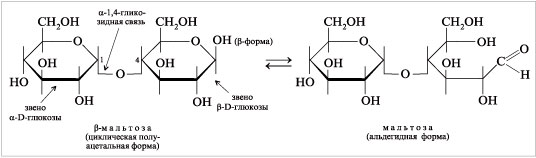
|
| Формулы Хеуорса мальтозы в циклической и альдегидной формах |
Лактоза (молочный сахар) содержится в молоке (4–6%), ее получают из молочной сыворотки после удаления творога. Лактоза значительно менее сладкая, чем свекловичный сахар. Она используется для изготовления детского питания и фармацевтических препаратов. Лактоза состоит из остатков молекул D-глюкозы и D-галактозы и представляет собой 4-( 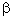 -D-галактопиранозил)-D-глюкозу, т.е. имеет не
-D-галактопиранозил)-D-глюкозу, т.е. имеет не 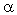 -, а
-, а 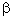 -гликозидную связь.
-гликозидную связь.
В кристаллическом состоянии выделены 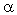 - и
- и 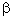 -формы лактозы, обе они принадлежат к восстанавливающим сахарам.
-формы лактозы, обе они принадлежат к восстанавливающим сахарам.
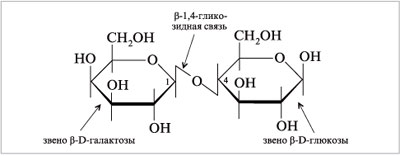
|
Формула Хеуорса лактозы ( 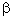 -форма) -форма)
|
Сахароза (столовый, свекловичный или тростниковый сахар) – наиболее распространенный в биологическом мире дисахарид. В сахарозе углерод С-1 D-глюкозы соединен с углеродом
С-2 D-фруктозы посредством 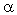 -1,2-гликозидной связи. Глюкоза находится в шестичленной (пиранозной) циклической форме, а фруктоза в пятичленной (фуранозной) циклической форме. Химическое название сахарозы –
-1,2-гликозидной связи. Глюкоза находится в шестичленной (пиранозной) циклической форме, а фруктоза в пятичленной (фуранозной) циклической форме. Химическое название сахарозы – 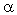 -D-глюкопиранозил-
-D-глюкопиранозил- 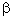 -D-фруктофуранозид. Поскольку оба аномерных углерода (и глюкозы, и фруктозы) вовлечены в образование гликозидной связи, глюкоза относится к невосстанавливающим дисахаридам. Вещества этого типа способны только к реакциям образования простых и сложных эфиров, как всякие многоатомные спирты. Сахароза и другие невосстанавливающие дисахариды гидролизуются особенно легко.
-D-фруктофуранозид. Поскольку оба аномерных углерода (и глюкозы, и фруктозы) вовлечены в образование гликозидной связи, глюкоза относится к невосстанавливающим дисахаридам. Вещества этого типа способны только к реакциям образования простых и сложных эфиров, как всякие многоатомные спирты. Сахароза и другие невосстанавливающие дисахариды гидролизуются особенно легко.
|
| Формула Хеуорса сахарозы |
3. Опишите биологическую роль и применение дисахаридов.
Дисахариды, биозы, углеводы, молекулы которых состоят из двух остатков моносахаридов. Все дисахариды построены по типу гликозидов. При этом водородный атом гликозидного гидроксила одной молекулы моносахарида замещается остатком др. молекулы моносахарида за счёт полуацетального или спиртового гидроксила. В первом случае образуются дисахариды, не обладающие восстанавливающими свойствами, во втором — дисахариды с восстанавливающими свойствами. В группу не восстанавливающих дисахаридов входят трегалоза (микоза, или грибной сахар), состоящая из 2 остатков глюкозы; сахароза, состоящая из остатков глюкозы и фруктозы, и др. К группе восстанавливающих дисахаридов относятся мальтоза, целлобиоза, лактоза и др. Дисахариды могут содержать 5- и 6-членные кольца моносахаридов (пентозы и гексозы) и различаться по конфигурации гликозидной связи (a- или b-гликозиды). Пространственные формы (конформации) колец моносахаридных остатков в разных дисахаридах могут варьировать. Так, целлобиоза и мальтоза различаются не только конфигурацией гликозидной связи (a — у мальтозы и b — у целлобиозы), но и тем, что в целлобиозе оба остатка находятся в одинаковой конформации, а в мальтозе — в разных.
Дисахариды — хорошо кристаллизующиеся вещества, легко растворимы в воде и в 45 — 48°-ном спирте, плохо растворимы в 96°-ном спирте; оптически активны; сладки на вкус. Гидролиз Д. (для сахарозы называется инверсией) происходит при действии кислот; при наличии 5-членного кольца в моносахаридном остатке скорость кислотного гидролиза Д. возрастает. Гидролиз Д. осуществляется также ферментами (карбогидразами), например a- или b-гликозидазами (в зависимости от типа гликозидной связи в дисахаридах). В результате гидролиза образуются моносахариды.
Дисахариды широко распространены в животных и растительных организмах. Они встречаются в свободном состоянии (как продукты биосинтеза или частичного гидролиза полисахаридов), а также как структурные компоненты гликозидов и др. соединений. Обычно Д. получают из природных источников (например, сахарозу — из сахарной свёклы или сахарного тростника, лактозу — из молока животных). Многие Д. синтезируют химическими и биохимическими методами.
Сахароза, лактоза и мальтоза — ценные пищевые и вкусовые вещества. Производством сахарозы занята сахарная промышленность.
в) олигосахариды:
1. Опишите строение крахмала.
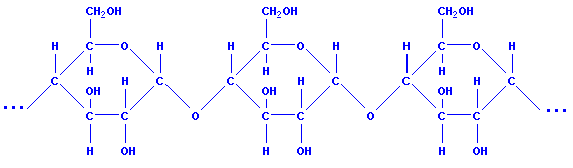 Крахмал состоит из 2 полисахаридов - амилозы и амилопектина, образованных остатками глюкозы. Экспериментально доказано, что химическая формула крахмала (C6H10O5)n.
Крахмал состоит из 2 полисахаридов - амилозы и амилопектина, образованных остатками глюкозы. Экспериментально доказано, что химическая формула крахмала (C6H10O5)n.
Установлено, что крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала. Накапливается в виде зерен, главным образом в клетках семян, луковиц, клубней, а также в листьях и стеблях. Крахмал - белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер.
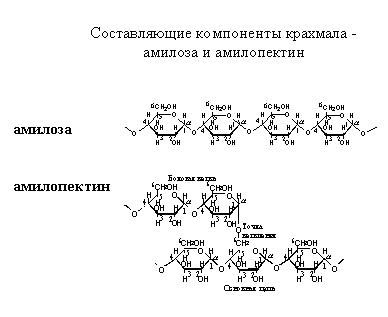
2. Напишите формулы структурных звеньев амилозы и амилопектина.
3. Опишите биологическую роль крахмала.
Крахмал, являясь одним из продуктов фотосинтеза, широко распространен в природе. Для растений он является запасом питательных веществ и содержится в основном в плодах, семенах и клубнях. Наиболее богато крахмалом зерно злаковых растений: риса (до 86 %), пшеницы (до 75%), кукурузы (до 72 %), а также клубни картофеля (до 24 %). Для организма человека крахмал наряду с сахарозой служит основным поставщиком углеводов — одного из важнейших компонентов пищи. Под действием ферментов крахмал гидролизуется до глюкозы, которая окисляется в клетках до углекислого газа и воды с выделением энергии, необходимой для функционирования живого организма.
Раствор крахмала в воде является неньютоновской жидкостью.
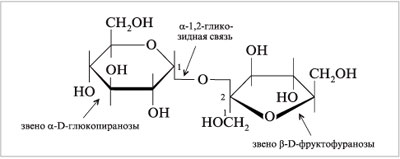
4. Напишите формулу структурного звена целлюлозы.
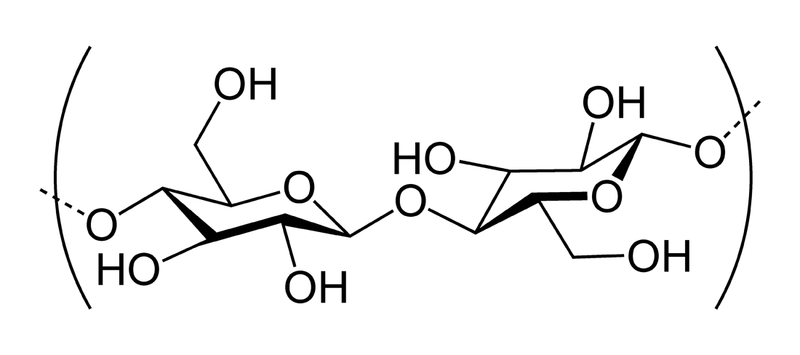
Целлюлоза в форме полимера β-D-глюкозы
5. Дайте характеристику строению и биологическому значению целлюлозы.
Целлюлоза представляет собой полимер бета-глюкозы. В отличие от крахмала и гликогена этот полисахарид выполняет структурную функцию.
Когда две молекулы бета-глюкозы соединяются друг с другом, группа —ОН при 1-м углеродном атоме может прийти в контакт с группой —ОН при 4-м атоме лишь в том случае, если одна из молекул будет повернута относительно другой на 180°. Связано это с тем, что группа —ОН при 1 -м атоме располагается под плоскостью кольца, а группа —ОН при 4-м атоме — над ней.
Таким образом, каждый следующий остаток в молекуле целлюлозы повернут относительно предыдущего на 180°. Именно это и отличает молекулы целлюлозы от молекул крахмала и позволяет изготавливать из целлюлозы футболки, которые мы все носим. Футболки из целлюлозы можно приобрести как в магазинах, так и имеется возможность получить футболки почтой России. Практически все футболки изготовлены из хлопка, который и состоит из целлюлозы особой формы.
В целлюлозе заключено около 50% углерода, находящегося в растениях, и по общей своей массе целлюлоза на Земле занимает первое место среди всех органических соединений. Практически всю целлюлозу поставляют растения, хотя она встречается также у некоторых низших беспозвоночных и у примитивных групп грибов.
Такое большое количество целлюлозы на Земле, обусловлено тем, что у всех растений из нее построены клеточные стенки: в среднем 20—40% материала клеточной стенки составляет именно целлюлоза. Строение молекул целлюлозы делает их как нельзя лучше приспособленными для этой роли. Они представляют собой длинные цепи — приблизительно из 10 000 остатков глюкозы. Эти цепи, в которых остатки глюкозы соединены бета-1,4-связями, прямолинейны в отличие от цепей крахмала, альфа-1,4-связи которых делают их способными изгибаться и свертываться.
Из каждой такой цепи выступает наружу множество —ОН-групп. Эти группы направлены во все стороны и образуют водородные связи с соседними цепями, что обеспечивает жесткое поперечное сшивание всех цепей. По 60—70 цепей объединены друг с другом в микро фибриллы, а последние в свою очередь собраны в пучки, т. е. в более крупные структуры, называемые макро фибриллами.
Прочность на разрыв при таком строении чрезвычайно велика (некоторое представление об этом дает испытание на разрыв такого материала, как хлопок, состоящего почти полностью из целлюлозы). В клеточной стенке слои целлюлозных макро фибрилл погружены в цементирующий матрикс, состоящий из других полисахаридов, что придает всей структуре еще большую прочность.
Таким образом, растительные клетки одеты оболочкой, состоящей из нескольких слоев целлюлозы. Она предохраняет их от разрыва, когда внутрь под действием осмотических сил поступает вода, и она же в какой-то мере определяет их форму, поскольку направление, в котором может растягиваться клетка, зависит от того, как располагаются в клеточной стенке целлюлозные слои.
Дата добавления: 2016-06-13; просмотров: 1468;
