Сырьевые материалы и перспективы биотехнологии.
Наиболее важным критерием, определяющим выбор сырья для биотехнологических процессов, являются: стоимость, наличие в достаточных количествах, химический состав, форма и степень окисленности источника углерода и т. п. В настоящее время наиболее широко используемыми и коммерчески выгодными материалами являются крахмал (преимущественно кукурузный), метанол, меласса и сырой сахар. Практически нет сомнения в том, что зерновые (в частности, кукуруза, рис и пшеница) будут основными краткосрочными сырьевыми материалами для биотехнологических процессов именно в тех странах, где развиты интенсивные биотехнологические процессы.
Следует отметить, что биотехнология на современном этапе своего развития преимущественно ориентируется на различные виды недорогого, легкодоступного и возобновляемого сырья, наиболее значимым из которого является растительная масса. При конверсии субстратов в биотехнологических процессах основное внимание обращается на создание безотходных производств, когда побочные продукты одного процесса служат питательными субстратами для последующего.
ЛЕКЦИЯ 4. ТЕХНОЛОГИЯ ФЕРМЕНТАЦИОННЫХ
ПРОЦЕССОВ
1 Биореакторы.
2 Конструкция биореакторов.
3 Специализированные ферментационные процессы.
При ферментационной технологии можно использовать цельные живые клетки (микроорганизмы, клетки животных или растений) или клеточные компоненты с целью физических или химических преобразований органических веществ. Однако недостаточно получать требуемые изменения веществ, метод должен иметь преимущества перед другими, применяемыми в настоящее время технологиями производства этих же самых продуктов.
Преимущества производства органических продуктов биотехнологическими способами перед чисто химическими методами достаточно многогранны:
· Многие сложные органические молекулы, такие, как белки и антибиотики, не могут практически быть синтезированы химическими способамии.
· Биоконверсия обеспечивает значительно больший выход целевого продукта.
· Биологические системы функционируют при более низких температурах, близких к нейтральному значениях рН и т. п.
· Биологические реакции намного специфичнее, чем реакции химического катализа,
· Биологические процессы обеспечивают почти исключительно продукцию чистых изомеров одного типа, а не их смесей, как это часто бывает в реакциях химического синтеза.
Но вместе с тем биологические способы в сравнении с химическими методами обладают рядом явных недостатков:
· Биологические системы могут легко быть загрязнены посторонней нежелательной микрофлорой.
· Целевой продукт, синтезируемый биологическим способом, присутствует в довольно сложной смеси, что обусловливает необходимость разделения его от примеси ненужных веществ.
· Биотехнологические производства требуют больших количеств воды, которую в итоге необходимо удалять, сбрасывая в окружающую среду.
· Биопроцессы обычно идут медленнее в сравнении со стандартными химическими процессами.
Для каждого биотехнологического процесса должна быть разработана подходящая схема, а сам процесс должен постоянно наблюдаться и тщательно контролироваться. Для большинства практических биотехнологических процессов такими системами являются ферментеры или биореакторы, которые обеспечивают необходимые физические условия, способствующие наилучшему взаимодействию катализатора со средой и поставляемым материалом.
Биореакторы.
Основное требование к биореакторам любого типа сводится к обеспечению оптимальных условий роста продуцента или накоплению синтезируемого им продукта. Для достижения указанных целей необходимо разрабатывать технологию, призванную оптимизировать процесс, а именно: использовать подходящий источник энергии, набор питательных веществ должен соответствовать питательным потребностям организма-продуцента, из ростовой среды должны быть удалены соединения, ингибирующие его жизнедеятельность, должна быть подобрана соответствующая посевная доза и, наконец, обеспечены все остальные требуемые физико-химические условия. Экономически рентабельные процессы в своей основе весьма сходны, независимо от избранного продуцента, используемой среды и образуемого продукта. Фактически один и тот же биореактор (лишь с небольшими изменениями) может быть использован для производства ферментов, антибиотиков, органических кислот или одноклеточного белка.
Биотехнологические процессы отличаются от процессов химического синтеза и могут быть двух типов: периодическими и непрерывными. Специфика биотехнологических процессов состоит в том, что в них участвуют живые клетки, субклеточные структуры или выделенные из клеток ферменты и их комплексы. Это оказывает довольно существенное влияние на процессы массообмена (обмена веществ между различными фазами - перенос кислорода из газообразной фазы в жидкую) и теплообмена (перераспределение тепловой энергии между взаимодействующими фазами). Поэтому одним из важнейших механизмов биореакторов является система перемешивания, обеспечивающая однородность условий в аппарате.
Другим существенным различием между биотехнологическими и химическими процессами является необходимость создания аэробных или анаэробных условий, требуемых для культивирования соответствующего организма. Поэтому в определенных случаях необходимо подавать кислород и удалять образующиеся газообразные продукты иного рода, в первую очередь двуокись углерода (СО2). Системы аэрациизачастую бывают очень сложной конструкции, поскольку они должны обеспечить баланс между расходом О2 и его поступлением в нужных количествах, учитывая тот факт, что потребность в кислороде не одинакова на различных стадиях культивирования.
Крайне важным является обеспечение должного уровня теплообмена в биореакторах, поскольку жизнедеятельность и метаболическая активность объектов зависит в значительной степени от колебаний температуры.
Еще одной серьезной проблемой при культивировании в биореакторах является пенообразование,связанное с необходимостью аэрирования содержимого, в котором постоянно присутствуют поверхностно-активные вещества (ПАВ). Это заставляет интенсивно разрабатывать эффективные системы пеногашения.
Специфическим элементом биореактора является система, обеспечивающая стерильностьпроцесса. Стерилизация осуществляется на разных этапах процесса, как до его начала, так и при осуществлении и после окончания. Таким образом, процессам стерилизации в биотехнологическом производстве отводится важное место.
В последнее время в биотехнологию внедряется принцип дифференцирования режимов культивирования: разные этапы одного и того же процесса осуществляются при различных условиях - температура, рН, аэрация и т. п. Естественно, это создает новые (дополнительные) требования при конструировании реакторов. Таким образом, в соответствии с основными принципами реализации биотехнологических процессов современные биореакторы должны обладать следующими системами:
• эффективного перемешивания и гомогенизации среды выращивания;
• обеспечения свободной и быстрой диффузии газообразных компонентов системы (аэрирование в первую очередь);
• теплообмена, обеспечивающего поддержание оптимальной температуры внутри реактора и ее контролируемые изменения;
• пеногашения;
• стерилизации сред, воздуха и самой аппаратуры;
• контроля и регулировки процесса и его отдельных этапов.
При разработке новых биотехнологических процессов сначала прибегают к периодическому культивированию. Периодическое культивирование включает несколько этапов: стерилизацию сред и оборудования, загрузку биореактора питательной средой, внесение посевного материала, выращивание культуры, отделение и очистку готового продукта. После окончания последнего этапа производится мойка биореактора и подготовка его к новому циклу.
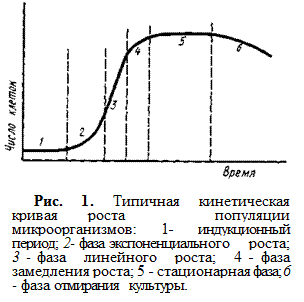 При этом типе культивирования рост клеточной популяции подразделяется на несколько фаз: 1) После введения инокулята обычно наблюдают индукционный период (лаг-фаза) (1),в течение которого не происходит сколько-нибудь заметного увеличения числа клеток или образования каких-либо продуктов. В этот период перестраивается метаболизм клетки, синтезируются ферменты, специфичные к использованию новых субстратов, активируется биосинтез белка. 2) Индукционный период сменяется фазой экспоненциального роста (2),в течение которой быстро накапливаются биомасса и продукты разных реакций. Эта фаза достаточно строго описывается экспоненциальной кривой. 3) В замкнутой системе экспоненциальная фаза роста не может развиваться неограниченно. Как правило, она переходит в фазу линейного роста (3),характеризующуюся равномерным во времени линейным ростом культуры. В этой фазе уже имеет место отклонение точек в сторону меньших значений количества клеток или продуктов, что служит экспериментальным критерием перехода культуры в линейную фазу роста. 4) Фаза линейного роста может смениться весьма непродолжительным периодом, в течение которого скорость роста культуры снижается до нуля. Это фаза замедления роста(4). 5) В некоторых случаях рост культуры может переходить в достаточно устойчивую и продолжительную стационарную фазу (5).В этих условиях культура развивается в режиме постоянства общего числа клеток. Режим характеризуется достаточно высокими скоростями отмирания клеток. При этом скорость прироста биомассы полностью компенсируется скоростью гибели и лизиса клеток. 6) Если система полностью истощается по субстрату или накопление ингибирующих рост продуктов является значительным, то скорость прироста биомассы становится равной нулю, происходят существенные физиологические изменения клеток и, как правило, наблюдается фаза отмирания культуры (6).
При этом типе культивирования рост клеточной популяции подразделяется на несколько фаз: 1) После введения инокулята обычно наблюдают индукционный период (лаг-фаза) (1),в течение которого не происходит сколько-нибудь заметного увеличения числа клеток или образования каких-либо продуктов. В этот период перестраивается метаболизм клетки, синтезируются ферменты, специфичные к использованию новых субстратов, активируется биосинтез белка. 2) Индукционный период сменяется фазой экспоненциального роста (2),в течение которой быстро накапливаются биомасса и продукты разных реакций. Эта фаза достаточно строго описывается экспоненциальной кривой. 3) В замкнутой системе экспоненциальная фаза роста не может развиваться неограниченно. Как правило, она переходит в фазу линейного роста (3),характеризующуюся равномерным во времени линейным ростом культуры. В этой фазе уже имеет место отклонение точек в сторону меньших значений количества клеток или продуктов, что служит экспериментальным критерием перехода культуры в линейную фазу роста. 4) Фаза линейного роста может смениться весьма непродолжительным периодом, в течение которого скорость роста культуры снижается до нуля. Это фаза замедления роста(4). 5) В некоторых случаях рост культуры может переходить в достаточно устойчивую и продолжительную стационарную фазу (5).В этих условиях культура развивается в режиме постоянства общего числа клеток. Режим характеризуется достаточно высокими скоростями отмирания клеток. При этом скорость прироста биомассы полностью компенсируется скоростью гибели и лизиса клеток. 6) Если система полностью истощается по субстрату или накопление ингибирующих рост продуктов является значительным, то скорость прироста биомассы становится равной нулю, происходят существенные физиологические изменения клеток и, как правило, наблюдается фаза отмирания культуры (6).
Биотехнологически ценные продукты синтезируются как в экспоненциальной фазе (нуклеотиды, многие ферменты, витамины - так называемые первичные метаболиты), так и в стационарной фазе роста (антибиотики, пигменты и т. п. - так называемые вторичные метаболиты).
Довольно широко в биотехнологии используется периодическое культивирование с подпиткой, при котором, помимо первичного внесения питательного субстрата до засева культуры, в процессе культивирования в аппарат через определенные интервалы добавляют питательные вещества либо порциями, либо непрерывно "по каплям".
Существует также отъемно-доливочное культивирование, когда часть содержимого биореактора периодически изымается и добавляется равное количество питательной среды. Такой прием обеспечивает регулярное "омолаживание" культуры и задерживает ее переход в фазу отмирания. Этот прием иногда называется полунепрерывным культивированием.
Модификацией периодического культивирования является культивирование с диализом, при котором питательный субстрат постоянно поступает в реактор через специальную мембрану. Диализ ведет к снижению концентрации продуктов жизнедеятельности клеток, неблагоприятно влияющих на их жизнеспособность. Помимо этого, диализ удаляет из культуры часть жидкости, что позволяет получать в конце процесса концентрированную биомассу.
В непрерывных процессах культивирования клетки постоянно поддерживаются в экспоненциальной фазе роста. С этой целью в биореактор подается свежая питательная среда и обеспечивается отток из него культуральной жидкости, содержащей клетки и продукты их жизнедеятельности. Основным принципом непрерывных процессов (как уже отмечалось выше) является точное соблюдение равновесия между приростом биомассы вследствие деления клеток и их убылью в результате разбавления содержимого свежей средой. Различают хемостатный и турбидостатный режимы непрерывного культивирования.
При хемостатном режиме культивирования саморегулируемая система возникает в силу следующих причин: если первоначальное поступление свежей питательной среды и вымывание биомассы превышает скорость деления клеток, то в результате разбавления культуры снижается концентрация веществ, ограничивающих ростовые процессы и скорость роста культуры повышается; увеличивающаяся популяция начинает активнее "выедать" субстрат, что в свою очередь приводит к торможению роста культуры. Конечным итогом этих процессов является (после серии затухающих колебаний) установление равновесия между скоростью роста культуры и ее разбавлением.
Биореактор, работающий в хемостатном режиме культивирования, называют хемостатом. Его конструкция предусматривает наличие: 1) приспособления для подачи питательной среды; 2) устройства, обеспечивающего отток культуральной жидкости вместе с клетками, и 3) системы, контролирующей концентрацию элементов питательной среды и управляющей скоростью подачи питательной среды.
Последнее является наиболее важным и наиболее сложно осуществимым устройством.
Турбидостатный режим культивирования базируется на прямом контроле концентрации биомассы. Наиболее распространенным методом ее определения является измерение светорассеивания с помощью фотоэлементов. Повышение концентрации клеток и соответственно оптической плотности автоматически ускоряет проток жидкости и наоборот. По своей конструкции турбидостаты отличаются от хемостатов лишь системами контроля скорости протока.
Хемостаты применяются в процессах, характеризующихся малым протоком, когда концентрация клеток изменяется незначительно с изменением скорости протока, что облегчает саморегулировку системы. Турбидостаты используются в процессах, характеризующихся высокой скоростью разбавления при быстром и резком изменении концентрации биомассы.
Дата добавления: 2016-06-02; просмотров: 2276;
