Энтропия, ее свойства
В термодинамике широко используются величины, которые являются функциями состояния системы. С одной из та.ких функций состояния, внутренней энергией U, мы уже познакомились. Еще одной функцией состояния системы, занимающей особое место в термодинамике, является энтропия S. Понятие энтропии было введено Клазиусом следующим образом: энтропия S —функция состояния системы, дифференциалом которой является 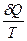 , т. е.
, т. е.
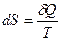 , (29.1)
, (29.1)
где δQ — элементарное количество теплоты, сообщаемое термодинамической системе от термостата с температурой Т при элементарном изменении состояния системы.
Чтобы убедиться в том, что энтропия является функцией состояния системы, нужно показать независимость изменения энтропии ΔS = S2—S1 от вида процесса при переходе термодинамической системы из одного состояния 1 в другое состояние 2. Покажем это на примере идеального газа. Пусть идеальный газ, образующий замкнутую систему, равновесным образом переходит из состояния 1 в состояние 2, тогда согласно (29.1)
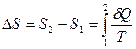 . (29.2)
. (29.2)
Подставляя в (29.2) из первого начала термодинамики
δQ = dU+δA
и учитывая, что
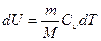 и
и 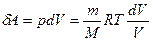 ,
,
получим
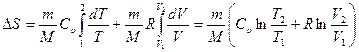 , (29.3)
, (29.3)
где m — масса газа; М — молярная масса; Т1, Т2, V1, V2 — температуры и объем газа в состояниях 1 и 2; Cυ — молярная теплоемкость газа при V=const. Из выражения (29.3) видно, что изменение энтропии идеального газа при переходе их состояния 1 в 2 не зависит от вида процесса перехода и определяется только параметрами газа V1 Т1в состоянии 1 и параметрами V2, Т2 в состоянии 2. Если газ участвует в обратимом циклическом процессе, то V1 = V2, T1 = T2и изменение энтропии газа за цикл равно тождественно нулю
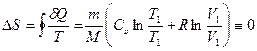 ,
,
что также указывает на то, что энтропия есть функция состояния термодинамической системы.
Остановимся на свойствах энтропии. Пусть термодинамическая система участвует в циклическом процессе, состоящем из двух участков: 1→2 необратимый процесс и 2→1 обратимый. В целом цикл будет необратим, и для него можно записать неравенство Клаузиуса:
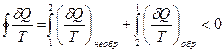 . (29.4)
. (29.4)
Для обратимого участка цикла имеем
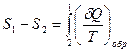 . (29.5)
. (29.5)
Тогда (29.4) запишется
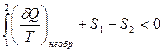 .
.
откуда
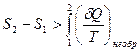 . (29.6)
. (29.6)
Поскольку на участке 2→1 процесс обратимый, то выражение (29.5) может быть представлено в виде
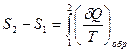 . (29.7)
. (29.7)
Обобщая формулы (29.6) и (29.7), получим выражение
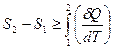 , (29.8)
, (29.8)
в котором знак равенства берется в случае обратимого процесса перехода системы из состояния 1 в состояние 2 и знак больше, если процесс перехода необратимый.
Если рассмотреть изолированную систему, то она не будет обмениваться теплотой с окружающей средой и в формуле (29.8) на любой стадии процесса δQ=0. В результате мы получаем, что изменение энтропии будет равно ΔS ≥ 0 или в дифференциальной форме dS ≥ 0, где знак равенства берется для обратимого процесса, и знак больше — в случае необратимого.
Так как реальные процессы необратимы, то на основании (29.8) можно утверждать, что все возможные процессы в теплоизолированной системе ведут к увеличению ее энтропии— принцип возрастания энтропии.
Важным свойством энтропии является ее аддитивность: энтропия системы равна сумме энтропии всех тел (частей), входящих в состав системы:
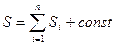 , (29.9)
, (29.9)
где п — число тел (частей) системы.
Как видно из (29.9), энтропия S известна с точностью до неопределенной постоянной и, следовательно, ее абсолютная величина зависит от выбора начала отсчета, в то время как ее изменение ΔS не зависит от выбора начала отсчета энтропии.
Введение понятия энтропии и установление принципа ее возрастания позволяет дать обобщенную формулировку второго начала термодинамики: в замкнутой термодинамической системе возможны лишь такие процессы, которые ведут к возрастанию энтропии.
Далее из (29.8) следует, что для произвольного процесса
δQ ≤ TdS. (29.10)
Если подставить (29.10) в выражение для первого начала термодинамики, получим
TdS ≥ dU+ δA. (29.11)
Последнее неравенство (29.11) объединяет первый и второй законы термодинамики и является ее важнейшим соотношением.
2. Термодинамические потенциалы
Термодинамическими потенциалами называют такие функции состояния системы, с помощью которых можно вычислить работу, производимую системой в обратимых процессах при заданных условиях, так как термодинамические потенциалы являются функциями состояния, их изменение зависит только от начального и конечного состояния системы, т. е. они являются полными дифференциалами. Конкретный вид термодинамического потенциала определяется условиями, в которых находится система при переходе из начального 1 в конечное 2 состояние.
При адиабатическом процессе, как это следует из первого начала термодинамики, работа, совершаемая системой, равняется убыли внутренней энергии δA = — dU или A1-2 = U1—U2. Таким образом:
1) внутренняя энергия системы в адиабатическом процессе играет роль термодинамического потенциала.
2) Важнейшим термодинамическим потенциалом является так называемая энергия Гeльмгoльцa
F=U—TS, (29.12)
термодинамический потенциал при изотермическом процессе. Работа, совершаемая в обратимом изотермическом процессе, равна убыли энергии Гельмгольца или
A1-2 = F1—F2. (29.13)
Энергия Гельмгольца F меньше внутренней энергии U на величину TS > 0. Произведение абсолютной температуры Т на энтропию S является той частью внутренней энергии системы, которую невозможно в изотермическом обратимом процессе реализовать в виде работы. Эту часть внутренней энергии называют связанной энергией системы. В этом смысле энергия Гельмгольца F является свободной, преобразующейся в работу.
3) Наряду со свободной энергией F в термодинамике широко используется термодинамический потенциал, известный как функция Гиббса G:
G = F+ pV = U – TS + pV. (29.14)
Функция Гиббса является изобарно-изотермическим потенциалом. Она позволяет рассчитать работу в процессе, при котором сохраняются давление p = const и температура Т = const системы:
δA = — dG или А1-2 = G1 — G2. (29.15)
В инженерной практике именно этот термодинамический потенциал является наиболее подходящим, так как многие процессы протекают в условиях постоянного давления и температуры.
3. Третье начало термодинамики (теорема Нернста)
Третье начало термодинамики было установлено Нернстом в 1906 г. на основании целого ряда экспериментальных фактов, относящихся к исследованиям химического равновесия, и поэтому представляет собой, как и другие законы термодинамики (нулевое, первое, второе начала), эмпирически установленный принцип.
Третье начало (теорема Нернста) термодинамики формулируется следующим образом: энтропия химически однородного вещества (тела) конечной плотности при стремлении температуры к абсолютному нулю приближается к предельному значению, не зависящему от давления, плотности или фазы вещества.
В силу неопределенности абсолютной величины энтропии можно принять состояние при 0 К за некоторое состояние и считать, что энтропия этого состояния S0 = 0. Тогда третье начало тремодинамики можно представить в виде
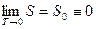 (29.16)
(29.16)
и энтропия произвольного состояния определяется однозначным образом. Найденную таким образом энтропию называют абсолютной энтропией.
Из третьего начала тремодинамики вытекает ряд следствий, которые могут быть проверены на опыте. В частности, из него следует, что теплоемкости вещества при постоянном объеме Cυи при постоянном давлении Ср при Т = 0 должны равняться нулю. Действительно, поскольку 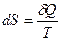 и δQ = Cυ(T)dT, имеем
и δQ = Cυ(T)dT, имеем
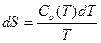 , (29.17)
, (29.17)
Интегрируя (29.17) в интервале температур от 0 К до Т, получим
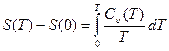 . (29.18)
. (29.18)
Для того чтобы интеграл (29.18) не расходился на нижнем пределе интегрирования и учитывая, что по третьему началу S(0) = S0 = 0, теплоемкость Cυ(T)в подынтегральном выражении при Т = 0 должна равняться нулю, т. е. Cυ(0)= 0.
Аналогично можно утверждать, что теплоемкость при постоянном давлении СР(Т)при Т=0 также равна нулю: Ср(0) = 0.
Важнейшим следствием, вытекающим из третьего начала термодинамики, является утверждение о том, что никакими способами нельзя достичь абсолютного нуля температуры (недостижимость абсолютного нуля), т. е. никакую систему невозможно охладить до абсолютного нуля температуры.
В заключение отметим, что третье начало вместе с нулевым, первым и вторым началами термодинамики образуют систему основных аксиом, на которых базируется термодинамика.
4. Статистический смысл энтропии
Физический смысл энтропии S не столь очевиден как, например, физический смысл внутренней энергии U, теплоты Q или работы А. В 1877 г. Людвиг Больцман исходя из основных свойств энтропии (ее возрастание во всех естественных процессах и ее аддитивность) предложил статистическую трактовку энтропии.
Он ввел в теорию теплоты статистические представления, приписав каждому состоянию системы «термодинамическую вероятность» W, которая тем больше, чем более однородным (беспорядочным) по распределению параметров, характеризующих механическое движение молекул, является это состояние.
Возрастание энтропии в этом случае означает, что система переходит из исходного состояния в другое, термодинамическая вероятность которого больше.
Пусть имеется сосуд с перегородкой, разделяющей два газа. Если перегородку убрать, то газы немедленно начнут перемешиваться посредством диффузии, которая является типичным необратимым процессом. Очевидно, что после того, как произошло смешение, маловероятно, чтобы все молекулы каждого сорта газа вернулись в первоначально занимаемые ими части объема сосуда.
Другой пример. Мы можем себе представить как разрушается старое здание, превращаясь в кучу мусора и кирпичей (переход от порядка к беспорядку), но маловероятно, чтобы вдруг эта груда мусора и кирпича превратилась снова в здание (переход от беспорядка к порядку), для этого надо приложить значительные усилия.
Образная трактовка энтропии — это функция, показывающая, что в природе все процессы направлены таким образом, чтобы системы переходили в состояния, которые характеризуются большей степенью беспорядка.
Волна, ударяясь о камни, разбивается на тысячи брызг, но эти брызги не собираются обратно в волну. Таким образом, необратимые процессы продолжаются до тех пор, пока не будет достигнуто наиболее вероятное для этой системы состояние, характеризующееся максимумом энтропии.
Принимая во внимание проведенную параллель между тенденцией к переходу в состояния с большей вероятностью (меньшей упорядоченностью) и возрастанием энтропии, Больцман предположил существование функциональной зависимости S = S(W) между S и W.
Эта функция должна быть монотонно возрастающей. Кроме того, оказывается, можно полностью определить ее вид. Пусть имеем систему, состоящую из двух частей А и В, тогда в состоянии равновесия энтропия всей системы будет
S(W) = SA + SB. (29.19)
Термодинамическая вероятность W осуществления конечного состояния системы равна произведению термодинамических вероятностей WA и WB для отдельных частей системы:
W = WA ∙ WB. (29.20)
В соответствии с (29.19) и (29.20) имеем
S(W) = S(WA ∙ WB) = S(WA)+S(WB). (29.21)
Уравнению (29.21) удовлетворяет логарифмическая функция
S = klnW + const, (29.22)
где k — постоянная Больцмана.
Энтропия — величина физическая и ее численное значение зависит от выбранной системы единиц, а термодинамическая вероятность — величина математическая, ибо она определяется числом способов, которыми может быть реализовано данное состояние термодинамической системы.
Коэффициент k обеспечивает гомогенность формулы Больцмана, но именно соотношение между двумя величинами различной природы обуславливает ее научную особенность.
Практическая ценность формулы (29.22) ограничена. Если состояние газа известно (известны Т и р), то нетрудно найти значение S, не используя величину W.
Если же состояния газа неизвестно или известно только частично (кроме массы известен только объем газа), то мы не можем вычислить W и, следовательно, определить величину S. Это не дает нам новых сведений о состоянии газа. Однако формула Больцмана имеет значительный теоретический интерес — она показывает, что кинетическая теория газов позволяет интерпретировать не только давление и температуру газа, но и его энтропию, причем изменение энтропии в одном определенном направлении есть статистическая закономерность.
5. Элементы термодинамики необратимых процессов
Разработка термодинамики необратимых процессов, которая давала бы информацию о протекании процессов во времени пока еще далека от завершения. Основные трудности связаны с тем, что до сих пор неизвестно, всегда ли параметры, необходимые для описания протекания во времени необратимых процессов, являются функциями только макроскопических величин.
Однако термодинамике необратимых процессов удалось добиться значительных успехов в решении ряда частных вопросов — изучении процессов, которые представляют поток, устанавливающийся под влиянием постоянно действующего во времени импульса, таких как электрический ток, поток тепла, диффузионный поток и поток вязкой жидкости. Термодинамика необратимых процессов определяет поток (аналогично тому, как мы это уже делали при рассмотрении явлений переноса) как производную по времени некоторой величины. Поток в соответствии с законами переноса Ома, Фурье, Фика и Ньютона пропорционален соответствующей силе (импульсу), а коэффициенты пропорциональ-ности (коэффицициенты переноса) должны зависеть от параметров состояния, а не от сил.
Для описания системы в неравновесном состоянии требуется вводить большее число параметров, чем для описания системы, находящейся в равновесии.
Так, термически однородная система в состоянии равновесия имеет одну температуру, общую для всех частей системы.
Та же система до установления равновесия могла иметь в разных частях различные температуры.
Предположим, что система может быть описана параметрами а1, а2, .,., ап.
Термодинамические силы (импульсы) Xi определяются соотношением
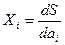 , (29.23)
, (29.23)
где S — энтропия, а потоки Ii — производными по времени:
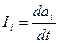 . (29.24)
. (29.24)
Возникновение энтропии σ, понятие, вводимое в термодинамике необратимых процессов, определяется соотношением
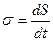 . (29.25)
. (29.25)
Используя формулы (29.23) и (29.24), получим вместо соотношения (29.25) новое:
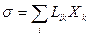 . (29.26)
. (29.26)
Это уравнение является основным для практических расчетов сил и потоков.
Взаимосвязь между силами и потоками является физической закономерностью, связывающей измеримые величины.
Теорию процессов переноса, согласующуюся с опытом при медленных потоках, удалось создать, основываясь на простейших линейных соотношениях между силами и потоками
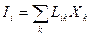 . (29.27)
. (29.27)
Уравнения такого вида получили наименования феноменологических. Феноменологические коэффициенты Lik не зависят ни от сил, ни от потоков.
В частном случае, когда имеются только один поток и один импульс, получаем известные феноменологические законы.
Закон Ома:
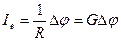 , (29.28)
, (29.28)
где 1е — электрический ток; R — сопротивление участка цепи; G — электропроводность; Δφ — разность потенциалов, обуславливающая ток на участке цепи.
Закон Фурье:
Iq = q = – λΔT, (29.29)
где q — поток тепла; λ, — коэффициент теплопроводности; ΔT — разность температур, обуславливающая поток тепла.
Закон Фика:
Iс = —DΔс, (29.30)
где Iс — поток вещества; D — коэффициент концентрационной диффузии; Δс — разность концентраций компонента смеси, обуславливающая поток вещества.
Закон Ньютона:
Iр = —ηΔυ, (29.31)
где Iр — поток импульса; η — коэффициент внутреннего трения; Δυ — разность скоростей, обусловившая поток импульса.
Термодинамика неравновесных процессов позволяет рассматривать более общие случаи явлений переноса чем те, что описываются уравнениями (29.28) — (29.31). Она позволяет описать процессы, в которых налагаются друг на друга два или несколько потоков различной физической природы и возникают так называемые перекрестные эффекты.
К перекрестным эффектам относятся упоминавшиеся ранее явления термодиффузии, диффузионного термоэффекта, а также такие, как термоэлектрический эффект, который нам предстоит еще изучить.
| <== предыдущая лекция | | | следующая лекция ==> |
| Второе начало термодинамики | | | Семейство Polypteridae Многоперы |
Дата добавления: 2016-05-25; просмотров: 1741;
