Второе начало термодинамики
Первое начало термодинамики указывает на то, что в любых термодинамических процессах должен выполняться закон сохранения энергии. Однако это начало не дает указаний относительно того, какие процессы невозможны, даже если формально закон сохранения энергии выполняется. Так, из первого начала термодинамики не следует, что не может быть процесса, единственным результатом которого является передача тепла от холодного тела к горячему, если при этом выполняется энергетический баланс: переданная холодным телом теплота равняется увеличению внутренней энергии горячего тела плюс работа, совершаемая над окружающей средой. Иными словами, из первого начала термодинамики невозможно определить направление эволюции термодинамической системы, указать на необратимость того или иного процесса. Этот существенный момент нашел свое отражение во втором начале термодинамики, которое установлено эмпирическим путем и может быть сформулировано несколькими способами, которые эквивалентны друг другу. Ниже приводятся некоторые из формулировок второго начала термодинамики.
1. Теплота не может самопроизвольно перейти от холодного тела к горячему без каких-либо других изменений в системе или, иначе говоря, процесс, при котором единственным результатом является передача тепла от горячего тела к холодному, будет необратимым (принцип Клаузиуса).
2. Невозможен процесс преобразования в работу всего количества теплоты, взятой от тела с однородной температурой, без каких-либо других изменений состояния системы или, иначе говоря, процесс, при котором работа переходит в тепло без каких-либо изменений состояния системы, является необратимым (принцип Томсона).
3. Невозможно создать циклически работающую тепловую машину, которая производила бы работу за счет поглощения тепла от одного теплового резервуара, не совершая при этом никаких других изменений состояния системы (принцип невозможности вечного двигателя второго рода).
Все три формулировки второго начала эквивалентны. Чтобы это показать, рассмотрим тепловую машину.
2. Тепловая машина. КПД тепловой машины
Тепловой машиной называют устройство, позволяющее производить работу при циклическом теплообмене между термодинамической системой (рабочим телом) и окружающей средой (термостатом). Примерами тепловой машины могут служить паровые двигатели, двигатели внутреннего сгорания. Рассмотрим с общих позиций принцип действия тепловой машины и ее коэффициент полезного действия.
Как отмечалось ранее, для того чтобы работа за цикл была положительная (А > 0), ветвь расширения цикла в диаграмме р, V должна иметь более высокое давление, чем ветвь сжатия (см. рис. 28.3, а). Это означает, что при расширении термодинамическая система получает количество теплоты Q1 от окружающей среды с температурой Т1(нагреватель), а при сжатии отдает некоторое количество теплоты Q2 окружающей среде с более низкой температурой Т2 (холодильник), чем Т1. Схематично принцип действия тепловой машины представлен на рис. 29.1.
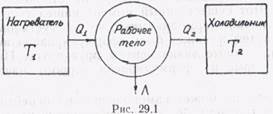
Коэффициент полезного действия тепловой машины η измеряется отношением работы А, совершаемой за цикл, к количеству теплоты Q1, полученной в цикле от нагревателя:
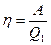 . (28.1)
. (28.1)
Из первого начала термодинамики для цикла имеем
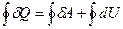 . (28.2)
. (28.2)
Учитывая, что
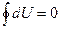 ,
, 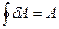 ,
, 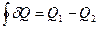 ,
,
из уравнения (28.2) получим
A = Q1 – Q2. (28.3)
Используя (28.3), выражение для КПД цикла (28.1) представится в виде
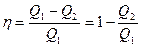 . (28.4)
. (28.4)
Как видно, тепловые машины работают таким образом, что рабочее вещество расширяется в результате поглощения тепла от резервуара, находящегося при высокой температуре Т1. Чтобы вернуться к первоначальному состоянию, это вещество нужно снова сжать и при этом передать некоторое количество тепла резервуару с более низкой температурой Т2.
Согласно формулировке 1 второго начала термодинамики, невозможно передать это тепло обратно к высокотемпературному резервуару без каких-либо других изменений. Следовательно, формулировка 2 второго начала термодинамики справедлива.
Наоборот, в силу формулировки «б» мы не можем извлечь тепло некоторого резервуара, превратить его в работу, а затем снова превратить в тепло (трением и т. д.) в резервуаре с более высокой температурой. Таким образом, из формулировки 2 вытекает формулировка 1.
Если бы утверждения 1 или 2 не выполнялись, то можно было бы получать тепло от резервуара с постоянной температурой и превращать его в работу при помощи циклического процесса. Это не нарушило бы первого закона термодинамики, который требует лишь, чтобы для каждого цикла выполнялось соотношение Q = А. С практической точки зрения такая машина была бы равноценна машине, способной совершать работу вечно, ибо в природе существуют источники неограниченных количеств тепла, например мировой океан. Подобную неосуществимую машину называют вечным двигателем второго рода. Утверждение о невозможности построить вечный двигатель второго рода эквивалентно формулировкам 1 и 2.
3. Цикл Карно, его КПД
Среди различных термодинамических циклов особое место занимает цикл Карно, рассмотренный впервые французским инженером и физиком Сади Карно.
Значение цикла Карно связано с тем, что он позволил проанализировать работу тепловой машины, и, что особенно важно, цикл является в ряде отношений оптимальным и может служить для анализа второго начала термодинамики.
Циклом Карно называется обратимый круговой процесс, происходящий с термодинамической системой (рабочим телом), которая получает от нагревателя тепло при неизменной температуре Т1 и отдает тепло холодильнику также при неизменной температуре Т2, т. е. изотермически. Изменение температуры рабочего тела от Т1до Т2 и обратно от Т2 до Т1совершается адиабатически. Таким образом, цикл Карно изображается двумя изотермами и двумя адиабатами (рис. 29.2).
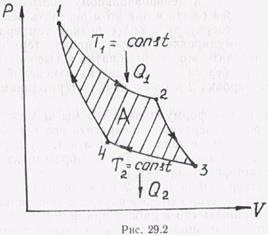
Предположим, что рабочим телом является газ, находящийся в цилиндре под поршнем. Пусть первоначально объем газа равен V1, а температура равна Т1(точка 1 на рис. 29.2). На участке цикла между точками 1 и 2 газ изотермически расширяется до объема V2, совершая работу за счет тепла Q1, получаемого от нагревателя. Чтобы процесс был обратимым, необходимо, чтобы температура нагревателя лишь на бесконечно малую величину превосходила температуру газа. Практически Т1— это температура и нагревателя, и газа. Размеры нагревателя предполагаются настолько большими, что передача тепла газу не повлияет на температуру нагревателя. Это обеспечивает изотермический характер процесса.
В точке 2 рабочее вещество теплоизолируется и на участке цикла 2—3 происходит адиабатическое расширение газа. На этом участке работа совершается газом за счет его внутренней энергии. Температура газа падает до температуры холодильника Т2.
На участке цикла 3—4 газ изотермически сжимается. Работа совершается внешними по отношению к газу силами, а газ отдает тепло Q2 холодильнику. В точке 4 газ теплоизолируется, и сжатие продолжается адиабатически. На участке цикла 4—1 внутренняя энергия газа растет и температура повышается до температуры нагревателя Т1. Газ возвращается в первоначальное состояние, совершив работу, равную площади, ограниченной графиком цикла.
Вычислим к.п.д. цикла Карно, считая, что он совершается идеальным газом. Согласно формуле (28.4), к.п.д. любой тепловой машины равен
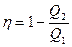 .
.
Количество тепла Q1 полученное от нагревателя идеальным газом при температуре Т1, равно работе, совершенной при изотермическом расширении газа от объема V1до объема V2. Поэтому согласно формуле (27.8) имеем
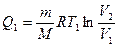 . (28.5)
. (28.5)
Количество тепла Q2, отданное холодильнику газом при температуре Т2, равно работе изотермического сжатия газа от объема Vздо V4:
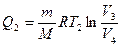 . (28.6)
. (28.6)
Из уравнения адиабаты (27.27) следует, что для участков цикла Карно 2—3 и 4—1 имеем
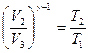 и
и 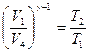 ,
,
откуда
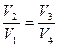 .
.
Таким образом, отношения объемов в формулах (28.5) и (28.6) для Q1 и Q2 оказываются равны между собой. С учетом этого обстоятельства после подстановки Q1 и Q2 в выражение для к.п.д. получаем, что для цикла Карно
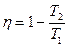 . (28.7)
. (28.7)
Покажем теперь, что к.п.д. η' любой тепловой машины М′, получающей тепло от нагревателя при температуре Т1и отдающей тепло холодильнику при температуре Т2, не может превосходить к.п.д. ηобр обратимой тепловой машины Карно М, работающей между теми же температурными пределами.
Пусть Q1 и Q1′ — количества теплоты, полученные машинами М и М' за один цикл от нагревателя с температурой Т1; Q2и Q2' — количества теплоты, отданные этими машинами за цикл холодильнику с температурой Т2(Т1 > Т2). Согласно первому началу термодинамики, работы, совершаемые машинами М и М' за цикл, будут соответственно равны
А = Q1 - Q2 и А' = Q1′ - Q2'. (28.8)
Поскольку машина Карно М обратима, заставим ее совершать цикл в обратном направлении (в этом случае работа будет отрицательна А < 0), в то время как машина М' совершает прямой цикл.
При этом пусть нагреватель Т1не отдает и не получает тепла (Q1 = Q1′). Тогда результат совершения этих двух циклов выразится полной работой:
Аполн = А' - А = Q2 - Q2', (28.9)
где были использованы соотношения (28.8) при Q1 = Q1′.
Если бы Аполн > 0, то это противоречило бы второму началу термодинамики (принцип Томсона), так как тогда бы тепло, отнятое у холодильника, в периодически действующей машине целиком превращалось бы в работу. Поэтому должно быть
Аполн = Q2 - Q2' ≤ 0,
откуда
Q2≤ Q2'
или
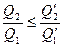 (28.10)
(28.10)
при Q1 = Q1′.
Используя соотношение (28.10), получаем, что к.п.д. η' тепловой машины М' и к.п.д. ηобр машины М, работающей по обратимому циклу Карно, находятся в соотношении
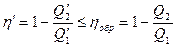 . (28.11)
. (28.11)
Из (28.11) следует весьма важное для практики заключение: ни в какой тепловой машине не может быть превзойден так называемый термодинамический коэффициент полезного действия 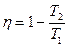 обратимой тепловой машины Карно.
обратимой тепловой машины Карно.
В тепловой машине, использующей необратимый цикл, к.п.д. всегда меньше, чем в машине, работающей по обратимому циклу в том же температурном пределе от Т1до Т2. Это связано с потерями энергии, обусловленными трением, теплопроводностью и другими необратимыми явлениями.
4. Неравенство Клаузиуса
Поскольку к.п.д. тепловой машины, работающей по обратимому циклу, 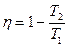 , из выражения (28.11) вытекает в общем случае следующее соотношение:
, из выражения (28.11) вытекает в общем случае следующее соотношение:
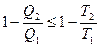 , (28.12)
, (28.12)
в котором знак равенства берется в случае обратимого цикла и знак неравенства — для необратимого цикла.
Путем элементарных алгебраических преобразований из (28.12) получаем
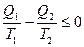 . (28.13)
. (28.13)
Если Q2, теплоту, отдаваемую термодинамической системой окружающей среде, рассматривать как отрицательное количество теплоты, получаемое системой от внешней среды, то (28.13) представляется в виде
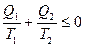 . (28.14)
. (28.14)
Отношение количества тепла Q, получаемого системой от какого-либо тела, к абсолютной температуре Т тела, при которой происходит теплопередача, 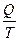 называется приведенной теплотой. Эту терминологию предложил Клаузиус. Используя терминологию Клаузиуса, соотношение (28.14) означает следующее: если термодинамическая система совершает цикл, в ходе которого она вступает в теплообмен с двумя тепловыми резервуарами (телами), температуры которых постоянны (T1 = const, T2 = const), то сумма приведенных количеств теплоты равна нулю, если цикл обратим, и меньше нуля, если цикл необратим.
называется приведенной теплотой. Эту терминологию предложил Клаузиус. Используя терминологию Клаузиуса, соотношение (28.14) означает следующее: если термодинамическая система совершает цикл, в ходе которого она вступает в теплообмен с двумя тепловыми резервуарами (телами), температуры которых постоянны (T1 = const, T2 = const), то сумма приведенных количеств теплоты равна нулю, если цикл обратим, и меньше нуля, если цикл необратим.
Если система в ходе цикла вступает в тепловой контакт с N телами, то выполняется соотношение
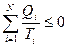 . (28.15)
. (28.15)
В выражении (28.15) предполагается, что температура каждого из N тел, обменивающихся теплом с системой, в ходе цикла не изменяется (Тi = const). Если это не так, т. е. температура i-го тела Ti при передаче тепла Qi системе меняется, то можно каждый из процессов теплопередачи разбить на ряд элементарных процессов, чтобы передачу тепла δQ в каждом из них можно было считать происходящей при постоянной температуре Т. Тогда в ходе цикла будем иметь:
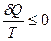 , (28.16)
, (28.16)
т. е. сумма элементарных приведенных количеств тепла, получаемых термодинамической системой за цикл, равна нулю, если цикл обратимый, и меньше нуля, если цикл необратимый.
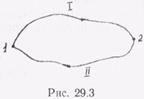 Выражения (28.15) или (28.16) известны в термодинамике как неравенство Клаузиуса. Сумму приведенных количеств тепла можно рассматривать не только для циклов, но и для любого нециклического процесса. Для обратимых процессов эта сумма обладает следующим свойством: она не зависит от формы пути (от способа), по которому термодинамическая система переходит от начального состояния к конечному. Действительно, представим себе некоторый обратимый цикл, который разобьем на два участка (пути) I (1—2) и II (2—1) (рис. 29.3).
Выражения (28.15) или (28.16) известны в термодинамике как неравенство Клаузиуса. Сумму приведенных количеств тепла можно рассматривать не только для циклов, но и для любого нециклического процесса. Для обратимых процессов эта сумма обладает следующим свойством: она не зависит от формы пути (от способа), по которому термодинамическая система переходит от начального состояния к конечному. Действительно, представим себе некоторый обратимый цикл, который разобьем на два участка (пути) I (1—2) и II (2—1) (рис. 29.3).
На основании неравенства Клаузиуса (28.16) для такого цикла имеем
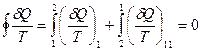 . (28.17)
. (28.17)
Поскольку цикл обратимый, то изменение направления перехода на участке II (2→1) на противоположное II (1→2) приведет к изменению знака 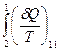 на противоположный, т. е.
на противоположный, т. е.
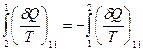 .
.
С учетом этого обстоятельства из (28.17) вытекает, что
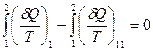 или
или 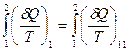 .
.
Таким образом, сумма элементарных количеств теплоты, получаемых системой при обратимом переходе из состояния 1 в другое состояние 2, не зависит от формы пути, по которому совершается переход, и зависит, следовательно, только от начального (1) и конечного (2) состояния.
| <== предыдущая лекция | | | следующая лекция ==> |
| Внутренняя энергия системы. Работа и теплота | | | Энтропия, ее свойства |
Дата добавления: 2016-05-25; просмотров: 1443;
