Термодинамические процессы в реальных газах. Диаграммы
Фазовым переходом называется переход вещества из одной фазы в другую, сосуществующую с первой. В термодинамике рассматриваются три фазовых состояния вещества: твердое, жидкое и газообразное.
При рассмотрении процессов с фазовыми переходами удобно пользоваться диаграммой 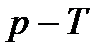 (рис. 8).
(рис. 8).
 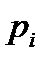 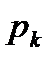 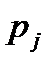  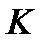  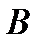 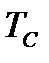 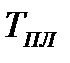 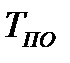 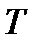 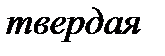 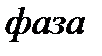 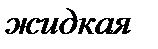 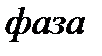 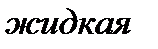 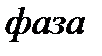 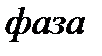 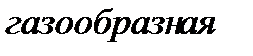
|
На диаграмме 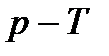 имеются три основных кривых:
имеются три основных кривых:
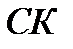 – кривая сублимации;
– кривая сублимации;
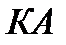 – кривая плавления;
– кривая плавления;
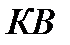 – кривая насыщения.
– кривая насыщения.
Кривые имеют общую точку 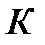 , называемую критической точкой.
, называемую критической точкой.
Рис. 8. 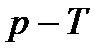 диаграмма и фазовые
состояния вещества диаграмма и фазовые
состояния вещества
|
Вещество, находящееся левее кривой 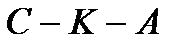 находится в твердой фазе; выше кривой
находится в твердой фазе; выше кривой 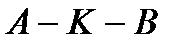 – в жидкой фазе; правее кривой
– в жидкой фазе; правее кривой 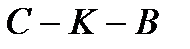 – в газообразной фазе. В критической точке
– в газообразной фазе. В критической точке 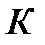 (ее также называют тройной точкой) возможно сосуществование всех трех фаз вещества.
(ее также называют тройной точкой) возможно сосуществование всех трех фаз вещества.
Фазовый переход из твердой фазы в жидкую называется плавлением; из жидкой в газообразную – парообразованием; из твердой в газообразную – сублимацией. Обратные переходы (процессы, обратные плавлению и парообразованию) называются кристаллизацией и конденсацией.
Как правило, кривые плавления, насыщения и сублимации имеют в 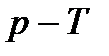 диаграмме положительный наклон. Исключение составляет аномальное поведение кривой плавления некоторых веществ (например воды, висмута, сурьмы).
диаграмме положительный наклон. Исключение составляет аномальное поведение кривой плавления некоторых веществ (например воды, висмута, сурьмы).
На диаграмме 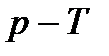 легко отслеживать фазовые переходы вещества и температуры плавления (кристаллизации), испарения (конденсации) и сублимации для каждого конкретного давления. Например, для давления
легко отслеживать фазовые переходы вещества и температуры плавления (кристаллизации), испарения (конденсации) и сублимации для каждого конкретного давления. Например, для давления 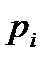 (рис. 8), вещество будет плавиться (кристаллизоваться) при температуре
(рис. 8), вещество будет плавиться (кристаллизоваться) при температуре 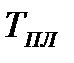 , и испаряться (конденсироваться) при температуре
, и испаряться (конденсироваться) при температуре 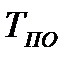 . При давлениях ниже критического, будет происходить только процесс сублимации.
. При давлениях ниже критического, будет происходить только процесс сублимации.
Для перехода вещества из одной фазы в другую необходимо затратить некоторое количество теплоты, называемое теплотой фазового перехода. Эта теплота тратится на разрушение внутримолекулярных связей в процессе парообразования или сублимации и на разрушение кристаллической решетки в процессе плавления.
Теплота, затраченная для фазового перехода на 1 кг вещества, называется удельной. В зависимости от процесса фазового перехода различают:
- удельную теплоту плавления;
- удельную теплоту парообразования;
- удельную теплоту сублимации.
В обратных переходах выделяется точно такое же количество теплоты, которое было затрачено на прямой переход.
При исследованиях различных процессов, происходящих с водой и водяным паром широко используются 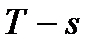 и
и 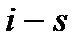 диаграммы воды и водяного пара.
диаграммы воды и водяного пара.
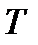
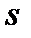
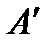
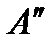
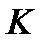
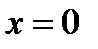
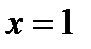
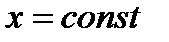
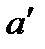
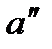
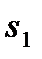
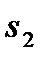
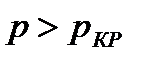
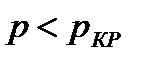
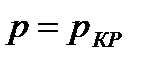
На диаграмму 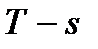 наносится пограничная кривая
наносится пограничная кривая 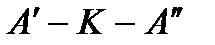 – линия насыщения (рис. 9). Крити-ческая точка
– линия насыщения (рис. 9). Крити-ческая точка 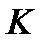 делит линию насыщения на две части:
делит линию насыщения на две части: 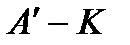 – нижнюю погранич-ную кривую;
– нижнюю погранич-ную кривую; 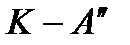 – верхнюю пограничную кри-вую. Влево от нижней пограничной кривой распо-лагается область жидкости, вправо и вверх от верхней пограничной кривой – область перегретого пара, между пограничными кри-выми – двухфазная область влажного насыщенного пара.
– верхнюю пограничную кри-вую. Влево от нижней пограничной кривой распо-лагается область жидкости, вправо и вверх от верхней пограничной кривой – область перегретого пара, между пограничными кри-выми – двухфазная область влажного насыщенного пара.
Рис. 9.  диаграмма воды и водяного пара. диаграмма воды и водяного пара.
|
Насыщенным называется пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется. Насыщенный пар, в котором отсутствуют взвешенные частицы жидкости, называется сухим насыщенным паром. Двухфазная смесь, представляющая собой смесь пара со взвешенными частицами жидкости, называется влажным насыщенным паром.
Массовая доля сухого насыщенного пара во влажном называется степенью сухости пара и обозначается – 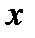 .
.
На диаграмму 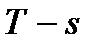 наносятся линии постоянной степени сухости пара –
наносятся линии постоянной степени сухости пара – 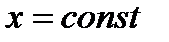 , исходящие из критической точки. Причем нижняя пограничная кривая представляет собой линию постоянной степени сухости пара
, исходящие из критической точки. Причем нижняя пограничная кривая представляет собой линию постоянной степени сухости пара 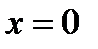 (чистая вода), а верхняя пограничная кривая – линию постоянной степени сухости пара
(чистая вода), а верхняя пограничная кривая – линию постоянной степени сухости пара 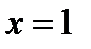 (сухой насыщенный пар).
(сухой насыщенный пар).
Площадь диаграммы под горизонтальным участком докритической изобары численно равна теплоте парообразования – 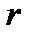 при данном давлении.
при данном давлении.
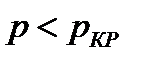 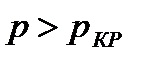 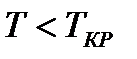 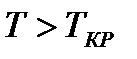 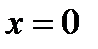 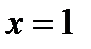 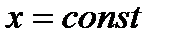     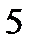 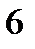 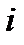 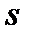
|
В 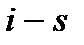 диаграмме (рис. 10) несколько необычно располо-жение критической точки – левее максимума пограничной кривой. Изобары в двухфазной области влажного насыщенного пара представляют собой пучок расходящихся прямых. Изотермы в этой области совпадают с изобарами. Изобары, пересекая линию насыщения, не имеют изломов, в отличие от изотерм. В области перегрева температура пара (при постоянном давлении) растет с увеличением энтропии примерно по логарифмичес-кому закону.
диаграмме (рис. 10) несколько необычно располо-жение критической точки – левее максимума пограничной кривой. Изобары в двухфазной области влажного насыщенного пара представляют собой пучок расходящихся прямых. Изотермы в этой области совпадают с изобарами. Изобары, пересекая линию насыщения, не имеют изломов, в отличие от изотерм. В области перегрева температура пара (при постоянном давлении) растет с увеличением энтропии примерно по логарифмичес-кому закону.
Рис. 10. Диаграмма 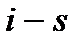 для воды и водяного
пара. для воды и водяного
пара.
|
В 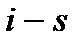 диаграмме наносятся также изохоры, которые расположены под большим углом, чем изобары.
диаграмме наносятся также изохоры, которые расположены под большим углом, чем изобары.
Изображение основных термодинамических процессов в i – s диаграмме показано на рис. 10:
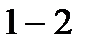 – адиабатное расширение пара;
– адиабатное расширение пара;
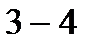 – изохорный процесс;
– изохорный процесс;
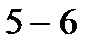 – изоэнтальпный процесс (
– изоэнтальпный процесс ( 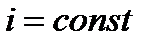 ) – дросселирование.
) – дросселирование.
Дросселированием называется необратимый термодинамический процесс уменьшения давления газа или жидкости в результате которого не происходит увеличения кинетической энергии и не совершается никакая техническая работа.
Дата добавления: 2016-05-25; просмотров: 1033;
