Термодинамические процессы в идеальных газах
В соответствии с уравнением состояния, изменение какого-либо термодинамического параметра системы приводит к изменению термодинамического состояния всего тела. Переход тела из одного термодинамического состояния в другое называетсятермодинамическим процессом.
Термодинамические процессы, происходящие в системе с постоянной массой при каком-либо постоянном параметре называются изопроцессами.
Различают следующие изопроцессы:
· изохорный (  ) – протекающий при постоянном объеме;
) – протекающий при постоянном объеме;
Для изохорного процесса справедливо равенство вида:
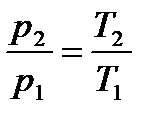
т.е. давление газа прямо пропорционально его абсолютной температуре;
· изобарный ( 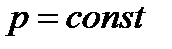 ) – протекающий при постоянном давлении;
) – протекающий при постоянном давлении;
Для изобарного процесса справедливо равенство вида:

т.е. при изобарном процессе объем газа пропорционален его абсолютной температуре;
· изотермический ( 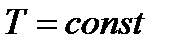 ) – протекающий при постоянной температуре; Для изотермического процесса справедливо равенство вида:
) – протекающий при постоянной температуре; Для изотермического процесса справедливо равенство вида:
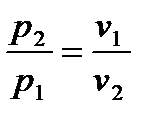
т.е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – уменьшается;
· адиабатный( 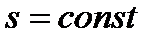 ) – процесс, протекающий без теплообмена с внешней средой (без изменения энтропии тела). Часто этот процесс называют изоэнтропным. Чтобы осуществить такой процесс, необходимо теплоизолировать тело от окружающей среды, т.е. поместить его в «адиабатную оболочку», либо провести этот процесс настолько быстро, чтобы изменение температуры газа, обусловленное теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа.
) – процесс, протекающий без теплообмена с внешней средой (без изменения энтропии тела). Часто этот процесс называют изоэнтропным. Чтобы осуществить такой процесс, необходимо теплоизолировать тело от окружающей среды, т.е. поместить его в «адиабатную оболочку», либо провести этот процесс настолько быстро, чтобы изменение температуры газа, обусловленное теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа.
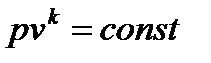 В большинстве случаев для адиабатных процессов можно пользоваться соотношением:
В большинстве случаев для адиабатных процессов можно пользоваться соотношением:
где: 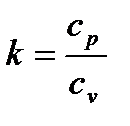 – показатель адиабаты для идеального газа.
– показатель адиабаты для идеального газа.
Кроме того для адиабатного процесса идеальных газов справедливы соотношения:
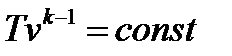
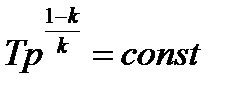
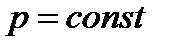 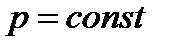 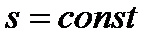 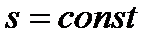 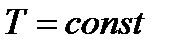 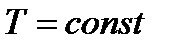 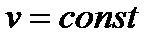 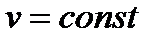   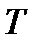 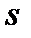
|
Рис. 7. Изображение основных изопроцессов в координатах 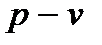 и
и 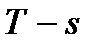 .
.
Изображение любых термодинамических процессов на диаграммах выглядит как линия, соединяющая начальную и конечную точки, характеризующие начальное и конечное термодинамические состояния вещества. Изображение изопроцессов для идеального газа в 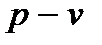 и
и  координатах показано на рис. 7:
координатах показано на рис. 7:
Процессы, находящиеся правее изохоры ( 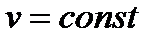 ), характеризуются положительной работой, так как сопровождаются расширением рабочего тела. Для процессов, расположенных левее изохоры, характерна отрицательная работа.
), характеризуются положительной работой, так как сопровождаются расширением рабочего тела. Для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты ( 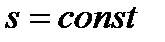 ), идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
), идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой (  ), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, поэтому на производство работы тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
Все рассмотренные изопроцессы являются частными случаями огромного семейства политропных процессов, описываемых для идеального газа соотношениями:
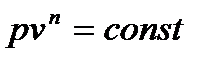

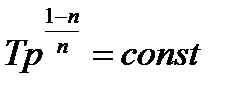
где:
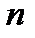 – показатель политропы – величина постоянная для данного процесса.
– показатель политропы – величина постоянная для данного процесса.
Политропные процессы, в зависимости от значения показателя политропы – 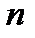 , принимают следующий вид:
, принимают следующий вид:
при 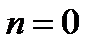 – процесс становится изобарным;
– процесс становится изобарным;
при 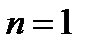 – процесс становится изотермическим;
– процесс становится изотермическим;
при  – процесс становится изохорным;
– процесс становится изохорным;
при 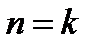 – процесс становится адиабатным.
– процесс становится адиабатным.
Дата добавления: 2016-05-25; просмотров: 1065;
