Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева.
Гидриды. В соединениях с неметаллами водород проявляет степень окисления +1. Поскольку энергия ионизации водорода очень большая, химическая связь его с неметаллами не ионная, а полярно-ковалентная. Наиболее электроотрицательные р-элементы в правой части периодов, например сера и хлор, реагируют с водородом, образуя ковалентные гидриды, которые обладают кислотными свойствами и сила этих кислот увеличивается по мере увеличения размера атома присоединяемого к водороду неметалла. Исключениями являются метан СН4, представляющий собой нейтральное соединение, а также аммиак NH3, обладающий основными свойствами. Водородные соединения неметаллов хорошо растворимы в воде и образуют кислоты с теми же формулами.
Более электроотрицательные р-элементы, например алюминий, кремний и фосфор, в нагретом состоянии не реагируют с водородом.
В отличие от металлов неметаллы образуют газообразные водородные соединения. Их состав зависит от степени окисления неметаллов.
RH4 → RH3 → H2R → HR
Летучие водородные соединения неметаллов можно разделить на три группы:
1) Хорошо растворимые в воде (HCl, HBr, HJ, H2S, H2Se, NH3), которые диссоциируют на ионы, проявляя кислотные и основные свойства.
2) Соединения, разлагаемые водой:
BH3 + 3H2O = H3BO3 + 3H2↑
3) Летучие водородные соединения
CH4, PH3, которые не взаимодействуют с водой.
По периоду в ПС химических элементов с увеличением порядкового номера элемента – неметалла усиливается кислотный характер водородного соединения.
SiH4 → PH3 → H2S → HCl
Билет №14.
Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Реакционная способность элементов во взаимодействии с кислородом, вообще говоря, уменьшается при перемещении вправо вдоль каждого периода. Например, в 3-м периоде два s-металла, натрий и магний, и два р-элемента, алюминий и фосфор, бурно реагируют с кислородом, образуя оксиды. В том же периоде элементы кремний и сера способны только медленно реагировать с кислородом. Хлор и аргон, расположенные в правом конце периода, вообще не реагируют с кислородом.
Электроположительные s-металлы образуют ионные оксиды, как, например, оксид натрия Na2O и оксид магния MgO. Оксиды элементов, расположенных в средней и правой частях периода, являются преимущественно ковалентными соединениями, как, например, оксиды азота и серы.
Кислотно-основный характер оксидов тоже изменяется от основного у оксидов элементов левой части периода к амфотерному у оксидов элементов средней части периода и далее к кислотному у оксидов элементов правой части периода. Например, s-металлы обычно образуют оксиды, которые растворяются в воде с образованием щелочных растворов:
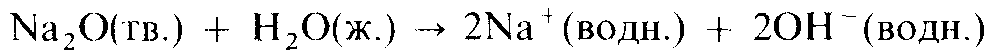
Молекулярные оксиды р-элементов, например диоксид углерода и триоксид серы, обычно обладают кислотными свойствами. Закономерное изменение основных свойств с переходом к кислотным свойствам наглядно проявляется у оксидов элементов 3-го периода.
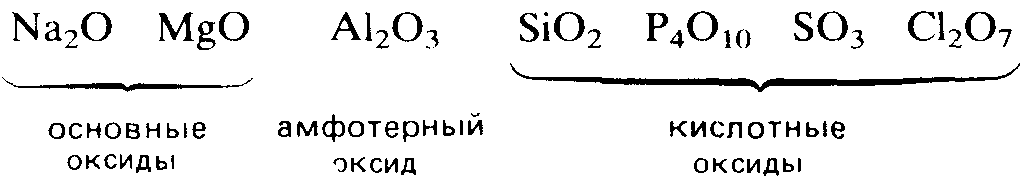
Билет №15.
Кислоты, их классификация и химические свойства на основе представлений об электролитической диссоциации. Особенности свойств концентрированной серной кислоты на примере взаимодействия с медью.
Дата добавления: 2016-05-11; просмотров: 13041;
