Открытие электрических явлений в животных тканях. Понятие о процессе возбуждения
Л. Гальвани (1786 г.) провел два опыта на препаратах задних лапок лягушек со снятой кожей. В первом опыте, подвешивая препарат с помощью медного крючка железным перилам балкона, он наблюдал сокращение мышц, когда те касались перил балкона. Он предположил, что сокращение мышц возникало как следствие воздействия на них электричества, источник которого являются «животные ткани» - мышцы и нервы. Однако физик А. Вольта оспорил гипотезу А. Гальвани. Причиной сокращения мышц, по мнению А. Вольта, был электрический ток, возникающий в области контакта двух разнородных металлов (медь и железо - гальваническая пара) с тканями лягушки.
А. Гальвани поставил второй опыт, в котором он набрасывал нерв нервно-мышечного препарата на мышцу стеклянным крючком так, чтобы тот касался поврежденного и неповрежденного участков мышцы. В этом случае мышца тоже сокращалась. Во втором опыте А. Гальвани доказал существование «животного» электричества.Позже оно было зарегистрировано К. Маттеучи (1838) с помощью гальванометра. Одну из клемм прибора он присоединял к поврежденному участку мышцы, другую - к неповрежденному, при этом стрелка гальванометра отклонялась. Размыкание цепи прибора сопровождалось возвращением стрелки гальванометра в прежнее (нулевое) положение.
Для регистрации используется внутриклеточная и внеклеточная регистрация электрических потенциалов с помощью монополярных, биполярных, мультиполярных электродов (металлических и стеклянных).
В случае монополярного отведения один электрод активный, другой - индифферентный, площадь которого в десятки раз больше площади активного электрода. При внутриклеточном отведении применяется стеклянный микроэлектрод, представляющий собой микропипетку с кончиком диаметром 0,5-1 мкм (рис. 1, Б).
Микроэлектрод заполнен 3М КС1, в его широкую часть вставлена тонкая проволока (например, серебряная), соединенная с регистрирующим устройством. В качестве индифферентного внеклеточного электрода часто используют хлорированную серебряную пластинку.
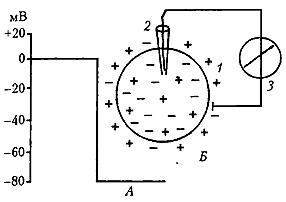
Рис. 1. Потенциал покоя возбудимой клетки (А) и схема его регистрации (Б): 1 – клетка; 2 – микроэлектрод; 3 – регистратор (Агаджанян, 2007)
Микроэлектродный способ регистрации биопотенциалов позволил изучить механизмы создания электрических зарядов клеткой, возникновения возбуждения в живых клетках.
Природа процесса возбуждения заключается в следующем. Все клетки организма имеют электрический заряд, создаваемый неодинаковой концентрацией анионов и катионов внутри и вне клетки. Различная концентрация анионов и катионов внутри и вне клетки является следствием неодинаковой проницаемости клеточной мембраны для разных ионов и работы ионных насосов. При действии раздражителя на возбудимую клетку сначала, как правило, обычно очень быстро повышается проницаемость ее мембраны для Na+ и быстро возвращается к норме, затем - для К+ и тоже быстро, но с некоторым отставанием возвращается к норме. Вследствие этого ионы перемещаются в клетку и из нее согласно электрохимическому градиенту (совокупность концентрационного и электрического градиентов) – это и есть процесс возбуждения.
Возбуждение возможно только в том случае, если клетка постоянно поддерживает ПП (потенциал покоя, мембранный потенциал).
Потенциал покоя
ПП - это разность электрических потенциалов между внутренней и наружной средой клетки в состоянии ее покоя. При регистрации ПП луч осциллографа во время прокола мембраны клетки микроэлектродом скачком отклоняется вниз и показывает отрицательный заряд внутри (см. рис. 1, А). Величина ПП обычно варьирует в пределах -30-90 мВ (в волокнах скелетной мышцы -60-90 мВ, в нервных клетках -50-80 мВ, в гладких мышах -30-70 мВ, в сердечной мышце -80-90 мВ). Органеллы клеток имеют собственные заряды, величина которых вариабельна. Например, у митохондрий этот потенциал составляет 175 мВ.
Роль ПП: является основной для возникновения возбуждения потенциала действия (ПД). ПП – это признак жизни самой клетки и организма в целом.
Непосредственной причиной существования ПП является неодинаковая концентрация анионов и катионов внутри и вне клетки (рис. 2)
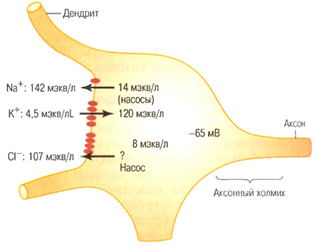
Рис. 2. Распределение ионов Na+, K+ и Cl- по обе стороны мембраны сомы нейрона; рисунок иллюстрирует происхождение мембранного потенциала сомы нейрона (Гайтон, 2008)
В нервных и мышечных клетках концентрация К+ внутри клетки примерно в 40 раз больше, чем вне клетки; концентрация Na+ вне клетки в 14 раз больше, нежели в клетке (табл. 1).
Таблица 1. Внутри- и внеклеточная концентрация ионов (мМ) в мышечных клетках гомойотермных животных
| Внутриклеточная | Внеклеточная | ||
| Na+ | Na+ | ||
| K+ | K+ | ||
| Cl- | Cl- | ||
| HCO3- | HCO3- | ||
| A-* | Прочие катионы |
*А- высокомолекулярные внутриклеточные анионы
Ионов С1- вне клетки 20 раз больше, чем внутри клетки. В клетке имеется большое количество ионов Mg+. Кальций в свободном (ионизированном) состоянии находится в основном вне клетки. В клетке находятся также крупномолекулярные анионы, главным образом это глутамат, аспартан, а также органические сульфаты, фосфаты.
Неравномерное расположение ионов внутри и вне клетки является, во-первых, следствием неодинаковой проницаемости клеточной мембраны для различных ионов, и во-вторых, - работы ионных насосов, транспортирующих ионы в клетку и из клетки вопреки их электрохимическим градиентам.
Проницаемость клеточной мембраны – это ее способность пропускать воду, незаряженные и заряженные частицы (ионы) согласно законам диффузии и фильтрации. Проницаемость определяется, во-первых, размерами пор клеточной мембраны или каналов (управляемых, с воротным механизмом, и неуправляемых, без воротного механизма, и размерами частиц; во-вторых – растворимостью частиц в мембране (клеточная мембрана проницаема для растворимых в ней липидов и непроницаема для пептидов). Термин «проводимость» следует использовать только лишь применительно к заряженным частицам. Следовательно, проводимость – это способность заряженных частиц (ионов) проходить через клеточную мембрану согласно электрохимическому градиенту.
Следует подчеркнуть, что проводимость иона зависит от его электрохимического градиента и от проницаемости мембраны: чем они больше, тем лучше проводимость иона через мембрану. Перемещения ионов в клетку и из нее осуществляются согласно концентрационному и электрическому градиентам с состоянии покоя клетки, преимущественно через неуправляемые (без воротного механизма) каналы, которые называются также каналами утечки ионов. Неуправляемые каналы всегда открыты, они практически не меняют своей пропускной способности при электрическом воздействии на клеточную мембрану и ее возбуждении. Однако движение ионов в клетку и из нее зависит и от электрического заряда клетки: одинаково заряженные ионы отталкиваются, а с противоположными зарядами – притягиваются.
Роль проницаемость клеточной мембраны и различных ионов и формировании ПП. В состоянии покоя клетки К+ выходит из нее значительно больше, чем входит Na+, поскольку проницаемость клеточной мембраны для К+ примерно в 25 раз больше проницаемости ее для Na+. Органические анионы из-за своих больших размеров вообще не могут выходить из клетки, поэтому внутри клетки, пребывающей в состоянии покоя, отрицательных ионов оказывается больше, чем положительных. По этой причине клетка внутри имеет отрицательный заряд. Основные анионы, находящиеся в клетке, - это глутамат, аспартан, органические фосфаты, сульфаты.
Важно отметить, что во всех точках клетки отрицательный заряд практически одинаков. Об этом свидетельствует одинаковая величина ПП при введении микроэлектрода на разную глубину внутрь клетки, что имело место в опытах Ходжкина, Хаксли и Катца. Гигантский аксон кальмара (диаметр около 1 мм) в этом опыте находился в морской воде; один электрод вводили в аксон, другой – помещали в морскую воду. Заряд внутри клетки является отрицательным как абсолютно (в гиалоплазме клетки содержится больше анионов, нежели катионов), так и относительно наружной поверхности клеточной мембраны. Однако превышение абсолютного числа анионов над числом катионов в клетке чрезвычайно мало. Но этого различия достаточно для создания разности электрических потенциалов внутри и вне клетки и для возникновения ПД при раздражении клетки.
Калий является основным ионом, обеспечивающим формирование ПП. Об этом свидетельствует результаты опыта с перфузией внутреннего содержимого гигантского аксона кальмара солевыми растворами. При уменьшении концентрации К+ в перфузате ПП уменьшается, при увеличении концентрации К+ - увеличивается. В покоящейся клетке устанавливается динамическое равновесие между числом входящих из клетки и входящих в нее ионов К+. Электрический и концентрационный градиенты противодействуют друг другу: согласно концентрационному градиенту, К+ стремится выйти из клетки, а отрицательный заряд внутри клетки и положительный заряд наружной поверхности клеточной мембраны препятствуют этому. Когда концентрационный и электрический градиенты уравновешиваются, число выходящих из клетки ионов К+ становится равным числу входящих в клетку ионов К+. В этом случае на клеточной мембране устанавливается так называемый равновесный К-потенциал. Равновесный потенциал для любого иона можно рассчитать по формуле Нернста. Внеклеточная концентрация положительно заряженного иона приводится в числителе, внутриклеточная концентрация этого иона – в знаменателе; для отрицательно заряженных ионов расположение этих параметров противоположное:
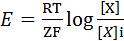 0,
0,
где Ех – потенциал, создаваемый данным ионом (Х); R – газовая постоянная (8,31 Дм); Т – абсолютная температура (273 + 37 °С); Z- валентность иона; F-постоянная Фарадея (9,65×104); 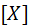 o- концентрация иона во внешней среде клетки (outside);
o- концентрация иона во внешней среде клетки (outside); 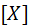 i-концентрация иона внутри клетки (inside).
i-концентрация иона внутри клетки (inside).
Равновесный потенциал для К+ при температуре 37°С с учетом соотношения концентрации его снаружи и изнутри (1/39) и валентности 1 равен - 97 мВ. Однако реальный ПП миоцита теплокровного животного несколько больше – около -90 мВ. То объясняется тем, что в создании ПП принимают участие и другие ионы, хотя их роль менее значительна в сравнении с ролью иона К+. Равновесный потенциал для Na+ равен +55 мВ. В целом ПП - это алгебраическая сумма равновесных потенциалов всех ионов, находящихся внутри и вне клетки, и поверхностных зарядов клеточной мембраны, которые имеют гликопротеиды, фосфолипиды и гликолипиды.
Вклад С1- и Na+ в создание ПП невелик, так как проницаемость клеточной мембраны в покое для этих ионов очень низкая – намного ниже, чем для К+. Роль ионов Са2+ в формировании ПП заключается в том, что они взаимодействуют с наружными отрицательными фиксированными зарядами мембраны клетки и отрицательными карбоксильными группами интерстиция, нейтрализуют их, что ведет к увеличению ПП и стабилизации его.
Роль проницаемости клеточной мембраны в формировании ПП иллюстрируется на модельном опыте (рис. 3).
Сосуд разделен полупроницаемой мембраной. Обе его половины заполнены растворами K2SO4 причем С1 и С2, причем С1< С2. Мембрана проницаема для К+ и непроницаема для SO42-. Ионы К+ перемещаются согласно концентрационному градиенту из раствора С2 в раствор С1. Поскольку ионы SO42- не могут пройти в раствор С1, где их концентрация тоже ниже, между растворами С1 и С2 и формируется разность электрических потенциалов, соответствующая равновесному калиевому потенциалу (Ек). В растворе С2 остается больше отрицательно заряженных ионов.
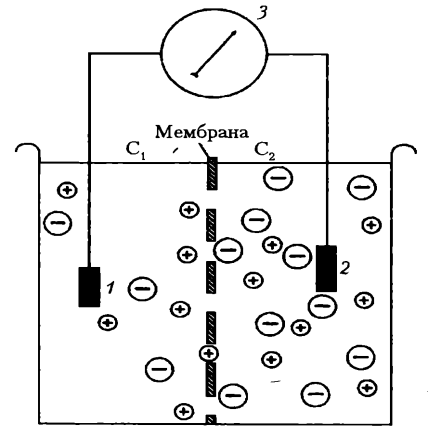
Рис. 3. Модельный опыт, иллюстрирующий роль избирательной проницаемости мембраны для отдельных ионов в формировании потенциала покоя. Раствор K2SO4, С- концентрация, С1<С2: 1,2 – электроды; 3 – регистратор; малые кружки ионы K+; большие кружки – ионы SO42-
Поверхностные заряды клеточной мембраны также участвуют в формировании ПП, они преимущественно с отрицательным знаком. Это полярные молекулы клеточной мембраны – гликопротеиды, гликолипиды, фосфолипиды. Фиксированные наружные отрицательные заряды, нейтрализуя положительные заряды внешней поверхности мембраны, уменьшают ПП. Фиксированные внутренние отрицательные заряды клеточной мембраны, напротив, суммируясь с анионами внутри клетки, увеличивают ПП. Таким образом, ПП – это алгебраическая сумма всех зарядов ионов вне и внутри клетки и поверхностных зарядов самой клеточной мембраны.
Повреждение клетки приводит к повышению проницаемости ее мембраны, в результате чего различие в проницаемости для К+ и Na+ уменьшается; ПП при этом снижается. Подобные изменения встречаются при ишемии ткани, например, миокарда.
Роль ионных насосов в формировании ПП. Ионный насос – это транспортная система, обеспечивающая перенос иона с непосредственной затратой энергии вопреки концентрационному и электрическому градиентам. В мембране возбудимых клеток имеется Nа/К – насос, который за один цикл выкачивает из клетки 3 иона и закачивает в клетку 2 иона калия. Ассиметричный перенос ионов Nа/К - насосом поддерживает избыток положительно заряженных частиц вне клетки и отрицательных зарядов внутри клетки, т.е. Nа/К – насос электрогенный, дополнительно увеличивает ПП примерно на -10%. Это говорит о том, что решающим фактором в формировании ПП является селективная проницаемость клеточной мембраны для разных ионов. Если уровнять проницаемость клеточной мембраны для всех ионов, то ПП будет составлять только -10 мВ – за счет работы Nа/К- помпы.
Потенциал действия
ПД – это электрофизиологический процесс, выражающийся в быстром колебании мембранного потенциала вследствие изменения проницаемости клеточной мембраны и диффузии ионов в клетку и из клетки и способный распространятся без затухания.
Роль ПД: обеспечивает передачу сигналов между нервными клетками, нервными центрами и рабочими органами; в мышцах обеспечивает процесс электромеханического сопряжения. Схема ПД представлена на рис. 4, А.
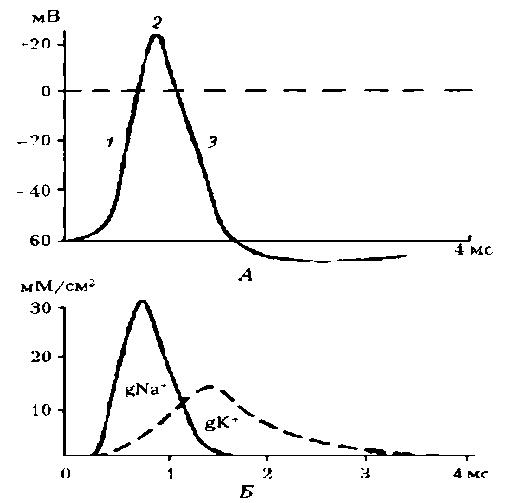
Рис. 4. Процесс возбуждения клетки: А – схема ПД; его фазы: 1 – деполяризация, 2 – инверсия, 3 – реполяризация; Б – изменение проводимости ионов натрия (gNa+) и (gK+) через мембрану гигантского аксона кальмара во время ПД (согласно расчетам)
Параметры ПД вариабельны: амплитуда - -80-130 мВ; длительность ПД нервного волокна составляет 1-2 мс, волокна скелетной мышцы – до 10 мс с учетом замедления реполяризации в конце ее.
Длительность ПД сердечной мышцы – около 300 мс. Амплитуда ПД не зависит от силы раздражения – она всегда максимальна для данной клетки в конкретных условиях: ПД подчиняется закону «все или ничего», но не подчиняется закону силы. ПД либо совсем не возникает при раздражении клетки, если оно мало, либо достигает максимальной величины, если раздражение является пороговым или сверхпороговым. Следует отметить, что слабое (подпороговое) раздражение может вызвать локальный потенциал (ЛП). Он подчиняется закону силы: с увеличением силы стимула величина его возрастает.
Механизм возникновения ПД. Наиболее часто встречающийся вариант возникновения ПД – это быстрое движение Na+ в клетку, а К+ - из клетки, вследствие фазовых изменений проницаемости клеточной мембраны, под влиянием самого ПД, если раздражитель вызвал его начало. Величина мембранного потенциала при этом вначале быстро уменьшается, а затем снова восстанавливается до исходного уровня.
Выделяют три фазы ПД, название которых отражает процесс изменения величины и знака заряда клетки в процессе ее возбуждения.
1.Фаза деполяризации – уменьшение заряда клетки до нуля (см. рис. 4, А, 1), развивается при действии деполяризующего раздражителя на клетку (электрический ток, медиатор). Начальная частичная деполяризация клеточной мембраны происходит без изменения ее проницаемости для ионов. Поэтому, несмотря на наличие движущей силы (концентрационный и электрический градиенты), движение N+ в клетку через быстрые электроуправляемые N+ – каналы отсутствует. Напомним, что клетка внутри заряжена отрицательно (разноименные заряды притягиваются друг к другу), а концентрация Nа+ вне клетки в 14 раз больше, чем внутри клетки. Условием же, обеспечивающим вход Nа+ в клетку, является увеличение проницаемости клеточной мембраны, которая определяется состояние воротного механизма Nа – каналов (в некоторых клетках, например в кардиомиоцитах, в волокнах гладкой мышцы, важную роль в возникновении ПД играют управляемые каналы для Са2+). Суммарный ток ионов в любой момент определяется числом открытых каналов клеточной мембраны и наличием электрохимическим градиентов ионов.
Часть ионного канала, обращенная во внеклеточное пространство, отличается от части канала, обращенной внутрь клеточной среды (П. Г. Костюк). Воротный механизм Nа – каналов расположен на внешней и внутренней сторонах клеточной мембраны, воротный механизм К – каналов – на внутренней стороне (К+ движется из клетки наружу). В каналах для Nа+ имеются активационные m – ворота, которые расположены с внешней стороны клеточной мембраны (Nа+ движется внутрь клетки во время ее возбуждения), и инактивационные h – ворота, расположенные с внутренней стороны клеточной мембраны. В условиях покоя активационные m – ворота закрыты, инактивационные h – ворота преимущественно (обычно около 80%) открыты; закрыты также калиевые активационные ворота, а инактивационных ворот для К+ нет, что, по-видимому, является причиной более медленного восстановления (снижения проницаемости клеточной мембраны во время ПД).
Ворота Na – каналов начинают открываться при достижении деполяризации клетки 50% критического потенциала (КП), который обычно составляет -40 мВ (возможны и другие величины). КП – величина мембранного потенциала, при которой начинается регенеративная часть ПД в процессе деполяризации клетки. Когда деполяризация клетки достигает КП, проницаемость мембраны для Nа+ резко возрастает – открывается дополнительно большое число потенциал зависимых m - ворот Nа – каналов, и Nа+ лавиной устремляется в клетку.
2. Фаза инверсии (изменение знака заряда клетки на противоположный) включает восходящую и нисходящую части. Вся восходящая часть пика ПД в большинстве случаев обеспечивается в основном входом Na+ в клетку. После исчезновения мембранного потенциала вход Na+ в клетку продолжается (m - ворота Nа - каналов еще открыты), поэтому число положительных ионов в ней превосходит число отрицательных ионов, заряд внутри клетки становится положительным. Период перезарядки мембраны представляет собой вторую фазу ПД — фазу инверсии (см. рис. 4, А, 2). Теперь электрический градиент препятствует входу Na+ внутрь клетки (положительные заряды отталкиваются друг от друга), Nа- проводимость снижается. Тем не менее, в течение некоторого периода времени (доли миллисекунды) продолжает входить в клетку — об этом свидетельствует продолжающееся нарастание величины ПД. Это означает, что концентрационный градиент, обеспечивающий движение Nа+ в клетку, сильнее электрического, препятствующего входу Nа+ в клетку. Примерно через 0,5— 2 мс и более после начала деполяризации (время зависит от вида клетки) рост ПД прекращается вследствие закрытия натриевых инактивационных h-ворот (инактивация Nа-каналов) и прекращения поступления Na+ в клетку.
Нисходящая часть фазы инверсии начинается с открытия ворот К-каналов и быстрого возрастания выхода К+ из клетки. Поскольку К+ находится преимущественно внутри клетки, он, согласно концентрационному градиенту, быстро выходит из клетки после открытия ворот К-каналов, вследствие чего уменьшается число положительно заряженных ионов в клетке. Заряд клетки снова начинает уменьшаться.
В период нисходящей части фазы инверсии выходу К+ из клетки способствует также электрический градиент. К+ выталкивается положительным зарядом из клетки. Так продолжается до полного исчезновения положительного заряда внутри клетки (до конца нисходящей части фазы инверсии — см. рис. 4, А, 2, пунктирная линия). Калий выходит из клетки не только по управляемым каналам, ворота которых открыты, но и по неуправляемым каналом в течение всего времени развития ПД, что и ускоряет ход нисходящей части ПД и несколько замедляет ход восходящей части ПД.
Таким образом, амплитуда ПД складывается из величины ПП и величины фазы инверсии, составляющей у разных клеток 10-50 мВ. Если мембранный потенциал покоящейся клетки мал, амплитуда ее ПД небольшая.
З. Фаза реполяризации — восстановление заряда клетки (см. рис. 4, А, 3), обеспечивается также продолжающимся быстрым выходом К+ из клетки согласно концентрационному градиенту. Проницаемость клеточной мембраны для К+ все еще высока (активационные ворота калиевых каналов открыты). Поскольку клетка теперь уже снова внутри имеет отрицательный заряд, а снаружи — положительный (см. рис. 3.3, А, 3), электрический градиент препятствует выходу К+ из клетки, что снижает его проводимость, хотя он продолжает выходить. Это объясняется тем, что действие концентрационного градиента выражено значительно сильнее электрического градиента. Таким образом, вся нисходящая часть пика ПД обусловлена выходом К+ из клетки, восходящая — входом Nа+ в клетку.
Нередко в конце ПД наблюдается замедление реполяризации, что объясняется уменьшением проницаемости клеточной мембраны для К+ и замедлением выхода его из клетки из-за закрытия значительной части ворот К-каналов. Другая причина замедления тока К+ из клетки связана с формированием противоположно направленного электрического градиента — внутри клетка в эту фазу снова заряжена отрицательно, а снаружи — положительно, что также замедляет выход К+ из клетки.
При блокаде Nа-каналов ПД не возникает. Возможность временного нарушения работы Nа-каналов широко используется в клинической практике. Так, с помощью местных анестетиков расстраивается механизм управления ворот Na-каналов. Это приводит к прекращению проведения возбуждения в соответствующем участке нерва, устранению болевых ощущений, например, при хирургических вмешательствах.
Роль Са2+ в возникновении ПД в мышечных клетках скелетной мускулатуры, в нервных волокнах незначительна. Однако Са2+ играет важную роль в передаче импульсов от одного нейрона к другому, от нервного волокна к мышечному, в возникновении ПД в сердечной и гладкой мышцах, в обеспечении мышечного сокращения.
Снижение содержания Са2+ в крови на 50%, что иногда встречается в клинической практике, может привести к судорожным сокращениям скелетных мышц. Это объясняется значительным повышением возбудимости нервных и мышечных клеток в результате снижения ПП из-за уменьшения степени нейтрализации отрицательных фиксированных зарядов на поверхности клеточной мембраны и отрицательно заряженных карбоксильных групп интерстиция и ионов С1-. Вследствие этого повышается возбудимость нейронов, так как ПП приближается к КП, и начинается активация Na-каналов. В ответ на поступление самой незначительной импульсации нейроны начинают генерировать ПД в большом количестве, что проявляется в судорожных сокращениях скелетной мускулатуры. При этом нейроны ЦНС и нервные волокна могут разряжаться и спонтанно.
Причиной последовательного открытия электроуправляемых ворот ионных каналов является изменение мембранного потенциала. Все фазы ПД являются регенеративными — необходимо только достичь КП, далее ПД развивается за счет потенциальной энергии клетки в виде электрохимического градиента, который поддерживают ионные насосы.
Следует также отметить, что ионные помпы непосредственно за фазы ПД не отвечают, хотя они работают непрерывно— и в покое, и во время развития ПД.
Следовые гиперполяризация и деполяризация. Следовая гиперполяризация клеточной мембраны — это увеличение мембранного потенциала после фазы реполяризации; обычно является результатом еще сохраняющейся повышенной проницаемости клеточной мембраны для К+, характерна для нейронов (рис 5, Б, 1).
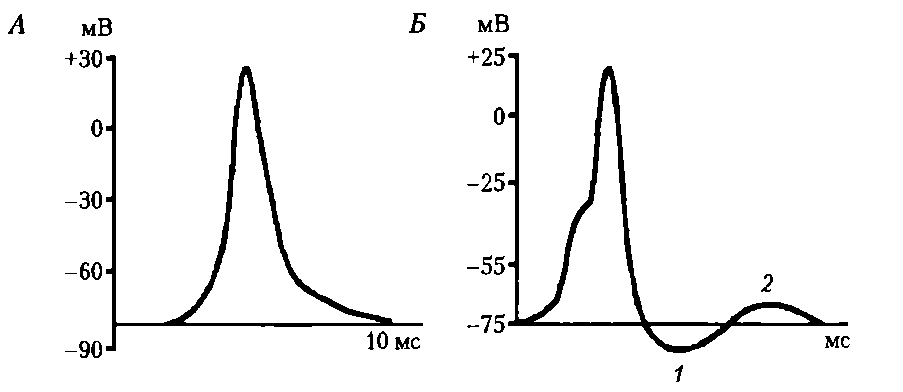
Рис. 5. Два варианта развития потенциала действия двух клеток: А – исчерченного мышечного волокна, замедление фазы реполяризации; Б – нейрона: 1 – следовая гиперполяризация, 2 – следовая деполяризация
Активационные ворота К-каналов еще не полностью закрыты, поэтому К+ продолжает выходить из клетки согласно концентрационному градиенту, что и ведет к гиперполяризации клеточной мембраны. Постепенно проницаемость клеточной мембраны возвращается к исходной (натриевые и калиевые ворота возвращаются в исходное состояние), а мембранный потенциал становится таким же, каким он был до возбуждения клетки. Возможно, Nа/К-помпа способствует развитию следовой гиперполяризации, что, например, хорошо выражено в тонких немиелинизированных нервных волокнах (болевых афферентах).
Cледовая деполяризация развивается после гиперполяризации, также характерна для нейронов (см. рис. 5, Б, 2), может быть зарегистрирована и в клетках скелетной мышцы. Механизм ее изучен недостаточно. Возможно, гиперполяризация связана с кратковременным повышением проницаемости клеточной мембраны для Na+ и входом его в клетку согласно концентрационному и электрическому градиентам, что ведет к кратковременному уменьшению мембранного потенциала.
Запас ионов в клетке (концентрационных градиентов). Клетка может генерировать до 5×105 ПД без подзарядки, т.е. без работы Na/К-насоса. Число импульсов, которое генерирует и проводит нервное волокно, зависит от толщины последнего, что определяет запас ионов: чем толще нервное волокно, тем больше запас ионов, тем больше импульсов оно может генерировать (от нескольких сот до нескольких сотен тысяч) без участия Nа/К-насоса.
Разновидности потенциалов действия – тонический, фазный и смешанный (рис. 6).
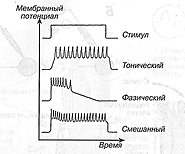
Рис. 6. Тонический и фазический потенциалы (Чеснокова, 2007)
Тоническая активность нейрона вызывают тонические (многократные, длительные) сокращения мышц, фазная – фазное (однократное) сокращение мышцы.
При раздражении возбудимой ткани не всегда возникает ПД. В частности, если сила раздражителя мала, деполяризация не достигнет КП, естественно, не возникнет импульсное — распространяющееся возбуждение, а регистрируется локальный потенциал (ЛП).
Дата добавления: 2016-02-16; просмотров: 1969;
