Механизм и закономерности кристаллизации металлов
Любое вещество может находиться в четырёх агрегатных состояниях: твердом, жидком, газообразном, плазменном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
Свободная энергия – часть внутренней энергии, высвобождающаяся при переходе вещества из одного состояния в другое.
Метастабильное состояние – стабильное состояние при постоянстве внешних факторов
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже теоретической температуры кристаллизации ТS . Температура, при которой практически начинается кристаллизация, называется фактической температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения (  ):
):
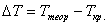
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура.

Кривая охлаждения чистого металла
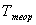 – теоретическая температура кристаллизации;
– теоретическая температура кристаллизации;
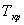 . – фактическая температура кристаллизации.
. – фактическая температура кристаллизации.
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Величина зерен зависит от количества зародышей кристаллизации и скорости их роста. Если скорость охлаждения мала, то возникает небольшое число зародышей и в конце кристаллизации образуются крупные зерна. При большой скорости охлаждения количество зерен возрастает, но они становятся мельче. Это можно наблюдать на практике – в тонких сечениях литых деталей, где структура стали мелкозернистая, так как происходит быстрое охлаждение. Чтобы сделать зерно мелким, в металл вводят специальные вещества – модификаторы. Процесс искусственного регулирования величины зерен получил название модифицирования.
Процесс образования кристаллов носит дендритный (древовидный)
характер, на что впервые обратил внимание Д.К. Чернов
3. Условия получения мелкозернистой структуры
Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов.
Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы,
Строение металлического слитка
Схема стального слитка, данная Черновым Д.К., представлена на рис.
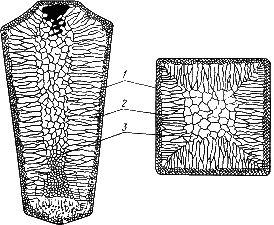
Схема стального слитка
Слиток состоит из трех зон:
1. мелкокристаллическая корковая зона;
2. зона столбчатых кристаллов;
3. внутренняя зона крупных равноосных кристаллов.
Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелкозернистая структура.
Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера.
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты. Растут дендриты с направлением, близким к направлению теплоотвода. Химическая неоднородностьв кристаллах называется дендритной ликвацией.
Химическая неоднородность в разных частях слитка называется зональной ликвацией
4. Механизмы упругой и пластической деформации. Наклёп и рекристаллизация
Деформация – изменение размеров и формы тела под действием приложенных сил.
После снятия нагрузки упругая деформация исчезает, пластическая – остаётся.
В процессе пластической деформации повышается плотность дефектов кристаллического строения, зёрна вытягиваются в направлении действующих сил, внутри зёрен образуются плотные полосы скольжения дислокаций, которые дробят зёрна на отдельные блоки.
Изменение структуры сопровождается повышением пределов прочности и текучести, увеличением твёрдости и снижением пластичности (явление наклёпа).
Наклёп – упрочнение металла в результате холодной пластической деформации.
При нагреве неравновесная структура, образовавшаяся при наклёпе, переходит в стабильную. Процессы, происходящие при нагреве, подразделяются на возврат(первичная рекристаллизация ) и рекристаллизацию( вторичная ).
Рекристаллизация – процесс зарождения и роста новых равноосных зёрен в деформированном металле, при температуре выше температуры рекристаллизации, приводящий к восстановлению свойств, присущих недеформированному металлу.
При возврате различают отдых и полигонизацию.
Температура рекристаллизации
tp = m ( tпл + 273) - 273, °С,
где tp и tпл —температура соответственно рекристаллизации и плавления, °С; т—коэффициент пропорциональности.
При расчете температуры рекристаллизации технически чистых металлов (Fе, W, А1, Zn и др.) в формуле для расчета tр принимают коэффициент пропорциональности m==0,4; для титана 0,37; для меди 0,35 и т. д. Для сплавов твердых растворов этот коэффициент равен 0,5.. .0,6.
Дата добавления: 2016-04-22; просмотров: 2936;
