Реальные газы. Уравнение Ван-дер-Ваальса. Критическая точка.
Модель идеального газа, используемая в МКТ позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлениях. Иначе говоря справедливо соотношение :
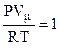 – коэффициент сжимаемости
– коэффициент сжимаемости
Реальные газы менее сжимаемы, следовательно :

Для реальных газов учитывают силы межмолекулярного взаимодействия, которые возникают на расстояниях 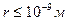
|

 При
При 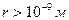 силы взаимодействия быстро уменьшаются и они получили название «короткодействующих сил».
силы взаимодействия быстро уменьшаются и они получили название «короткодействующих сил».
При r = ro равнодействующая F = 0 т.е. Fпр и Fот уравновешивают друг друга.
Элементарная работа при увеличении расстояния на dr dA=Fdr, совершаемая за счет уменьшения взаимной потенциальной энергии между молекулами газа.
|
При r = ro dA=0 П=min
r 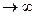 П=0
П=0
r < ro dA>0 dП<0
r > ro dA<0 dП>0
Критерием различия агрегатных состояний вещества является соотношение величины потенциальной энергии взаимодействия молекул и энергии теплового движения молекул.
Если Пmin<<KT ,то состояние газообразное
Пmin>>KT, то состояние твердое
(молекулы совершают колебания около положения равновесия, определяемого r0)
Пmin≈KT , то жидкое состояние
Учет собственного объема молекул и сил межмолекулярного взаимодействия позволило Ван-дер-Ваальсу внести поправки в уравнения Менделеевa-Клапейрона
1.Учет собственного объема .
Фактически свободный объем, в котором могут двигаться молекулы реального газа Vm-b, где b - объем, занимающий самими молекулами b= 4VoN (Vo - объем одной молекулы, N - число молекул )
2.Учет притяжения молекул .
Действие сил притяжения приводит к появлению давления, называемого внутренним давлением
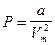 , a - постоянная Ван-дер-Ваальса; Vm - молярный объем.
, a - постоянная Ван-дер-Ваальса; Vm - молярный объем.
Тогда для одного моля газа уравнение Ван-дер-Ваальса имеет вид

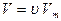
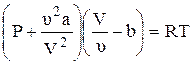
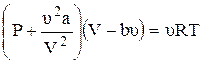
Полученная зависимость p от V при заданном Т называется изотермами Ван-дер-Ваальса и при Т=Ткрит на изотерме имеется только одна точка перегиба.
Изотерма называется критической, а соответствующая температура- критической температурой.
4.2 Изотермы Ван-дер-Ваальса. Метастабильные состояния.
(Pкр,Vкр,Tкр) - соответствующие критической точке и описывают критические состояния.
Для T<Tкр.
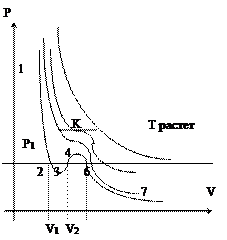 |
На участках 1-3 и 5-7 при уменьшении объема увеличивается давление;
На участке 3-5 при уменьшении объема уменьшается давление, что в природе не существует, следовательно в некоторый момент должно наступить скачкообразное изменение состояния вещества. Истинная изотерма состоит из кривой 7-6-4-2-1, причем участок 7-6 соответствует газообразному состоянию; 2-1 - жидкому; 2-6 - равновесию жидкой и газообразной фаз.
Определение:

|
Вещество в газообразном состоянии при температуре ниже Ткр называется паром, а пар, находящийся в равновесии со своей жидкостью называется насыщенным паром.
Подтверждение выводов Ван-дер-Ваальса было сделано ирландским ученым Эндрюсом, исследовавшим изотермы сжатого углекислого газа.
Отличие опытов Эндрюса и теории Ван-дер-Ваальса заключается в том, что в 1-м случае превращение газа в жидкость соответствует горизонтальным участкам, а во 2-м волнообразным.
Перепишем уравнение Ван-дер-Ваальса в виде полинома 3-й степени:
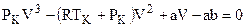
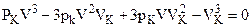
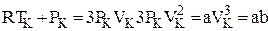 Если решить полученные уравнения в случае СО2, то окажется, что Vкр=3b;
Если решить полученные уравнения в случае СО2, то окажется, что Vкр=3b;
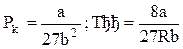 ;
;
Из теории Эндрюса следует, что изотермы Эндрюса содержат прямолинейные участки, соответствующие 2-х фазным состояниям. Состояния соответствующие 5-6 и 2-3 называются метастабильными состояниями, причем участку 2-3 - соответствует перегретая жидкость; 5-6 - пересыщенный пар.
4.3 Эффект Джоуля - Томсона. Инверсионная кривая.
|
В теплоизолированной трубке с пористой перегородкой находится 2 поршня, которые могут перемещаться по трубке без трения .
Первоначально P1V1T1
После прохождения через перегородку P2V2T2
Т.к. расширение происходит без теплообмена с окружающей средой, т.е. адиабатный процесс :
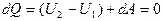 (*)
(*)
Внешняя работа, совершаемая газом состоит из положительной работы
A2=P2V2>0 и отрицательной A1=P1V1<0
Тогда (*), с учетом 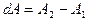 запишется в виде
запишется в виде 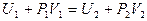 .
.
Определение : Величина U+PV в опыте Джоуля - Томсона сохраняется или остается неизменной и называется энтальпия.
| <== предыдущая лекция | | | следующая лекция ==> |
| | | Производственная структура предприятия и ее элементы. Построение производственного процесса в пространстве |
Дата добавления: 2016-04-19; просмотров: 659;




