Медицинские средства защиты
К числу средств медицинской защиты относятся:
1. Средства предотвращающие поступления веществ в организм через кожу - индивидуальные противохимические пакеты (ИПП - см. раздел “Специальная обработка”);
2. Медикаментозные средства медицинской защиты.
Медикаментозные средства представлены препаратами, назначаемыми с целью профилактики поражения, само- и взаимопомощи, раннего (догоспитального) лечения. Сюда относятся этиотропные, патогенетические и симптоматические средства.
Этиотропные средства защиты (антидоты).
Разработка этиотропных средств защиты - специфических противоядий (антидотов) ФОВ, долго считавшихся основным видом химического оружия, началась сразу после второй мировой войны и продолжается до настоящего времени. Основные направления исследований в области разработки медицинских средств защиты представлены в таблице 48.
Таблица 48.
Основные направления разработки средств медицинской защиты от фосфорорганических отравляющих веществ (по С.Н. Голикову и соавт., 1972)
| Направление | Препараты |
| Защита холинорецепторов | Холинолитические (антихолинэргические) средства |
| Реактивация холинэстеразы | Оксимы |
| Защита холинэстеразы от необратимого угнетения ФОС | Обратимые ингибиторы холинэстеразы |
| Нейтрализация ФОС | Оксимы; специфические антитела |
| Ускорение метаболизма ФОС | Индукторы микросомальных ферментов |
| Возмещение холинэстеразы | Препараты очищенной холинэстеразы |
| Подавление синтеза и высвобождения ацетилхолина | Производные дифенилгликолятов, гемихолиний |
Холинолитики как антидоты ФОС. Как известно, вещества различного строения имеют неодинаковую способность проникать через гематоэнцефалический барьер. Поэтому все холинолитики подразделяются на центральные (проникающие через ГЭБ: амизил, тропацин и др.) и периферические (непроникающие через ГЭБ). Неодинаково и сродство веществ с различным строением к рецепторам разных типов. По этому показателю антихолинэргические препараты разделяют на М-холинолитики (атропин, скополамин, метацин и др.) и Н-холинолитики (пентамин, бензогексоний, мекамиламин и др.).
Холинолитики (антихолинэргические средства) являются физиологическими антагонистами ФОС в действии на холинэргические синапсы. Они связываются с постсинаптическими рецепторами, защищая их от гиперактивации ацетилхолином, накапливающимся в избытке в синаптической щели.
Как указывалось ранее, ингибирование ацетилхолинэстеразы, развивающееся при отравлении ФОС, приводит к накоплению нейромедиатора в холинэргических синапсах всех типов: центральных и периферических, мускарин- и никотинчувствительных. Поэтому при интоксикации ФОС с целью защиты изучалась антидотная активность холинолитиков разных типов (С.В. Аничков, С.Н. Голиков, М.Я. Михельсон, Н.В. Саватеев и др.). В результате многолетних исследований удалось установить ряд закономерностей:
1. Ни один из представителей различных групп холинолитиков не является полным антагонистом ФОС, так как, блокируя лишь определенный тип рецепторов, устраняет эффекты, инициируемые возбуждением только рецепторов этого типа.
2. Чувствительность отравленных к холинолитикам резко снижается и для получения антидотного эффекта препараты следует вводить в дозах, во много раз превосходящих фармакопейные.
3. Продолжительность действия холинолитиков в организме (блокада М-, и Н-холинорецепторов) не велика, а на фоне тяжелой интоксикации ФОС еще более сокращается и, как правило, в среднем составляет не более 1-3 часов. Это указывает на необходимость повторного назначения холинолитиков при отравлениях.
4. Наибольший защитный эффект удается получить при раннем использовании комплекса холинолитиков, связывающихся как с центральными, так и периферическими, М- и Н-холинорецепторами. Однако, в то время как симптоматика, обусловленная возбуждением М-холинорецепторов, сохраняется длительное время (дни), нарушения, связанные с активацией Н-холинорецепторов отмечаются сравнительно непродолжительное время (часы). Поэтому по мере развития токсического процесса эффективность Н-холинолитиков быстро снижаться, а потребность в их назначении исчезает.
5. При раннем назначении отравленным препаратов отдельных групп наибольшая антидотная активность выявляется у центральных холинолитиков (амизил, скополамин, циклодол и т.д.). Однако активность этих средств на периферии выражена менее отчетливо. Поскольку всегда существует необходимость повторного введения препаратов, для устранения, в том числе и периферических эффектов, возникает опасность их побочного действия на центральную нервную систему. Поэтому при создании профилактических противоядий предпочтение отдают центральным холинолитикам, а лечебных - препаратам периферического действия.
Выявленные закономерности позволили разработать тактику использования холинолитиков при поражениях ФОС. В состав профилактических средств и средств само- и взаимопомощи, назначаемых при появлении первых признаках интоксикации, они входят в качестве важнейших компонентов соответствующих рецептур (см. ниже), а для целей лечения пораженных используются в виде самостоятельных препаратов.
В течение длительного времени препаратом выбора для лечения отравленных ФОС является атропин. Этот препарат был предложен уже через несколько недель после окончания 2-й Мировой Войны и захвата арсеналов химического оружия немецкой армии. Будучи М-холинолитиком преимущественно периферического действия, атропин устраняет такие проявления интоксикации как бронхоспазм, бронхорея, брадикардия, тошнота, рвота, боли в животе, понос, гиперсаливация и т.д. Однако атропин не защищает никотиновые рецепторы от токсического действия ФОС, и, следовательно, не устраняет явления, связанные с перевозбуждением нейронов симпатических ганглиев (нарушения гемодинамики и т.д.), нервно-мышечных синапсов (фасцикулляции, паралич мускулатуры). Атропин обладает слабой противосудорожной активностью.
Доза и схема назначения атропина отравленным определяется по клиническим показаниям.
Для устранения проявлений местного действия ФОС на орган зрения (спазм аккомодации) несколько капель 0,1% раствора препарата вносят в конъюнктивальный мешок.
При легкой интоксикации вещество вводят внутримышечно в дозе 2 мг. При необходимости (сохранение или рецидив симптоматики) инъекции повторяют каждые 30 минут до появления признаков легкой переатропинизации (сухость и покраснение кожных покровов, прекращение саливации, расширение зрачка, учащение пульса).
При отравлении средней степени тяжести внутримышечно вводят 4 мг атропина, а затем каждые 10 минут по 2 мг вещества до полного прекращения симптоматики и появления признаков легкой атропинизации (см. выше). Иногда пострадавшие нуждаются в ведении вещества в течение 2 суток.
Тяжело пораженному ФОС желательно внутривенно (или внутримышечно) ввести 4 - 6 мг атропина, а затем через каждые 5 - 10 минут повторять инъекцию в дозе 2 мг. По существующим данным в течение первых суток может потребоваться до 100 мг и более атропина.
Необходимость введения атропина в больших дозах делает чрезвычайно опасным случайное (ошибочное) его назначение не отравленным людям (неправильный диагноз, паника и т.д.). В таких случаях развиваются признаки отравления антидотом: покраснение кожных покровов, сухость во рту, жажда, мидриаз, ухудшение зрения вблизи (паралич аккомодации), тахикардия, головокружение, нарушение ориентации, галлюцинации. Плохая переносимость препарата здоровым человеком делает невозможным его использование как средства индивидуальной защиты, выдаваемого бойцу на руки.
Еще одна опасность связана с введением атропина тяжело пораженным в поздние сроки на фоне выраженной гипоксии. В этом случае возрастающая чувствительность миокарда к симпатомиметическим влияниям может стать причиной смертельной фибрилляции желудочков сердца при блокаде атропином окончаний блуждающего нерва. Для предупреждения этого осложнения введению препарата должны предшествовать мероприятия по устранению гипоксии.
Антидотными свойствами помимо атропина обладают и многие другие холинолитики, особенно, как указывалось, с выраженным действием на центральную нервную систему. Перечень холинолитических средств, рекомендуемых для лечения отравлений ФОС, представлен в таблице 49.
Таблица 49.
Холинолитические средства, рекомендуемы для оказания неотложной медицинской помощи пораженным ФОС (по С.И. Локтионову, 1970)
| Название препарата (форма выпуска) | Действие | Начальная доза |
| Атропин (ампулы) | М-холинолитическое | 2,0 мл 0,1% раствора внутримышечно (внутривенно) |
| Амизил (порошок, таблетки) | М-холинолитическое | 1 - 2 мг внутрь |
| Метацин (таблетки, ампулы) | М-холинолитическое | 2 - 5 мг внутрь 0,5 - 1,0 мл 0,1% раствора под кожу (внутривенно) |
| Скополамин (раствор) | М-холинолитическое | 1,0 мл 0,05% раствора под кожу |
| Апрофен (таблетки, ампулы) | М,Н-холинолитическое | 0,25 мг внутрь 0,5 - 1,0 мл 1% раствора под кожу (внутримышечно) |
| Арпенал (таблетки, ампулы) | ганглиоблокирующее, М-холинолитическое | 50 мг внутрь 1,0 - 2,0 мл 2% раствора под кожу (внутримышечно) |
| Тропацин (таблетки) | ганглиоблокирующее, М-холинолитическое | 10 - 12,5 мг внутрь |
| Бензогексоний (таблетки, ампулы) | ганглиоблокирующее | 100 - 250 мг внутрь 1,0 мл 2,5% раствора под кожу (внутримышечно) |
| Пентамин (ампулы) | ганглиоблокирующее | 1,0 мл 5% раствора внутримышечно |
Помимо классических холинолитиков, выраженным центральным и периферическим антихолинэргическим действием обладают препараты и других фармакологических групп: некоторые нейролептики, антидепрессанты, главным образом, производные тиоксантена (хлорпротиксен и др.) и фенотиазина (аминазин, фторацизин и др.). Фторацизин является компонентом профилактических антидотов ФОВ (П-6, П-10М).
Некоторые миорелаксанты (Н-холинолитики), например мекамиламин, потенцируют профилактическую эффективность рецептур, включающих М-холинолитики и обратимые ингибиторы холинэстеразы.
Реактиваторы холинэстеразы. Восстановление каталитической активности холинэстеразы, угнетенной ФОС, определяется как процесс реактивации. Фармакологические препараты, способные ускорять этот процесс, называются реактиваторами холинэстеразы и являются биохимическими антогонистами ФОС. Первым веществом, для которого была показана реактивирующая способность, был гидроксиламин (Виллсон, 1951), затем последовали производные гидроксамовой кислоты и, наконец, в качестве средств оказания помощи пораженным, были предложены оксимы, менее токсичные и более активные вещества, содержащие в молекуле оксимную группировку (-НС=N-OH). К числу наиболее известных реактиваторов холинэстеразы относятся пралидоксим (2-ПАМ), дипирокисм (ТМБ-4), токсогонин (LuH-6) (рис. 48).
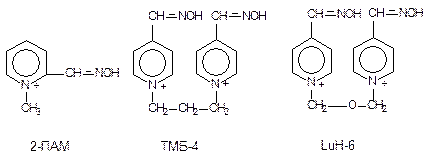
Рисунок 48. Структура некоторых реактиваторов холинэстеразы
Биохимический механизм процесса реактивации холинэстеразы (Е) схематично представлен на рисунке 49.
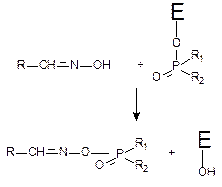
Рисунок 49. Дефосфорилирование хлинэстеразы с помощью оксима
В результате нуклеофильной атаки оксимной группы на фосфорилированный энзим разрывается ковалентная связь между атомом фосфора ФОС с кислородом серина активного центра холинэстеразы и образуется новое соединение – фосфорилированный оксим и свободный энзим.
Реактивация ингибированных холинэстераз как in vitro, так и in vivo характеризуется двумя показателями: скоростью, то есть количеством восстановленного энзима в единицу времени, и уровнем реактивации – максимальным количеством дефосфорилированного фермента, которое можно получить, обрабатывая фосфорилированную холинэстеразу реактиватором. Эти характеристики зависят от структуры ФОС, строения реактиватора и времени, прошедшего с момента взаимодействия ФОС с активным центром холинэстеразы. Например, скорость реактивации холинэстеразы эритроцитов человека, ингибированной зарином, под влиянием 2 ПАМ в 10 раз выше, чем холинэстеразы, угнетенной ДФФ. Феномен может быть следствием влияния стерических (пространственно-структурных) факторов. Так, при реактивации холинэстеразы, ингибированной веществами с сильно разветвленными алкильными радикалами (ДФФ), затрудняется образование связи между атомом фосфора и кислородом оксимной группы, без чего невозможна реактивация.
Из известных реактиваторов наивысшей активностью обладают биспиридиниевые соединения (содержат два пиридиновых кольца в молекуле): ТМБ-4, токсогонин и др. Слабой реактивирующей и антидотной активностью, не смотря на способность проникать через ГЭБ, обладают реактиваторы, не содержащие в молекуле пиридиновых радикалов с четвертичным азотом: диацетиламиноксим (ДАМ-оксим), изонитрозин и др.
Как указывалось ранее, холинэстеразы, ингибированные ФОС, с течением времени приобретают устойчивость к воздействию реактиваторов. Это явление получило название “старения” фосфорилхолинэстераз. Поэтому на реактивационный эффект при действии оксимов можно рассчитывать только при условии их применения в первую (обратимую) фазу торможения, продолжительность которой, в зависимости от строения действующих ФОС, будет значительно различаться (минуты – часы). Наиболее устойчивой к реактиваторам является быстро “стареющая” холинэстераза, ингибиорованная зоманом.
Помимо свойства дефосфорилировать холинэстеразу и восстанавливать ее активность, реактиваторы способны деблокировать (десенсибилизировать) холинорецепторы и восстанавливать их функцию, разрушать ФОС при непосредственном взаимодействии с ядами.
Деблокирующее действие реактиваторов достаточно подробно изучено на мионевральных синапсах. Так, показано, что с помощью 2-ПАМ, ТМБ-4 удается устранять блок проведения на нервно-мышечном препарате диафрагмы крысы, вызванный зоманом или метилфторфосфорилхолином. Этот факт нельзя объяснить реактивацией холиэстеразы, так как яды образуют с ферментом практически нереактивируемый комплекс.
Десенсибилизирующее действие оксимов, проявляется способностью снижать возникающую при действии ФОС повышенную чувствительность Н-холинорецепторов (центральной нервной системы, вегетативных ганглиев) к холиномиметикам, не гидролизуемым холинэстеразой. Полагают, что и деблокирующее и десенсибилизирующее действие оксимов на Н-холинорецепторы осуществляется за счет расщепления комплекса ФОС – холинорецептор.
Некоторые оксимы (2-ПАМ, ТМБ-4) обладают Н-холинолитической активностью (курареподобным действием), что также играет роль в их способности устранять нервно-мышечный блок.
Один из механизмов защитного действия реактиваторов связан с прямой нейтрализацией (разрушением) яда, циркулирующего в крови. Суть явления состоит в том, что оксимы образуют связь с атомом фосфора ингибитора, замещая при этом подвижную группу в молекуле ФОС. При этом образуется комплекс яда с оксимом, который, распадаясь, дает уже неактивное соединение. Однако в некоторых случаях скорость распада продукта взаимодействия ФОС–оксим мала. При этом в организме накапливается вещество, обладающее, порой, мощными ингибиторными свойствами. Поэтому в практике оказания помощи отравленным следует избегать введения неоправданно большого количества оксимов.
В последнее время появились сообщения о способности реактиваторов холинэстеразы восстанавливать активность карбоксилэстеразы крови и тканей, что важно, поскольку при отравлении ФОС этот фермент играют существенную роль в детоксикации ядов.
Под влиянием реактиваторов холинэстеразы ускоряется восстановление сознания у пораженных, ослабляется выраженность бронхоспазма, спазма кишечника, ослабляются или прекращаются фибриллярные мышечные подергивания, предупреждается развитие мышечной слабости, нормализуется функция нервно-мышечных синапсов и восстанавливается деятельность дыхательной мускулатуры, что в свою очередь приводит к ослаблению гипоксии.
Изложенные представления о механизмах антидотного действия оксимов определяют тактику их применения.
Необходимостью раннего введения обусловлено включение реактиватора холинэстеразы в состав антидота само- и взаимопомощи АЛ-85 (см. ниже). В качестве лечебных антидотов реактиваторы применяют при отравлениях средней степени тяжести и тяжелых поражениях ФОС.
В опытах на животных показано, что минимальной действующей концентрацией пралидоксима (2-ПАМ) в крови является 4 мг/мл. Внутривенное введение препарата со скоростью 500 мг/час обеспечивает поддержание концентрации в плазме крови 15 мг/мл. Для достижения действующей концентрации препаратов в крови и тканях человека и поддержания ее на этом уровне в течение необходимого времени (около 1,5 часов) рекомендуют повторно, с интервалом 20 минут вводить внутривенно (или внутримышечно) 500 - 2000 мг пралидоксима (2-ПАМ) или 150 - 250 мг дипироксима (ТМБ-4). При необходимости инъекции можно повторить спустя 4 - 6 часов после первого введения. Возможно внутривенное капельное введение препаратов в указанных дозах со скоростью: 2-ПАМ - 100 мг/мин, ТМБ-4 - 25 мг/мин. Более высокие дозы оксимов или более частое и длительное их применение не только не оправдано, но может привести к осложнениям, обусловленным способностью образовывать с ФОС стойкие токсичные комплексы, миорелаксирующим действием оксимов.
При лечении острых отравлений ФОС реактиваторы холинэстеразы применяются в сочетании с холинолитическими веществами. В эксперименте установлено, что при применении атропина или других холинолитиков (например амизила, пентафена) вместе с оксимами наблюдался эффект потенцирования. Это выражалось в увеличении антидотной мощности противоядий и в ускорении восстановления нарушенных функций.
На снабжении армии США принят реактиватор холинэстеразы пралидоксим (2-ПАМ). При чрезвычайных ситуациях на руки бойцу выдают 3 автоинъектора с пралидоксимом, каждый содержит 600 мг оксима. Препараты рекомендуют вводить при появления первых признаков поражения. Отечественной наукой разработан эффективный, отличающийся высокой реактивационной способностью биспиридиноксим - карбоксим.
Обратимые ингибиторы холинэстеразы. В 1946 году Костер показал, что предварительное введение физостигмина (алкалоид растительного происхождения), существенно повышает резистентность экспериментальных животных к ДФФ, а Келле в том же году связал этот эффект со способностью алкалоида, защищать активный центр АХЭ от действия яда. Этим было положено начало изучения еще одной группы биохимических антагонистов ФОС - обратимых ингибиторов холинэстеразы. Эти вещества, как правило, являются производными карбаминовой кислоты (NH2COOH) и потому нередко называются карбаматами (рис. 50).
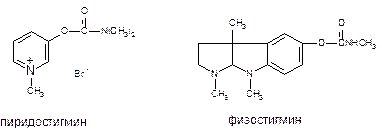
Рисунок 50. Структура некоторых обратимых ингибиторов холинэстеразы
В настоящее время установлено, что профилактическое введение обратимых ингибиторов, как проникающих (физостигмин, галантамин, аминостигмин), так и непроникающих (пиридостигмин) через ГЭБ, обеспечивает защиту экспериментальных животных от высокотоксичных ФОС. Наибольшей активностью обладают проникающие через ГЭБ третичные карбаматы (физостигмин, галантамин, аминостигмин и др.).
Структурно эти вещества напоминают естественный субстрат энзима - ацетилхолин, однако как катионная, так и кислотная часть молекулы ингибитора имеют большую массу, чем соответствующие фрагменты молекулы субстрата. За счет этого осуществляется относительно прочная фиксация веществ на активном центре фермента (карбамилирование активного центра), что и лежит в основе его ингибирования. Поскольку комплекс фермент-ингибитор достаточно быстро спонтанно разрушается (как правило, в течение 6 часов) карбаматы называются конкурентными, обратимыми ингибиторами холинэстеразы. Обратимость в действии карбаматов на фермент отличает их от ФОС.
Профилактический эффект при воздействии ФОВ наблюдается при введении обратимых ингибиторов в дозах, вызывающих угнетении ХЭ на 40% и более. В этих условиях ФОС, попавшее в организм, в значительно меньшей степени угнетает активность холинэстеразы, поскольку активные центры энзима в момент воздействия яда защищены карбаматом и накапливающимся в синаптической щели ацетилхолином. В дальнейшем ФОС быстро разрушается в организме, а карбамат покидает активный центр холинэстеразы, активность которой восстанавливается. При этом подъем уровня ацетилхолина в тканях защищенного не столь выражен и значительно менее продолжителен. Так, на фоне тяжелой интоксикации зоманом повышенное содержание ацетилхолина в мозге крыс отмечается в течение 5 - 6 часов. При профилактическом введении физостигмина нормализация уровня ацетилхолина происходит в течение 30 минут.
Человек безсимптомно переносит карбамилирование 20-30% ацетилхолинэстеразы. Поэтому для предотвращения развития неблагоприятных эффектов, связанных с угнетение холинэстеразы обратимым ингибитором, и защиты холинорецепторов в состав профилактических антидотов дополнительно вводят холинолитики.
В США препаратом выбора является четвертичный карбамат, не проникающий через ГЭБ - пиридостигмин. Препарат выпускается в таблетках по 30 мг вещества в каждой. Продолжительность защитного действия - 6-8 часов.
В состав отечественных профилактических антидотов входит аминостигмин, вещество проникающее через ГЭБ, и, следовательно, защищающее не только периферические, но и центральные холинэргические синапсы.
Индукторы микросомальных ферментов. Поскольку ФОВ метаболизируют в организме при участии микросомальных ферментов с образованием нетоксичных продуктов, в 60-е годы прошлого века была высказана идея о возможности использовать для целей профилактики вещества, активирующие эту группу энзимов - индукторы микросомальных ферментов (Рыболовлев Р.С., Линючев М.Н. и др.). Препаратом выбора долгое время считался бензонал (производное барбитуровой кислоты), не обладающий снотворным действием и потому не снижающий военно-профессиональную работоспособность. Вещество рекомендовали к приему в течение 3-х суток, после чего примерно на неделю резистентность организма к действию ФОВ (по данным на экспериментальных животных) возрастала в 1,5 и более раз. В настоящее время к этой группе средств профилактики отношение достаточно настороженное, поскольку при чрезвычайных ситуациях причиной поражения человека могут стать не только ФОС, но чаще другие вещества, некоторые из которых усиливают свою токсичность в организме в процессе метаболизма.
Другие этиотропные средства. Препараты с иными механизмами антагонизма с ФОС (см. табл. 48) при их изучении показали слабую эффективность или плохую переносимость и потому не нашли применения в военно-медицинской практике. Наиболее продуктивно изучалась возможность создания средств иммунной профилактики поражения ФОВ, на основе получения антител к ним. Теоретически такой подход может быть использован применительно к любому токсиканту, на основе которого может быть синтезирован комплексный антиген (токсикант или его фрагмент, связанный с высокомолекулярной иммуногенной группой). В настоящее время в эксперименте показана возможность создания антидотов на рассматриваемом принципе в отношении некоторых фосфорорганических соединений (зоман, малатион, фосфакол и др.). Однако на практике существуют значительные ограничения возможности использования антител (в том числе моноклональных) в целях лечения и профилактики интоксикаций (см. раздел “Антидоты”).
Симптоматические и патогенетические средства, применяемые с целью медицинской защиты при поражении ФОС. Необходимость применения средств симптоматической и патогенетической терапии для целей медицинской защиты от ФОС определяется, прежде всего, тем обстоятельством, что среди противоядий не существует “абсолютного” антагониста этих ядов в действии на биологические системы. Кроме того средства медицинской защиты и лечебные антидоты оказываются эффективными лишь при своевременном (раннем) введении. Появление симптоматики свидетельствует о развитии патологического процесса, и в этих условиях устранение пускового звена (нормализация состояния холинореактивных структур), совсем не означает устранение проявлений, которые могут быть следствием вторичных патохимических и патофизиологических процессов. Наиболее ранимой в этом плане является функция ЦНС. Спасти жизнь пострадавшему оказывается проще, чем сохранить его профессиональную работоспособность, так как перевозбуждение холинэргических механизмов быстро перерастает в полимедиаторную патологию за счет тесного структурно-функционального взаимодействия различных нейромедиаторных систем мозга. Поэтому при поражении ФОС в высоких дозах клиника интоксикации может развиться, не смотря на своевременное применение этиотропных средств защиты. Во всех этих случаях необходимо использовать значительно больший арсенал средств и методов терапии, с помощью которых только и удается оказать помощь пострадавшему: спасти жизнь, сохранить здоровье. Группы препаратов, используемые для указанных целей, представлены в таблице 50.
Таблица 50.
Дата добавления: 2016-04-14; просмотров: 995;
