Механизм токсического действия. Как указывалось, практически все эффекты, выявляемые на начальных этапах развития интоксикации ФОС, могут быть объяснены явлением гиперактивации
Как указывалось, практически все эффекты, выявляемые на начальных этапах развития интоксикации ФОС, могут быть объяснены явлением гиперактивации холинэргических механизмов передачи нервного импульса в ЦНС и на периферии. В основе феномена, как установлено, лежит способность токсикантов угнетать активность ацетилхолинэстеразы, а также некоторые другие механизмы действия на холинэргические структуры, в частности, непосредственное взаимодействие с холинорецепторами, сопровождающееся прямым холиномиметическим эффектом, и повышением чувствительности холинорецепторов к ацетилхолину и негидролизуемым холиномиметикам (холиносенсибилизирующее действие).
Антихолинэстеразное действие. ФОС являются ингибиторами АХЭ, практически необратимо взаимодействующими с ее активным центром. В результате их действия угнетается процесс разрушения АХ в синапсах. Так, при отравлении ФОС существенно возрастает содержание ацетилхолина в мозге (более чем в три раза; нормальное содержание - 2,4 мкг/г ткани). Медиатор накапливается в синаптической щели и вызывает стойкое перевозбуждение постсинаптических холинэргических рецепторов (непрямое холиномиметическое действие ФОС). Перевозбуждение холинорецепторов избытком ацетилхолина приводит к стойкой деполяризации постсинаптических мембран, иннервируемых клеток. Это, в свою очередь, первоначально сопровождается гиперактивацией центральных и периферических М- и Н-холинореактивных механизмов передачи нервных импульсов, а затем, в случае крайне тяжелого отравления, - блоком проведения нервного импульса, преимущественно в Н-холинэргических синапсах. Таким образом, отравление ФОС, по сути, - отравление эндогенным ацетилхолином, накапливающимся в крови и тканях, вследствие прекращения его разрушения ферментом ацетилхолинэстеразой.
С антихолинэстеразной теорией согласуются факты, свидетельствующие о существовании параллелизма между токсичностью ФОС и их способностью угнетать активность фермента in vitro, степенью угнетения холинэстеразы различных органов и выраженностью развивающихся эффектов. Легкое поражение ФОС, как правило, развивается при угнетении АХЭ более чем на 40%, средней степени тяжести - более 70%, тяжелой - около 90%.
Способность ФОС взаимодействовать с активным центром энзима объясняют структурным сходством молекул ядов с молекулой ацетилхолина. Некоторые ФОС (зарин, диизопропилфторфосфат и др.) имитируют сложноэфирную часть молекулы медиатора, поскольку группировка (Р=О) поляризована так же, как и карбонильная (С=О) группа ацетилхолина. Другие ФОС (например, фосфорилхолины) могут имитировать как эфирную, так и катионную часть ацетилхолина. При этом катионная головка, взаимодействуя с анионным участком активного центра фермента, обеспечивает ориентацию на нем токсиканта, а фосфорсодержащая часть молекулы яда взаимодействует с эстеразным центром. И в первом и во втором случае взаимодействие ФОС с активным центром ацетилхолинэстеразы приводит к образованию прочной ковалентной связи атома фосфора с гидроксильным радикалом серина, входящего в структуру эстеразного участка активного центра холинэстеразы, вызывая его фосфорилирование.
Таким образом, можно представить, что взаимодействие фермента с ФОС проходит по тому же механизму, что и с ацетилхолином. Взаимодействие ацетилхолина, зарина и VX с активным центром холинэстеразы показано на рис. 47.

Рисунок 47. Схема взаимодействия ацетилхолина, зарина и фосфорилтиохолина с активным центром ацетилхолинэстеразы
Чем выше структурное сходство ФОС с ацетилхолином, тем, как правило, выше его антихолинэстеразная активность и токсичность.
Принципиальное различие во взаимодействии ацетилхолина и ФОС с АХЭ состоит в том, что реакция декарбоксилирования активного центра после гидролиза АХ проходит практически мгновенно и энзим снова восстанавливает способность взаимодействовать с субстратом, а дефосфорилирование – протекает медленно. Причем с течением времени изначально обратимая связь ФОС-АХЭ, которая может разрушаться спонтанно (“спонтанная реактивация”) или с помощью некоторых веществ, вводимых отравленному (реактиваторы АХЭ), становится необратимой, неспособной к разрушению. Таким образом, взаимодействие ФОС и АХЭ проходит в две фазы и может быть представлено следующим образом:
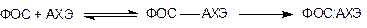
Процесс превращения образовавшейся в первой фазе обратимо фосфорилированной холинэстеразы в необратимо связанную форму называется “старение” фосфорилхолинэстеразы. Как скорость “спонтанной реактивации” АХЭ (и самопроизволное восстановление ее активности), так и “старения”, зависит от структуры ФОС, а именно от строения алкильных радикалов при атоме фосфора. Чем “тяжелее” радикалы, тем ниже скорость “спонтанной реактивации” и выше скорость “старения”. Поэтому АХЭ, ингибированная VX (R -OC2H5), стареет чрезвычайно медленно, зарином (R -OCН(СH3)2) - в течение нескольких часов, зоманом (R -OCНСН3С(СH3)3) - в считанные минуты. В основе “старения” лежит процесс отщепления от атома фосфора, связанного с активным центром энзима, алкильных радикалов. При этом одновременно изменяется конформация белковой части энзима (с этим, вероятно, связано то обстоятельство, что фосфорилированные одним и тем же веществом холинэстеразы, выделенные из тканей разных млекопитающих, “стареют” с разной скоростью).
В настоящее время обнаружены соединения (гидроксиламин, гидроксамовые кислоты, оксимы), способные, взаимодействуя с остатком ФОС, связанного с АХЭ, отрывать его от молекулы энзима (если не произошло его “старение”) и, тем самым, восстанавливать ферментативную активность. Такие вещества, получившие название реактиваторов холинэстеразы, при своевременном введении отравленному существенно ослабляют выраженность токсического процесса, что подтверждает справедливость антихолинэстеразной теории действия ФОС.
Даже ингибированная Vх ацетилхолинэстераза, “стареющая” с минимальной скоростью, а “спонтанно реактивирующаяся” относительно быстро, дефосфорилируется в течение нескольких суток. Вот почему ФОС называют необратимыми ингибиторами холинэстеразы. In vitro способность ФОС угнетать АХЭ уменьшается при увеличении концентрации в инкубационной среде естественного субстрата энзима - ацетилхолина. По этой причине ФОС называют также конкурентными ингибиторами АХЭ. За активный центр энзима ФОС конкурируют не только с ацетилхолином, но и с ингибиторами энзима из других классов соединений, в частности с карбаматами. Последние вызывают обратимое карбамилирование активного центра АХЭ и потому называются обратимыми ингибиторами АХЭ. Установленная в опытах in vitro и in vivo способность обратимых ингибиторов холинэстеразы (прозерина, галантамина и т.д.) защищать холинэстеразу от угнетения ФОС, предупреждать действие этих ядов на органы и системы и, тем самым, препятствовать развитию интоксикации используется на практике при разработке профилактических антидотов ФОС (см. ниже).
Холинэстеразная активность выявляется не только в синаптических структурах, но и в крови млекопитающих и человека. Причем в мембране эритроцитов содержится ацетилхолинэстераза, по сути, идентичная энзиму нервной ткани, а в плазме крови - бутирилхолинэстераза, отличающаяся от АХЭ более высоким сродством к эфирам холина и жирных кислот с большей молекулярной массой, чем ацетат (например, бутирилхолину - эфиру холина и масляной кислоты). ФОС, при поступлении в организм, угнетают оба типа холинэстераз крови. Степень инактивации энзимов пропорциональна степени угнетения активности синаптической ацетиохолинэстеразы. Это явление используется для диагностики интоксикации ФОС, а также для верификации степени тяжести поражения. При отсутствии иных причин, снижение активности холинэстеразы крови более чем на 50% свидетельствует об интоксикации антихолинэстеразными ядами. При необходимости контролировать состояние синаптического энзима, для исследования можно изучать активность АХЭ в эритроцитах, выделенных методом центрифугирования.
Способность ФОС угнетать холинэстеразу используют также для индикации ФОС в воде, продовольствии и т.д. (биохимический метод индикации).
Действие на холинорецепторы. Из возможных неантихолинэстеразных механизмов наиболее важным является действие ФОС на холинорецепторы. Поскольку и холинорецепторы, и холинэстераза адаптированы к одному и тому же нейромедиатору, ингибиторы холинэстеразы могут проявить активность и по отношению к холинорецепторам.
По-видимому, блокада проведения нервно-мышечного сигнала, развивающаяся при смертельной интоксикации ФОС, связана не только со стойким деполяризующим действием избыточного количества ацетилхолина, но и с прямым действием ФОС на нервно-мышечные синапсы (по типу действия деполяризующих миорелаксантов). Так, в эксперименте на изолированном нервно-мышечном препарате млекопитающего, при внесении в инкубационную среду достаточной дозы ФОС, наблюдается полное прекращение передачи нервного импульса с нервного волокна на мышцу. Однако через некоторое время на фоне практически “тотального” угнетения активности холинэстеразы отмечается восстановление нервно-мышечной проводимости в синапсах. Повторно блок можно вызвать, вновь добавив ФОС в инкубационную среду.
Сенсибилизирующее действие на холинорецептор зарина, ДФФ и других ФОС, проявляется, в частности, существенным повышении чувствительности отравленных экспериментальных животных к холиномиметикам, негидролизуемым ацетилхолинэстеразой (никотину, ареколину и т.д.). Установлено, что сенсибилизация к М-холиномиметикам (ареколину) сохраняется значительно дольше, чем к Н-холиномиметикам (никотину). Причины различия, вероятно, обусловлены особенностями проведения нервных импульсов в М- и Н-холинэргических синапсах (см. выше).
Восстановление нормального проведения нервного импульса у лиц, перенесших интоксикацию ФОС, осуществляется за счет медленно протекающих процессов дэфосфорилирования АХЭ (“спонтанная реактивация”), синтеза АХЭ в перикарионе нервных клеток de novo и транспорта ее в нервные окончания, снижения содержания ацетилхолина в синаптической щели, десенситизации холинорецепторов (понижение чувствительности к ацетилхолину).
Нехолинэргические механизмы токсического действия. Помимо действия на холинореактивные структуры, ФОС, в высоких дозах, обладают прямым повреждающим действием на клетки различных органов и тканей (нервной системы, печени, почек, системы крови и т.д.), в основе которого лежат общие механизмы цитотоксичности: нарушение энергетического обмена клетки; нарушение гомеостаза внутриклеточного кальция; активация свободнорадикальных процессов в клетке; повреждение клеточных мембран. Чем менее токсично ФОС, тем значимее роль указанных механизмов в развитии проявлений тяжелого поражения данным токсикантом. Существуют ФОС полностью лишенные антихолинэстеразной активности, токсичность которых обусловлена исключительно их цитотоксическим действием (три-о-крезилфосфат). Клиника отравления такими веществами полностью отличается от описанной выше.
Дата добавления: 2016-04-14; просмотров: 948;
