Атом водорода по Бору
По теории Бора в атоме водорода электрон движется вокруг ядра по одной из «разрешенных» ему круговых орбит, каждая из которых соответствует определенному значению энергии. Чем больше радиус орбиты, тем больше энергия.
Читатель: А почему с удалением электрона от ядра энергия возрастает?
Автор: Мы имеем систему двух одинаковых по величине зарядов: положительного с зарядом +е (ядро) и отрицательного с зарядом –е (электрон). Поскольку масса ядра примерно в 1800 раз превосходит массу электрона, то ядро мы считаем неподвижным. Электрон, вращаясь вокруг ядра по окружности радиуса r, обладает, во-первых, кинетической энергией 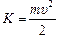 , а во-вторых, потенциальной энергией
, а во-вторых, потенциальной энергией 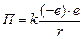 (где
(где 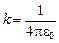 ).
).
Под потенциальной энергией мы понимаем работу, которую совершают силы взаимодействия электрона с ядром при удалении электрона с орбиты радиуса r на бесконечность. Поскольку заряды +е и –е притягиваются, то эта работа отрицательная.
Так как электрон движется по окружности, он имеет центростремительное ускорение 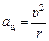 , и второй закон Ньютона для электрона имеет вид
, и второй закон Ньютона для электрона имеет вид
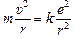 . (1)
. (1)
Полная энергия системы «ядро – электрон» равна
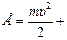
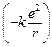 . (2)
. (2)
Выразим скорость из уравнения (1): 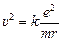 , подставим в (2) и получим:
, подставим в (2) и получим: 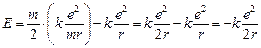 .
.
Итак, запомним: полная энергия атома водорода равна
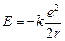 . (24.4)
. (24.4)
Значит, чем меньше r, тем меньше Е.
Значение энергии по теории Бора для п-й орбиты электрона равно
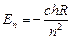 , (24.5)
, (24.5)
где с – скорость света, h – постоянная Планка, R постоянная Ридберга, п – порядковый номер стационарной орбиты.
Минимальное значение энергии (при п = 1) Е1 = –chR, а максимальное (при п ® ¥) Еп = 0. Тогда изменение энергии при переходе с k-й орбиты на п-ю (п < k) равно
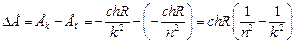 .
.
Запомним:
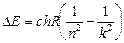 . (24.6)
. (24.6)
С учетом того, что DЕ = hn, получим
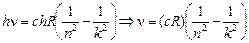
или
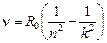 . (24.7)
. (24.7)
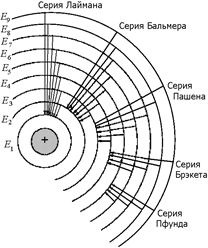 Рис. 24.5
Рис. 24.5
|
Это уже знакомая нам формула. В самом деле, при п = 1 мы получаем серию Лаймана, при п = 2 – серию Бальмера, при п = 3 – серию Пашена, при п = 4 – серию Брэкета, при п = 5 – серию Пфунда.
Иными словами, серия Лаймана образуется переходами со всех вышележащих орбит на первую, серия Бальмера – переходами со всех вышележащих орбит на вторую, серия Пашена – на третью, серия Брэнета – на четвертую, серия Пфунда – на пятую (рис. 24.5).
Задача 24.2. На какие стационарные орбиты переходят электроны в атоме водорода при испускании лучей: видимых, ультрафиолетовых, инфракрасных?
Решение. Воспользуемся уравнением (24.7), разделим обе его части на с, учтем, что 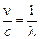 и
и 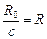 , и получим
, и получим
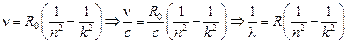 ,
,
где R = 1,097×107 1/м – постоянная Ридберга.
1. Пусть п = 1, тогда 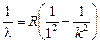 (серия Лаймана). Наименьшая разность энергий (а значит, наибольшая длина волны) наблюдается при переходе со второго уровня на первый. Если k = 2, получим
(серия Лаймана). Наименьшая разность энергий (а значит, наибольшая длина волны) наблюдается при переходе со второго уровня на первый. Если k = 2, получим
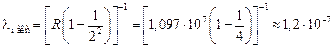 м.
м.
Наибольшая разность энергии (а значит, наименьшая длина волны) наблюдается при переходе с бесконечно высокого уровня на первый. Если k ® ¥, то
lмин = [R(1 – 0)]–1 = (1,097×107)–1 » 0,91×10–7 м.
Значит, все длины волн серии Лаймана лежат в интервале от 0,91×10–7 до 1,2×10–7 м. Это ультрафиолетовый свет.
2. Пусть п = 2, тогда 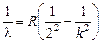 (серия Бальмера). Наименьшая разность энергий (а значит, наибольшая длина волн) получится при переходе на второй уровень с третьего:
(серия Бальмера). Наименьшая разность энергий (а значит, наибольшая длина волн) получится при переходе на второй уровень с третьего:
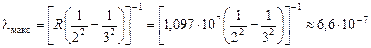 м
м
– это длина волны видимого спектра (красный свет). Но вот если k ® ¥, то получим
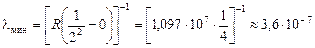 м
м
– это уже ультрафиолет. Таким образом, некоторые переходы на второй уровень энергии дают видимое излучение, а некоторые (при больших k) – ультрафиолетовое.
3. Пусть п = 3, тогда 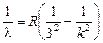 (серия Пашена).
(серия Пашена).
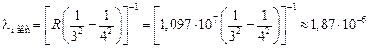 м,
м,
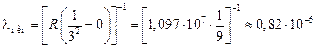 м.
м.
Все эти волны лежат в инфракрасной части спектра.
Ясно, что при п > 3 (серии Брэкета и Пфунда) длины волн будут больше.
Итак, мы можем сформулировать ответ: при переходе на 1-ю стандартную орбиту излучаются ультрафиолетовые лучи, при переходе на 2-ю стационарную орбиту – видимые и ультрафиолетовые лучи, при переходе на 3-ю стационарную орбиту и выше – инфракрасные.
СТОП! Решите самостоятельно: В2–В5, С1–С3.
Задача 24.3. Определить энергию, испускаемую при переходе электрона в атоме водорода с третьей орбиты на первую.
| п = 1 k = 3 | Решение. Воспользуемся формулой (24.6), тогда искомая энергия будет равна
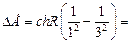
|
| DЕ = ? | |
= 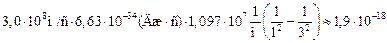 Дж.
Дж.
Ответ: 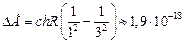 Дж.
Дж.
СТОП! Решите самостоятельно: В6–В8.
Следует отметить, что успехи теории Бора в основном ограничились объяснением спектра водорода. Для всех остальных атомов теория Бора должных объяснений дать не смогла. Но Бор сделал первый шаг от классической физики к современной физике микромира – квантовой механике. Но с этим интереснейшим разделом физики вы познакомитесь уже в вузе.
Дата добавления: 2016-04-11; просмотров: 4055;
