Массовое число нуклида равно числу содержащихся в нем нуклонов (сумме протонов и нейтронов).
Для обозначения конкретного нуклида применяется специальная символика. Слева от символа химического элемента верхним индексом указывается массовое число, а нижним индексом – заряд ядра (порядковый номер элемента). Например, изотоп хлора-18 записывается как 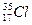 .
.
Таким образом:
Массовое число = Число нуклонов в ядре.
Порядковый номер = Число протонов в ядре или число электронов в оболочке атома.
Разность между массовым числом и порядковым номером = Число нейтронов в ядре.
2.1.4. Строение электронной оболочки атома. Энергетические уровни
Строение электронной оболочки атома определяется различным запасом энергии E отдельных электронов в атоме. В соответствии с моделью атома Бора электроны могут занимать в атоме положения, которым отвечают точно определенные (квантованные) энергетические состояния.
Число электронов, которые могут находиться на отдельном энергетическом уровне, определяется формулой 2n² , где n – номер уровня, который обозначается арабскими цифрами 1-7; для обозначения энергетических уровней используются также буквы от K до Q. Максимальное заполнение первых четырех энергетических уровней в соответствии с формулой 2n² составляет: для первого уровня К – 2 электрона, для второго L – 8, для третьего M – 18 и для четвертого уровня N – 32 электрона.
2.2. КВАНТОВО - МЕХАНИЧЕСКОЕ ОБЪЯСНЕНИЕ СТРОЕНИЯ АТОМА
2.2.1. Орбитальная модель атома
Современные квантово-механические представления о строении электронной оболочки атома исходят из того, что движение электрона в атоме нельзя описать определенной траекторией. Можно рассматривать лишь некоторый объем пространства, в котором находится электрон. Поскольку электрон обладает одновременно свойствами частицы и волны, то подходом к объяснению строения электронной оболочки может быть как корпускулярная теория, так и волновая теория; обе они приводят к одинаковому наглядному представлению, сформулированному как орбитальная модель атома.
1. Обоснование орбитальной модели атома, исходящее из корпускулярного характера электрона, состоит в следующем. Как следует из рис. 2, вероятность пребывания электрона в атомном ядре равна нулю, она незначительна вблизи ядра, но быстро возрастает при удалении от ядра. На некотором расстоянии вероятность достигает максимума, а затем медленно уменьшается, ассимптотически приближаясь к нулю на расстоянии, стремящемся к бесконечности. Таким образом, невозможно ограничить то пространство, в котором может находиться электрон, т.е. нельзя (без дополнительных условий) указать размеры атома. Исходя из корпускулярного характера электрона можно говорить о 90 %-ой вероятности его пребывания в ограниченном объеме пространства, которое называется атомная орбиталь.
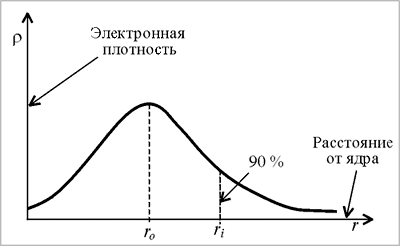
|
| Рис. 2. Зависимость электронной плотности (или вероятности пребывания электрона на расстоянии r ядро-электрон) в атоме от расстояния от ядра |
2. Обоснование орбитальной модели атома, исходящее из волнового характера электрона, состоит в следующем. Электрон заполняет пространство вокруг атомного ядра в форме стоячей волны, которую наглядно можно представить как электронное облако. Плотность электронного облака, понимаемого как облако электрического заряда электрона − электронная плотность – окажется различной и зависящей от расстояния ядро-электрон (рис.1). При ограничении электронной плотности до значения ~ 90 % получается та же орбитальная модель атома.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90 %-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90 %-ой плотности заряда электрона (как волны).
Модель атомной орбитали (электронного облака) очень удобна для наглядного описания распределения электронной плотности в пространстве. При этом s-орбиталь имеет сферическую форму, р-орбиталь – форму гантели, d-орбиталь – четырехлепесткового цветка или удвоенной гантели, f-орбиталь – еще более сложную форму (рис. 3).
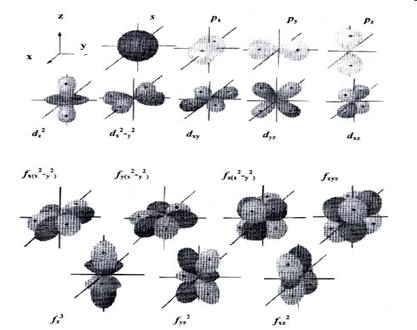
|
| Рис. 3. Формы s-, p- , d- и f -орбиталей |
Если в атомной орбитали находится только один электрон (как в атоме водорода), то говорят об однократно занятой или полузаполненной, полузаселенной атомной орбитали. Если же в атомной орбитали находятся два электрона (как в атоме гелия), то говорят о двукратно занятой или полностью заполненной, полностью заселенной атомной орбитали. Полузаселенные АО играют важнейшую роль при формировании химических связей.
В соответствии с квантово-механическим описанием состояния электрона в атоме каждый электрон является индивидуальной частицей. Такие его свойства, как масса и заряд не выявляют различий между электронами, особенно между теми электронами, которые находятся на одной атомной орбитали (как в атоме гелия). Собственной характеристикой каждого электрона в атоме является спин.
Два электрона, находящиеся в одной атомной орбитали, различаются по спину.
Спин – квантово-механическое свойство электрона, которое невозможно точно объяснить с помощью традиционных представлений на основе механического поведения макрочастиц. Без учета волновых свойств электрона спин можно интерпретировать путем сравнения электрона с шаром, вращающимся вокруг выбранной оси. Спин характеризует направление вращения и, следовательно, при двух возможных направлениях механического вращения должно существовать два разных спина электрона.
Спин – неотъемлемая характеристика электрона в атоме; два электрона на одной атомной орбитали обладают антипараллельными спинами.
Атомную орбиталь удобно изображать в виде квадрата, называемого квантовой ячейкой, а каждый электрон − вертикальной стрелкой, обозначающей один из двух возможных спинов электрона. Квантовая ячейка с одной стрелкой означает атомную орбиталь с одним электроном, т.е. полузаселенную орбиталь, с двумя стрелками − атомную орбиталь с двумя электронами, т.е. полностью заселенную орбиталь, без стрелок – вакантную орбиталь, т. е. без электронов.
2.2.2. Орбитали с s, p , d - и f -электронами
(атомные s, p , d - и f -орбитали)
Атомную орбиталь, имеющую шаровую симметрию (рис. 3), принято обозначать как s-орбиталь (s-АО), а находящиеся в ней электроны – как s-электроны.
Радиус атомной s-орбитали возрастает при увеличении номера энергетического уровня; 1s-АО расположена внутри 2s-АО, последняя – внутри 3s-АО и т.д. с центром, отвечающим атомному ядру. В целом строение электронной оболочки атома в орбитальной модели представляется слоистым. Каждый энергетический уровень, содержащий электроны, геометрически рассматривается как электронный слой.
Для сокращенного обозначения электрона, занимающего атомную s-орбиталь, используется обозначение самой s-АО с верхним цифровым индексом, указывающим число электронов. Например, 1s 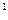 − обозначение единственного электрона атома водорода.
− обозначение единственного электрона атома водорода.
Номер энергетического уровня отвечает главному квантовому числу, а вид орбитали − орбитальному квантовому числу.
2s 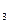 Li=1s
Li=1s 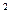 2s
2s 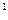 ,
, 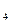 Be=1s
Be=1s 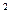 2s
2s 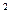
1s 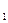 H=1s
H=1s 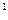 , He
, He
Электронная формула в сочетании с энергетической диаграммой электронной оболочки атома (рис. 3) отражают его электронную конфигурацию.
Атомную орбиталь, имеющую вращательную (осевую) симметрию принято обозначать как p-орбиталь (p-АО) ; находящиеся в ней электроны – это p-электроны.
Каждая атомная p-орбиталь может принять (при максимальном заполнении) два электрона, подобно любой другой АО. Эти электроны сообща занимают обе половины p-орбитали. На каждом атомном энергетическом уровне (кроме первого) имеется три атомных орбитали, которым отвечает максимальное заселение шестью электронами.
Все три p-АО одного энергетического уровня отличаются друг от друга пространственным расположением; их собственные оси, проходящие через обе половины орбитали и перпендикулярные ее узловой плоскости, образуют систему декартовых координат (обозначения собственных осей x, y, z). Поэтому на каждом энергетическом уровне имеется набор трех атомных p-орбиталей: px-, py- и pz-АО. Буквы x, y, z соответствуют магнитному квантовому числу, позволяющему судить о влиянии внешнего магнитного поля на электронную оболочку атома.
Атомные s-орбитали имеются на всех энергетических уровнях, атомные p-орбитали − на всех уровнях, кроме первого. На третьем и последующих энергетических уровнях к одной s-АО и трем p-АО присоединяется пять атомных орбиталей, получивших название d-орбиталей(рис. 4), а на четвертом и последующих уровнях − еще семь атомных орбиталей, называемых f-орбиталями.
Квантово-механические расчеты показывают, что в многоэлектронных атомах энергия электронов одного уровня не одинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию.
Энергетический уровень характеризуется главным квантовым числом n. Для всех известных элементов значения n изменяются от 1 до 7. Электроны в многоэлектронном атоме, находящемся в основном (невозбужденном) состоянии, занимают энергетические уровни от первого до седьмого.
Энергетический подуровень характеризуется орбитальным квантовым числом l. Для каждого уровня (n = const) квантовое число l принимает все целочисленные значения от 0 до (n-1), например, при n=3 значениями l будут 0, 1 и 2. Орбитальное квантовое число определяет геометрическую форму (симметрию) орбиталей s-, p-, d-, f-подуровня. Очевидно, что во всех случаях n>l; при n=3 максимальное значение l равно 2.
Существующие подуровни для первых четырех энергетических уровней, числа атомных орбиталей и электронов в них приведены в таблице 1.
Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г. швейцарским физиком Паули.
Дата добавления: 2016-04-11; просмотров: 2087;
