Основы процесса горения органических топлив. Горение жидкого топлива, горение газообразного топлива. – 2 часа
Элементы теории горения топлива.
Горение представляет собой процесс быстрого и полного окисления горючего вещества, происходящий при высокой температуре и сопровождающийся выделением тепла. В горении участвуют два компонента, а именно: окисляемое (горящее) вещество, называемое топливом, и окислитель — вещество, содержащее кислород, способный достаточно быстро вступать в реакцию с топливом. В топках котельных агрегатов в настоящее время используют только самый дешевый и распространенный в природе окислитель, а именно атмосферный воздух, 21% объема которого составляет кислород.
Характер горения топлива в каждом отдельном случае определяется рядом различных факторов, среди которых основными являются: вид сжигаемого топлива, способ сжигания, аэродинамические особенности процесса, характер подвода кислорода к топливу.
Влияние вида топлива на процесс его горения определяется агрегатным состоянием топлива, а также его влажностью, зольностью, спекаемостью, выходом летучих. Различают гомогенное и гетерогенное горение. Гомогенным называют горение, протекающее в одной — газовой — фазе, т. е. горение газообразного топлива. Гетерогенным в строгом смысле этого слова называют горение, происходящее на поверхностях раздела двух фаз. Практически — это горение углерода в воздухе. В более широком смысле под гетерогеннымгорением понимают горение любого твердого или жидкого топлива.
Способ сжигания сказывается на характере горения в основном при сжигании твердого топлива, когда различают горение кускового топлива в слое и горение размолотого, пылевидного топлива в факеле. Жидкое и газообразное топливо сжигают только в факеле, причем жидкое топливо предварительно распыляют на мелкие капли.
Аэродинамические особенности влияют на горение главным образом при сжигании топлива в факеле. В этом случае сказываются характер движения в факеле — ламинарный или турбулентный, а также прямоточность или за-крученность потока.
В отношении характера подвода кислорода к топливу, также особенно сильно сказывающегося при сжигании топлива в факеле, имеет значение, является ли процесс кинетическим, когда горит уже предварительно перемешанная смесь топлива и воздуха, диффузионным, когда весь воздух для горения подается в факел отдельно от топлива и смешивается с ним в процессе горения, или промежуточным, когда одна часть воздуха предварительно перемешана с топливом, а другая смешивается с ним во время горения.
На особенности процесса горения, кроме перечисленного, влияет и ряд других факторов: вид топки, концентрация кислорода в воздухе, подаваемом для горения, давление при котором происходит горение, и др.
Распространение пламени
Опыт показывает, что если какой-нибудь элемент объема горючей смеси доведен источником тепла до температуры, при которой теплота, развиваемая реакцией соединения горючего с кислородом, начинает превышать количество тепла, теряемого рассматриваемым элементом объема, то наступает скачкообразное ускорение реакции, сопровождаемое появлением пламени. Этот процесс может происходить как в гомогенной смеси горючего газа с воздухом, так и в воздушной взвеси распыленного жидкого или твердого топлива, например в облаке угольной пыли. Указанная температура, называемая температурой воспламенения, для большинства горючих смесей находится в пределах 500—750° С и зависит от рода горючего, его концентраций в воздухе, концентрации кислорода в воздухе и некоторых других факторов..
При горении в неподвижной или почти неподвижной среде возникшее пламя начинает распространяться в горючей смеси в виде тонкого светящегося слоя — фронта пламени, отделяющего еще не начавшую гореть топливную смесь от продуктов реакции, так как сама реакция горения протекает именно в этом слое. Горение прекращается, когда фронт пламени достигает стен, ограничивающих объем, занимаемый горючей смесью.
При горении в струе, вытекающей из трубки или горелки, т. е. в факеле, фронт пламени, наоборот, стабилизуется в пространстве, образуя поверхность в виде конуса с основанием, расположенным почти на обрезе трубки, из которой вытекает горючая смесь (рис. 3). Этот конус, называемый конусом Михельсона, при ламинарном гомогенном горении представляет собой очень тонкий, ясно очерченный и ярко светящийся слой пламени, который при стационарном режиме горения остается совершенно неподвижным. При ламинарном гетерогенном горении конус Михельсона, оставаясь неподвижным, получается размытым и менее ярким. При переходе же к турбулентному горению как гомогенному, так и гетерогенному конус Михельсона размывается еще больше и, кроме того, теряет свою неподвижность и превращается в пульсирующую вокруг некоторого срединного положения область воспламенения, которая тем не менее сохраняет конусообразную форму.
В неподвижной смеси при горении возможны два вида распространения пламени: медленное и быстрое — взрывное (детонация). При медленном распространении пламени фронт его движется в большинстве случаев со скоростью 0,3—1,2 и только в отдельных случаях 3—5 м/сек. Взрывное горение характеризуется скоростью распространения фронта пламени, доходящей до нескольких тысяч метров в секунду. В струе, вытекающей из трубки или горелки в свободное пространство, т. е. в факеле, может происходить только медленное горение.
Медленному распространению пламени в неподвижной смеси, а также распространению пламени в ламинарных струях присуща своя, для каждой данной смеси постоянная скорость, называемая нормальной скоростью распространения пламени, которая определяется как отнесенная к холодной, еще не воспламененной топливо-воздушной смеси скорость перемещения пламени по нормали к его поверхности. Для гомогенной смеси углеводородов с воздухом она составляет 0,3—1,2 м/сек, для смеси ацетилена с воздухом она доходит до 3 м/сек, а для смеси водорода с воздухом — до 5 м/сек.
.
 Рис. 3. Конус Михельсона. vн—вектор скорости распространения пламени.
Рис. 3. Конус Михельсона. vн—вектор скорости распространения пламени.
Для гетерогенных взвесей скорость распространения пламени обычно составляет 0,3—0,7 м/сек.
Нормальная скорость распространения пламени остается одинаковой как в неподвижной топливо-воздушной среде, так и в ламинарном потоке независимо от скорости движения его. Наряду с этим величина нормальной скорости распространения пламени зависит от концентраций топлива в горючей смеси и кислорода в воздухе, начальной температуры и давления смеси.
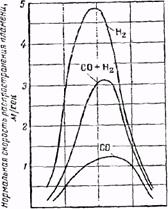
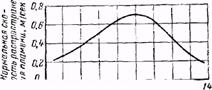
Рис. 4. Изменение нормальной скорости распространения пламени в зависимости от концентрации горючего газа в топливовоздушной смеси.
а - водород, окись углерода, генераторный газ; б —метан.
0 20 40 60 80 5 6 7 8 9 10 11 12 14
Содержание горючего газа в смеси Содержание метана в смеси
а) б)
Зависимость нормальной скорости распространения пламени от концентрации топлива в воздухе носит одинаковый принципиальный характер, как для различных газов, так и для различных взвесей распыленного твердого и жидкого топлива: она имеет максимум, по обе стороны от которого скорость уменьшается (рис. 4).
Для каждого топлива существуют максимальная и минимальная концентрации горючего в воздухе, при которых скорость распространения пламени скачком падает от конечной величины до нуля; за пределами этих концентраций горения и распространения пламени не происходит.
С ростом концентрации кислорода в воздухе, входящем в топливо-воздушную смесь, и повышением температуры ее нормальная скорость распространения пламени заметно увеличивается, а пределы воспламеняемости расширяются.
При переходе движения топливо-воздушной смеси, вытекающей из горелки, от ламинарного к турбулентному, возникают качественные изменения процесса горения. Кроме того, что фронт пламени становится размытым и пульсирующим, скорость распространения пламени возрастает в несколько раз и начинает зависеть от скорости истечения струи и степени турбулизации потока. В момент перехода движения горючей смеси от ламинарного к турбулентному происходит значительное увеличение скорости распространения пламени, которое после достижения установившегося турбулентного движения начинает расти медленнее.
Для условий горения газообразных смесей в промышленных топках зависимость скорости турбулентного распространения пламени vТ от осредненной скорости потока U можно выразить в виде:
vТ = 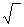 vн2+ сε2 U2 (16)
vн2+ сε2 U2 (16)
где vн — нормальная скорость распространения пламени (при горении в ламинарном потоке);
с — постоянная величина;
ε— степень турбулентности потока.
Зависимость скорости распространения пламени от концентрации топлива в топливо-воздушной смеси, начальной температуры и концентрации кислорода в воздухе при турбулентном горении носит тот же принципиальный характер, что и при ламинарном горении.
Горение в факеле может происходить только в определенном диапазоне скоростей истечения. С уменьшением скорости истечения высота конуса Михельсона и при ламинарном и при турбулентном горении уменьшается.
При скорости истечения, уменьшающейся до нормальной скорости распространения пламени, фронт пламени становится плоским, перекрывая выходное отверстие горелки. При дальнейшем уменьшении скорости истечения пламя проскакивает в горелку, доходя до того места, где происходит смешение топлива и воздуха. При значительном увеличении скорости истечения наступает такой момент, когда фронт воспламенения скачком отрывается от горелки и воспламенение горючей смеси переносится в пространство. Эта форма горения, однако, неустойчива, будучи очень чувствительной, к изменению скорости истечения.
Механизм горения частицы твердого и капли жидкого топлива
Горение твердого и жидкого топлива является процессом многостадийным.
Процесс горения твердого топлива может быть разбит на три стадии. На первой стадии топливо под влиянием внешнего источника тепла проходит процесс нагрева и коксования, в результате чего оно разделяется на летучую часть и коксовый остаток. На второй стадии происходит воспламенение выделившихся летучих и сгорание их. На третьей стадии происходит процесс горения коксовой основы топлива.
Несколько по-особому происходит только горение антрацита. В этом случае процессу воспламенения предшествует процесс низкотемпературного окисления углерода топлива с образованием окиси углерода, которая и воспламеняется.
Жидкое топливо в большинстве случаев сгорает в две стадии. На первой стадии топливо нагревается до температуры кипения и испаряется. На второй стадии происходит гомогенное сгорание образовавшихся топливных паров.
Воспламенение и горение каждой отдельной частицы топлива в гетерогенном факеле происходят индивидуально, хотя и не без связи с воспламенением и горением других частиц.
Горение частицы твердого топлива, лишенного летучих, протекает на ее поверхности. Кислород, необходимый для горения, проникает к поверхности частицы путем молекулярной диффузии через граничный застойный газовый слой, который окружает горящую частицу. Удаление продуктов сгорания с поверхности частицы в окружающую среду также осуществляется диффузией через тот же граничный слой (рис. 5, а).
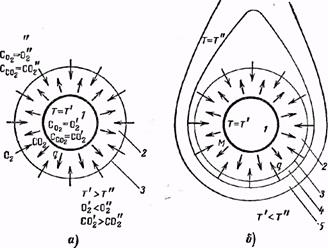
Рис. 5. Схемы горения отдельных частиц твердого топлива и
отдельных капель жидкого топлива.
а — горение отдельной частицы твердого топлива, лишенного летучих; б—горение отдельной капли жидкого топлива; 1—поверхность горящей частицы или испаряющейся капли; 2 —газовый граничный слой вокруг частицы; 3 — наружная поверхность граничного слоя; 4—область образования горючей смеси при горении капли жидкого топлива; 5—область горения горючей смеси при горении капли жидкого топлива; О2 —поток диффузии кислорода; СО2 — поток диффузии углекислоты; М—поток диффузии испаренного горючего; q — поток тепла; Т—температура; сO2—концентрация кислорода; сCO2 —концентрация углекислоты. Индексы: ' — на поверхности частицы или капли; " — в окружающей среде.
Механизм воспламенения и горения капли жидкого топлива существенно отличается от механизма горения частицы твердого топлива, лишенного летучих. Воспламенение и горение капли происходят не на поверхности ее, а в пространстве вокруг ее газового граничного слоя, который окружает жидкие капли, так же как и твердые частицы. При этом вокруг каждой капли возникает свое пламя, похожее на пламя свечи (рис. 5, б).
Температура на поверхности капли жидкого топлива во всех областях факела остается равной температуре кипения той фракции топлива, из которой она состоит. В результате, в какой бы части факела ни находилась капля жидкого топлива, в ее граничном слое имеются градиент температуры и поток тепла, передаваемого теплопроводностью к поверхности частицы, благодаря которому и происходит испарение капли. Навстречу возникает поток паров топлива, передаваемых через граничный слой молекулярной диффузией в окружающую среду. Как только эти пары, пройдя граничный слой, смешиваются в необходимой концентрации с кислородом, который содержится в среде, окружающей каплю, они воспламеняются и сгорают поблизости от нее. Выделившееся при воспламенении тепло резко поднимает температуру окружающей среды и интенсифицирует процессы испарения и горения, которые заканчиваются только после того, как частица испарилась полностью. При этом в случае сжигания тяжелого топлива после испарения капли остается маленькая по сравнению с ее размерами частичка твердого кокса, которая медленно догорает в чисто гетерогенном процессе.
Механизм горения частицы твердого топлива, обладающего летучими, занимает промежуточное положение. Воспламенение и первая стадия горения, приходящиеся на период интенсивного выделения летучих из топлива, происходят вокруг граничного слоя, окружающего частицу, так же как и при горении капли жидкого топлива. На второй же стадии горения, которая начинается после того, как основная масса летучих из частицы выделилась, процесс переходит на поверхность частицы, как при горении частицы твердого топлива, лишенного летучих.
Реакции горения
В топке котельного агрегата происходят гетерогенные реакции горения углерода и серы и гомогенные реакции горения водорода, окиси углерода и различных углеводородов.
Горение углерода представляет собой сложную химическую реакцию, особенности которой еще полностью не изучены. Считают, что в процессе горения углерода одновременно образуются как углекислота, так и окись углерода. Реакцию горения углерода выражают формулой:
хС + уО2 = mСО2 + nСО, (17)
где х и у — число молекул С и О2 вступающих в реакцию, а m и n — число образующихся молекул окислов. В тех случаях, когда имеется достаточное количество кислорода, эта реакция сопровождается вторичной реакцией сгорания окиси углерода в углекислоту, которая протекает во много раз быстрее, чем первая. Поэтому для практических целей можно принять, что при достаточном количестве кислорода горение углерода происходит в точном соответствии со стехиометрическим уравнением реакции сгорания углерода.
| С | + 02 | = С02 |
| 1 моль | + 1 моль | = 1 моль |
| 0 объемных частей | + 1 объемная часть | = 1 объемная часть |
| 12 массовых частей | +32 массовые части | =44 массовые части |
Горение серы при теплотехнических расчетах выражается стехиометрическим уравнением реакции сгорания серы в сернистый ангидрид, т. е. уравнением
| S | + 02 | = SО2 |
| 1 моль | + 1 моль | = 1 моль |
| 0 объемных частей | + 1 объемная часть | = 1 объемная часть |
| 32 массовые части | +32 массовые части | =64 массовые части |
Реакции горения водорода, окиси углерода и углеводородов также достаточно сложны, так как они являются цепными. Такие реакции протекают с образованием непрерывно возрастающего количества нестойких и очень хими- чески активных промежуточных веществ, которые реагируют между собой до образования конечного продукта со скоростью, гораздо большей, чем скорость обычных молекулярных реакций. В результате реакция, раз начавшись, развивается, саморазгоняясь, и завершается очень быстро — практически мгновенно.
Исследование горения водорода показывает, что оно характеризуется довольно сложной совокупностью многих реакций.
Саморазгоняющийся характер цепных реакций горения водорода, окиси углерода и углеводородов, приводящий к почти мгновенному завершению их, позволяет для практических расчетов пользоваться стехиометрическими уравнениями этих реакций.
Горение водорода — уравнением:
| 2Н2 | + О2 | = 2Н2О |
| 2 моля | + 1 моль | = 2 моля |
| 2 объемные части | + 1 объемная часть | = 2 объемные части |
| 4 массовые части | +32 массовые части | =36 массовых частей |
Горение окиси углерода – уравнением:
| 2СО | + О2 | = 2СО2 |
| 2 моля | + 1 моль | = 2 моля |
| 2 объемные части | + 1 объемная часть | = 2 объемные части |
| 56 массовых частей | +32 массовые части | =88 массовых частей |
Горение углеводородов — уравнением:
| СmHn | + (m+n/4) О2 | = mСО2 +n/2 Н2О |
| 1 моль | + (m+n/4) молей | = m молей + n/2 молей |
| 1 объемная часть | + (m+n/4) объемных частей | = m объемных частей + n/2 объемных частей |
| 12 m+n массовых частей | +32 (m+n/4) массовых частей | =44m массовых частей + 9n массовых частей |
Скорость реакции горения зависит от температуры, при которой она происходит, концентрации кислорода в воздухе, используемом для горения, а при гомогенной реакции также и от концентрации горючего газа в горючей смеси.
Вопрос о скорости химических реакций изучается химической кинетикой. Однако в классическом виде ее теоретические положения применимы только к гомогенным реакциям. Согласно химической кинетике можно принять, что скорость гомогенной реакции, понимаемая как скорость изменения концентрации реагирующих веществ, определяется законом действующих масс. При этом в случае горения промышленных газов, когда в реакции участвуют только два вещества, а сама реакция протекает до конца в одном направлении, скорость реакции гомогенного горения, может быть выражена законом:
w = - dA/dt = KAAaBb, 1/сек (17)
Константа скорости химической реакции KA не имеет постоянной размерности; последняя определяется величинами а и b,входящими в стехиометрическое уравнение реакции горения: aA +bB 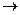 mM+nN
mM+nN
Константа скорости химической реакции сильно зависит от температуры, при которой она протекает и выражается законом Аррениуса:
К = К0• е –Е/RT(18)
где К0 — постоянная величина, имеющая ту же размерность, что и K;
е — основание натуральных логарифмов;
Е— энергия активации реакции, ккал/ моль; Rо— универсальная газовая постоянная, ккал/моль • град;
Т— абсолютная температура реакции, °К.
Энергия активации Епредставляет собой характеристику, определяющую активность реагирования данных веществ, при вступлении их в химическую реакцию. Энергия активации в известной мере определяет энергию, которую необходимо затратить для того, чтобы разрушить связи между атомами в молекулах исходных веществ реакции, с тем, чтобы освободившиеся атомы могли соединиться в молекулы конечных продуктов реакции. Очевидно, что чем ниже значение энергии активации данной реакции, тем легче вступают в нее исходные вещества и тем быстрее она протекает. Величина энергии активации реакции горения газовых смесей находится в пределах 20 000—40 000 ккал/кмоль.
Как показывает практика, в большинстве химических реакций закон действующих масс точно не проявляется. В частности, можно считать, что при горении большинства горючих газов, имеющих распространение в промышленности, реакция протекает как бимолекулярная со скоростью, пропорциональной концентрациям горючего газа Ги кислорода О2. В соответствии с этим скорость гомогенного горения можно выразить в виде:
w =- dГ/dt = К0 • ГО 2 • е –Е/RT, 1/сек (19)
Теоретический объем воздуха, необходимый для горения. Теоретический объем дымовых газов
В процессе горения топлива в топке котла участвуют углерод, водород к горючая сера топлива. В результате завершившегося процесса горения из исходных веществ — топлива и атмосферного воздуха — в топке образуются продукты сгорания: дымовые газы, а при горении твердого топлива — еще и очаговые остатки. По закону сохранения материи масса продуктов сгорания оказывается равной массе топлива и атмосферного воздуха, вступивших в реакцию горения.
В соответствии с составом исходных веществ и характером реакций горения в дымовых газах содержатся углекислота СО2, сернистый ангидрид SО2 с небольшим количеством серного ангидрида SО3, азот N2 и водяные пары Н2О. Кроме того, в дымовых газах содержится в относительно незначительном количестве кислород О2 , так как в топках котлов приходится вести режим горения с некоторым избыточным количеством воздуха, поскольку еще не удается обеспечить полное сгорание топлива при подаче в топку того количества воздуха, которое теоретически (стехиометрически) необходимо для осуществления реакций горения. Наконец, в дымовых газах может содержаться некоторое очень небольшое количество продуктов газификации и неполного горения топлива, обычно окись углерода СО, а иногда водород Н2 и углеводороды, так как летучие вещества, выделяющиеся и топлива в процессе горения, не всегда сгорают полностью.
Углекислота, сернистый ангидрид, азот и кислород образуют в совокупности «сухие» газы. Углекислоту и сернистый ангидрид часто объединяют под названием «сухие трехатомные газы» и обозначают через:
RO 2=СО2 + SО2 (20)
Крайне незначительное содержание SО3 в дымовых газах в теплотехнических расчетах не учитывают.
Количество воздуха, необходимое для горения, а также состав дымовых газов вычисляют в кубических метрах при нормальных условиях (0° С и 760 мм. рт. ст.) для 1 кг твердого и жидкого топлива и для 1 м3 газообразного топлива. Для обеспечения полного сгорания I кг твердого или жидкого топлива, имеющего элементарный состав Cp, Нp, Оp, Np, Spл, Aр, Wр , теоретически требуется массовое количество кислорода, равное:
МО20= 32/12 • Cp/100 + 8Hp/100 + Spл/100 - Оp/100, кг∕кг (21)
или соответственно объемное количество его, равное:
V О20 = МО20/ ρ О2 =1/ 1,428•100( 2,67 Cp + 8Hp+ Spл- Оp), м3∕кг (22)
где ρ О2 = 1,428 кг/м3 — плотность кислорода при нормальных условиях.
Коэффициент избытка воздуха. Действительные объемы воздуха и дымовых газов
Для обеспечения полного сгорания топлива в топку приходится подавать некоторое избыточное против теоретически необходимого количество воздуха. Отношение действительного количества воздуха, поданного в топку, Vвд к теоретически необходимому для горения количеству воздуха Vв0 называют коэффициентом избытка воздуха и обозначают α:
Vвд = α Vв0 (23)
В современных топках коэффициент избытка воздуха при сжигании твердого топлива принимают равным 1,2 — 1,6, а при сжигании жидкого и газообразного топлив 1,05 — 1,15.
Избыточный воздух, подаваемый в топку, в процессе горения не участвует, но увеличивает количество дымовых газов, образующихся на 1 кг сожженного топлива.
Коэффициент избытка воздуха зависит от вида сжигаемого топлива, способа его сжигания, конструкции топки и принимается на основании опытных данных.
Пример (решение задачи, стр. 52 (2))
При работе топок всех видов необходимо постоянно наблюдать за исправным ведением топочных процессов по контрольно-измерительным приборам. На экономичность работы котельной установки: значительное влияние оказывают потери тепла от химической неполноты сгорания топлива. Величина потерь зависит в основном от количества воздуха, поступающего в топку.
Для поддержания нормального горения нужно подводить воздуха в топку столько, сколько требуется для полного сгорания топлива, что достигается постоянным контролем за составом дымовых газов. Наиболее важно определение содержания в дымовых газах двуокиси и окиси углерода.
В случае неполного сгорания при недостатке воздуха в составе уходящих из топки газов будут углеводороды, окись углерода СО, а иногда и чистый водород Н, а при чрезмерном избытке воздуха создаются условия для удаления из топки несгоревших летучих горючих веществ и уноса частичек твердого топлива. Поэтому при: эксплуатации топки следует сводить неполноту сгорания к возможному минимуму. Как правило, котельный агрегат работает или при: полном сгорании, или с незначительной химической неполнотой, сгорания.
При присосе холодного воздуха в газоходы котлоагрегата экономичность работы его снижается, поэтому персонал, обслуживающий котлоагрегат, должен постоянно следить за исправностью обмуровки, плотным закрытием заслонок, дверок, гляделок и пр.
Энтальпия воздуха и продуктов сгорания
Энтальпия воздуха и продуктов сгорания 1 кг твердого, жидкого или 1 м3 газообразного топлива определяется по сумме энтальпий газообразных продуктов сгорания, входящих в состав дымовых газов.
Энтальпия воздуха, кДж/м3 ( при α— 1)
Iв0 = α Vв0 Св tв , (24)
где Св — теплоемкость воздуха, м3 • °С, при его температуре tв ºС.
Энтальпия газообразных продуктов сгорания, кДж/м3 (при α = 1)
Iг0 = (VRO2 CCO2 + VN2 CN2 + VH2O CH2O )tг (25)
где CCO2, CN2, CH2O — средние объемные теплоемкости двуокиси углерода, азота и водяных паров при постоянном давлении и температуре, кДж/(м3°С).
Энтальпия дымовых газов, кДж/м3, при α > 1
Iг = Iг0+ (α−1) Vв0 Св tг (26)
Теплоемкость газов изменяется в зависимости от их температуры.
Лекция 5
Дата добавления: 2016-04-06; просмотров: 4015;
