Трансмембранный потенциал, дипольные свойства волны возбуждения на поверхности возбудимого волокна.
Для более глубокого понимания механизма электровозбудимости миокарда рассмотрим мембранные свойства его клеток. Клеточная оболочка рассматривается как мембрана, по обе стороны которой располагаются два слоя взаимоуравновешивающих зарядов противоположного электрического знака, - обращенный внутрь клетки слой отрицательных зарядов и, обращенный наружу слой положительных зарядов. Два электрически равнозначных слоя мембраны могут быть представлены правильным рядом электрических диполей, ориентированных своими положительными полюсами к внешней поверхности, а отрицательными - к внутренней среде клетки подобно поляризованному диэлектрику. Такое состояние свойственно клетке, находящейся в электрофизиологическом состоянии покоя. Поляризация клетки определяет существование так называемого электростатического или электрического градиента, возникающего из разнополярности зарядов по обе стороны мембраны и влияющего на направление движения ионов электрической среды: отрицательный заряд цитоплазмы отталкивает от себя ионы отрицательного значения (анионы) и притягивает или удерживает внутри клетки положительные ионы (катионы).
Указанными физико-биологическими свойствами оболочки, ограничивающей цитоплазму клетки от внешней среды, может быть также объяснено разное содержание определенных ионов в химическом составе жидкостной среды по ту и другую сторону мембраны. Так, внутриклеточная концентрация К+ во много раз выше, чем концентрация К+ в экстрацеллюлярной жидкости, а внутриклеточная концентрация Na+ значительно ниже внеклеточной. Различие в концентрации электролитов по обе стороны мембраны определяет существование для каждого иона так называемого концентрационного (или химического) градиента, влияющего, подобно электростатическому градиенту, на направление движения ионов. Движение каждого из ионов происходит в направлении от высокой концентрации в сторону низкой.
Влияние двух градиентов - электростатического и концентрационного - на передвижение ионов может быть одно- и разнонаправленным с разной степенью преобладания одного над другим. Их взаимное влияние рассматривается как общий, меняющийся во времени электрохимический градиент, колебания которого регулируют величину напряжения и движения тока в возбудимых тканях, т.е. определяют характер "трансмембранного потенциала" или разности потенциалов, регистрирующейся двумя микроэлектродами, один из которых находится внутри клетки (проникающий электрод), а другой - на её поверхности или на известном отдалении в окружающей среде (внешний электрод).
Потенциал покоя и потенциал действия в нормальных предсердных и желудочковых клетках и в волокнах Пуркинье: Нормальное регулярное сокращение сердца сопровождается циклическими изменениями мембранного потенциала миокардиальных клеток. Применение внутриклеточных микроэлектродов позволяет прямо определить изменения мембранного потенциала. При распространении возбуждения по сердцу они меняются по амплитуде и во времени. Введение тонкого стеклянного капилляра в клетку позволяет в течение длительного времени регистрировать мембранный потенциал, т. е. разность потенциалов между внутриклеточной средой и внеклеточной жидкостью. С помощью микроманипулятора микроэлектрод продвигается до тех пор, пока его кончик (обычно менее 1 мкм в диаметре) не пройдет через клеточную мембрану. В момент, когда кончик микроэлектрода проходит с внешней поверхности клетки внутрь, внезапно регистрируется отрицательная разность потенциалов с учетом отношения к нейтральному электроду, помещенному во внеклеточную жидкость (Рис. 1). Исследования обычно проводятся на изолированных пучках миокардиальных волокон, помещенных в камеру и перфузируемых теплым оксигенированным раствором. Потенциалы действия в таких препаратах могут быть вызваны посредством пропускания коротких импульсов тока через электроды, находящиеся на поверхности волокна. Однако в отсутствие вызванных потенциалов действия внутренняя часть большинства миокардиальных клеток (за исключением клеток синусового и атриовентрикулярного узлов) остается отрицательно заряженной (80 - 90 мВ) по отношению к внеклеточному пространству. Этот трансмембранный потенциал, наблюдаемый при отсутствии электрического возбуждения, называется потенциалом покоя.
Как и во многих других возбудимых клетках, потенциал покоя сердечных клеток определяется главным образом градиентом концентрации ионов калия относительно клеточной мембраны, тогда как быстрое изменение потенциала во время начала возбуждения зависит от градиента концентрации ионов натрия. Градиенты концентрации имеют противоположную направленность.
Внутриклеточная концентрация ионов калия, [К+]i в примерно в 30 раз выше внеклеточной [К+]о. Например, в волокнах Пуркинье [К+]i и [К+]о обычно составляют 140 - 150 мМ и 4 - 5 мМ соответственно. Внутриклеточная концентрация ионов натрия, [Na+]i, напротив, значительно ниже внеклеточной, [Na+]о; в волокнах Пуркинье [Na+]i и , [Na+]о равны 10 мМ и 150 мМ соответственно.
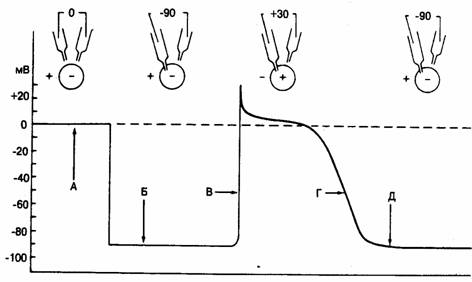
Рис. 1. Потенциал покоя и потенциал действия в сердечных клетках. Вверху - схематическое изображение клетки (кружок) и двух микроэлектродов. Фрагмент А - оба микроэлектрода находятся во внеклеточном пространстве и разности потенциалов между ними нет; Б - кончик одного микроэлектрода введен в клетку, что позволяет регистрировать разность потенциалов между внутренним пространством клетки и внеклеточной средой; в данном случае это потенциал покоя, равный -90 мВ; В - фаза быстрой деполяризации потенциала действия, возникающая при возбуждении клетки, на пике потенциала действия клетка становится на + 30 мВ более положительной по отношению к внешней среде; Г - конечная фаза реполяризации, во время которой мембранный потенциал возвращается к уровню покоя (фрагмент Д).
Во время существования каждого потенциала действия небольшое количество ионов натрия входит в клетку, а некоторое количество ионов калия выходит из нее. Нормальная электрическая активность клеток зависит от существования столь высоких градиентов для Na+ и К+, а длительное поддержание таких градиентов - от механизма активного ионного транспорта, называемого натриевым насосом. Этот механизм хорошо изучен; известно, что насос является Мg2+-АТфазой (аденозинтрифосфатазой), находящейся в клеточной мембране, и что он использует энергию АТФ (аденозинтрифосфата) для перемещения ионов натрия за пределы клетки, а ионов калия - внутрь клетки. Таким образом, натриевый насос обеспечивает четкое движение положительного заряда наружу или, иначе говоря, определенную направленность генерируемого тока через клеточную мембрану. Возникающий ток обычно очень мал, но при определенных условиях он может внести существенный вклад в изменение мембранного потенциала.
Потенциал покоя:Величина потенциала покоя определяется главным образом градиентом концентрации ионов калия. Это связано с тем, что в покое клеточная мембрана относительно проницаема для ионов калия, но сравнительно непроницаема для других ионов, таких как натрий, кальций или хлор. Ввиду существования градиента концентрации ионы калия стремятся диффундировать из клетки через мембрану. Электронейтральность не может поддерживаться за счёт движения клеточных анионов наружу, так как эти анионы в основном являются большими поливалентными ионами (часто связанными с клеточными белками), для которых клеточная мембрана непроницаема. Поэтому направленное кнаружи движение положительно заряженных ионов калия приводит к возникновению отрицательного заряда внутри клетки (Рис. 2).
Внутриклеточный потенциал, при котором суммарный пассивный поток ионов калия равен нулю, называется потенциалом равновесия ионов калия (ЕK); его величина определяется из уравнения Нернста:
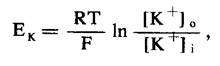
где R - газовая постоянная, Т - абсолютная температура, F - константа Фарадея, [К+]о и [К+]i - внеклеточная и внутриклеточная концентрации соответственно. Например, величина ЕK для волокна Пуркинье при 36 °С, когда [К+]о равна 4 мМ, а [К+]i - 150 мМ, составляет
ЕK = RT/F • ln(4/150) = -96,6 мВ.

Рис. 2. Распределение ионов, способствующее потенциалу покоя. Показаны типичные концентрации ионов внутри и вне клетки. В покое клеточная мембрана хорошо проницаема для ионов К+, но слабо проницаема для ионов Na+ и непроницаема для крупных анионов (А-). Проницаемость для Сl- также относительно низкая, и распределение ионов Сl- определяется средней величиной мембранного потенциала.
Из уравнения Нернста видно, что ЕK изменится на 61,4 мВ при 10-кратном изменении либо [К+]о, либо [К+]i,. Если бы клеточная мембрана была проницаемой исключительно для К+, клетка вела бы себя точно так же, как калиевый электрод, и ее внутриклеточный потенциал менялся бы с изменением [К+]i и [К+]о в точном соответствии с уравнением Нернста. Действительно, мембранный потенциал волокон Пуркинье в покое, а также миокардиальных волокон предсердий и желудочков логически хорошо аппроксимируется уравнением Нернста, когда [К+]о выше 10 мМ. Однако при более низких величинах [К+]о потенциал покоя этих клеток менее отрицательный, чем калиевый потенциал равновесия, и данное расхождение увеличивается по мере уменьшения [К+]о. Например, потенциал покоя волокон Пуркинье в растворе, содержащем 4 мМ К+, на несколько милливольт менее отрицательный, чем Ек, оцененный выше. Это объясняется тем, что клеточная мембрана не является проницаемой исключительно для K+, как предполагалось выше; через нее проникают также (хотя и значительно хуже) ионы Na+. Поскольку и электрический градиент, и градиент концентрации благоприятствуют движению Na+ внутрь, через клеточную мембрану протекает небольшой входящий деполяризующий поток ионов. Деполяризация, вызываемая этим потоком Na+, пренебрежимо мала при высокой [К+]о и, следовательно, высокой проводимости мембраны для калия, но она становится значительной при низкой [К+]о, так как в этих условиях протекающие через мембрану потоки К+ также существенно уменьшаются. Деполяризующее влияние Na+ удобнее всего обозначать терминами уравнения «постоянного поля» Гольдмана или Ходжкина и Катца для потенциала покоя (Vr) клетки, проницаемой как для К+, так и для Na+
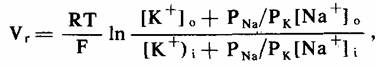
где PNa/PK - отношение коэффициентов проницаемости клеточной мембраны для натрия и для калия. Данное уравнение позволяет достаточно точно рассчитать потенциалы покоя в волокнах скелетных мышц и в волокнах Пуркинье (миокард) в более широком диапазоне величин (К+)о, чем при расчетах по формуле Нернста, если PNa/PK постоянно и составляет приблизительно 1/100. Так как [К+]i в норме значительно больше, чем [Na+]i, в данном отношении коэффициентов проницаемости второй член в знаменателе достаточно мал и им можно пренебречь, что позволяет переписать уравнение следующим образом:
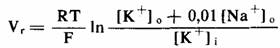
или, если принять (Na+)о равным 150 мМ, то
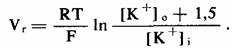
Из этого уравнения сразу видно, что потенциал покоя (Vr) близок к калиевому потенциалу равновесия (ЕK) только при [К+]о значительно большем, чем 1,5 мМ; при низких значениях [К+]о второй член в числителе начинает играть важную роль. Например, при [К+]о, равном 1,5 мМ, Vr будет менее отрицательным, чем ЕK, на 61,4•log (3/1,5) = 61,4•log 2, или приблизительно на 18 мВ. Как следует из уравнения Гольдмана, а также Ходжкина и Катца, потенциал покоя чувствителен к отношение проницаемости ионов, а не к самим величинам проницаемости. Например, даже если проницаемость для ионов Na+ была бы очень значительной, потенциал покоя определялся бы главным образом градиентом концентрации ионов К+ до тех пор, пока проницаемость мембраны дляК+ оставалась бы гораздо выше, чем для Na+. Каналы мембраны, через которые движутся ионы К+, создавая калиевые потоки, определяющие мембранный потенциал покоя, известны как направленные кнутри К-каналы. Объем калиевых потоков, проходящих по этим каналам, находится в четкой зависимости от величины и направления электрохимической движущей силы для K+, равной (Vm - ЕK), т. е. разности мембранного потенциала (Vm) и калиевого потенциала равновесия (ЕK). Эти каналы называют «каналами, направленными внутрь», так как они позволяют прохождение направленных внутрь больших потоков К+ при высоких и отрицательных значениях Vm-ЕK, но обеспечивают лишь очень небольшие потоки K+, направленные кнаружи, когда движущая сила велика и положительна.
Изменения уровня потенциала покоя являются основной причиной аритмии и нарушений проведения и возникают при тех или иных патологических состояниях. Например, заболевание сердца может привести к изменениям внутриклеточной и (или) внеклеточной концентрации ионов К+, что в свою очередь вызовет изменение мембранного потенциала покоя. В других случаях характеристики клеточной мембраны могут изменяться таким образом, что относительная проницаемость мембраны для Na+ или других ионов (таких как Са2+, возрастет, в результате чего потенциал покоя также изменится.
Возбуждение клетки характеризуется быстрым перераспределением концентрации ионов по обе стороны мембраны и соответственно этому изменением значения её двух электрических слоев: внешний слой мембраны приобретает отрицательный заряд, а внутренний - положительный. Происходит быстрая переориентация зарядов диполей, меняющая электрический знак двух слоев поляризованной мембраны на прямо противоположный исходному. Эту быструю последовательность изменения электрического значения мембраны называют процессом деполяризации. При деполяризации, соответствующей фазе 0 трансмембранного потенциала, изменяется не только величина последнего (в диапазоне 120 мВ), но и его значение (от отрицательного значения -90 до положительного значения +30 мВ), т.е. имеет место реверсия потенциала, обозначаемая как положительный пик. Реверсия внутриклеточного потенциала периода деполяризации обнаруживается и на поверхности волокна с помощью двух электродов и регистрируется на электрограмме (ЭГ) в виде быстрого отклонения, не достигающего, однако, величины внутриклеточного реверсионного напряжения (пика реверсии до +30 мВ).
По завершении деполяризации в клетке начинается неравномерный по времени спад возбуждения, характеризующийся определенной последовательностью перехода к первоначальному состоянию поляризации и восстановлению исходной ориентации электрических диполей. Процесс восстановления исходного электрического равновесия клетки получил название реполяризации. Он заканчивается восстановлением исходной величины трансмембранного потенциала покоя отрицательного значения как показателя состояния поляризации клетки.
В клинической электрокардиографии с помощью ЭГ, записывающейся с обнаженного сердца, или ЭКГ, записывающейся с поверхности тела, регистрируется лишь та разность потенциалов, которая развивается на поверхности возбудимого субстракта. В период возбуждения волокна на его поверхности обнаруживается напряжение, которое регистрируется на ЭКГ при использовании поверхностных непроникающих электродов. Разность потенциалов записывается в течение периодов деполяризации и реполяризации и исчезает при переходе клетки к состоянию покоя.
На характер ЭГ влияет ход распространения процессов деполяризации и реполяризации мембраны по длине (объему) волокна. Колебания разности потенциалов на поверхности клетки зависят, таким образом, не только от скорости и характера изменений ТП, но и от скорости проведения импульса или времени распространения возбуждения по мембране, а форма кривой ЭГ также и от места расположения электрода на поверхности мембраны относительно участка возбуждения. Создающееся на поверхности возбудимых структур электрическое поле совпадает по своим характеристикам с теоретически рассчитанным значением электрического поля диполя. Другими словами, электрические свойства самого биологического источника разности потенциалов (и тока) имеют природу диполя.
Дата добавления: 2016-04-06; просмотров: 2293;
