Энзимология как учение о ферментах. Простые и сложные ферменты. 5 страница
Примером мультэнзима может служить пируватдегидрогеназный комплекс, находящийся в митохондриях и катализирует последовательные реакции окислительного декарбоксилирования пирувата:
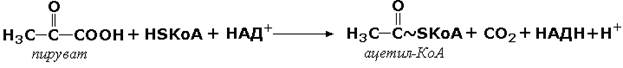
Пируватдегидрогеназный комплекс состоит из трёх ферментов: пируватдекарбоксилазы, трансацилазы и дигидролипоилдегидрогеназы.
В промежуточных реакциях участвует пять коферментов:
тиаминдифосфат;
липоевая кислота;
коэнзим А;
ФАД;
НАД.
Регуляторным ферментом комплекса является пируватдекарбоксилаза, активность которой (и всего комплекса в целом) снижается при высокой концентрации АТФ в клетке.
Раздел 4.2
Основные методы фракционирования белков, основанные на их различиях по физико-химическим свойствам и биологической активности.
Вся информация об отдельных метаболических реакциях, о промежуточных соединениях, образующихся на последовательных этапах различных метаболических путей, а также о механизме регуляции работы катализаторов получена главным образом с использованием очищенных препаратов ферментов. Высокоочищенные препараты ферментов необходимо иметь также и для того, чтобы получить надежные данные о кинетике, кофакторах, активных центрах, о структуре и механизме действия ферментов.
Процесс очистки состоит в выделении данного фермента из грубого клеточного экстракта, содержащего множество других компонентов. Основная проблема — отделить нужный фермент от сотен химически и физически сходных белков.
Как вам уже известно, различные белки отличаются друг от друга по своим физико-химическим свойствам и биологической активности. На этих различиях основаны широко используемые в медицине и биотехнологии методы разделения белковых смесей на фракции и выделения отдельных белков.
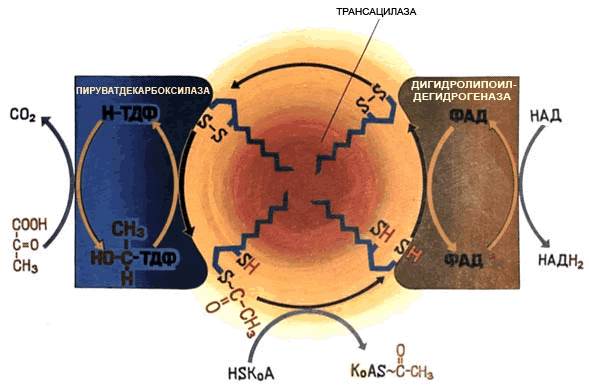
Методы разделения белков по молекулярной массе
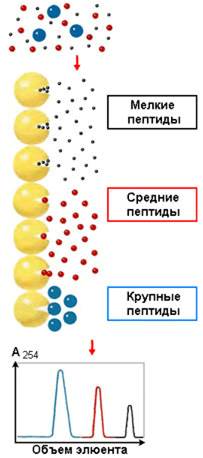
Рисунок 4.5. Разделение пептидов методом гель-фильтрации
С этой целью наиболее часто применяют методы гель-фильтрации, ультрацентрифугирования, диализа и диск-электрофореза.
Гель-фильтрация – метод, основанный на различной способности молекул разных размеров проходить через своеобразные «молекулярные сита» – сефадексы – инертные гидратированные полисахаридные материалы, представляющие собой пористые гранулы. Крупные белковые молекулы не способны диффундировать внутрь гранул сефадекса и элюируются (выходят из колонки) в первую очередь. В то же время молекулы небольшого размера проникают через поры гранул, задерживаются в них и движутся в колонке с более низкой скоростью (рисунок 4.5). Метод гель-фильтрации эффективно используется и при очистке белков от низкомолекулярных примесей.
Ультрацентрифугирование. Метод основывается на измерении скорости седиментации (осаждения) белковых частиц под действием центробежной силы, создаваемой в ультрацентрифуге. Скорость седиментации частиц пропорциональна их молекулярной массе.
Диализ – процесс разделения высокомолекулярных и низкомолекулярных веществ при помощи полупроницаемой мембраны. Белки не способны проходить через такую мембрану, поэтому данный метод применяется для очистки белков от неорганических соединений.
Диск-электрофорез в полиакриламидном геле проводят в присутствии детергента – додецилсульфата натрия (ДСН), маскирующего заряд ионогенных групп в молекуле белка. Поэтому электрофоретическая подвижность белков, связанных с ДСН, будет пропорциональна их молекулярной массе.
Методы разделения белков по электрическому заряду
Рисунок 4.6. Разделение пептидов методом ионообменной хроматографии
На различии белков по электрическому заряду основаны методы высаливания, ионообменной хроматографии, электрофореза, изоэлектрического фокусирования.
Высаливание – процесс осаждения белков из раствора при добавлении сульфата аммония, а также солей щелочных и щелочноземельных металлов. Чем больше величина заряда белка, тем более высокая концентрация соли требуется для его осаждения.
Ионообменная хроматография – метод, основанный на взаимодействии заряженных групп белка с ионными группами полимеров-ионообменников. При разделении смеси белков на анионите (например, диэтиламиноэтилцеллюлозе) в первую очередь элюируются положительно заряженные белки, затем – нейтральные и, наконец, отрицательно заряженные белки (рисунок 4.6). При разделении смеси белков на катионообменнике (например, карбоксиметилцеллюлозе) элюция происходит в обратном порядке.
Электрофорез – метод, основанный на различной скорости движения белков в электрическом поле на различных носителях (бумага, полиакриламидный и крахмальный гели и т.д.). Эта скорость зависит от величины заряда белка при данном значении рН.
Изоэлектрическое фокусирование – методика проведения электрофореза на колонке или в тонком слое с градиентом рН, создаваемом при помощи синтетических полиаминокарбоновых кислот – амфолинов. Каждый белок разделяемой смеси будет располагаться на колонке в участке со значением рН, соответствующем его изоэлектрической точке (см. 1.4.2).
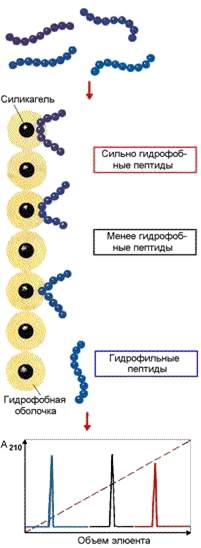
Рисунок 4.7. Разделение пептидов методом гидрофобной хроматографии
Методы разделения белков по гидрофобным свойствам
Различная гидрофобность белковых молекул используется при проведении гидрофобной хроматографии. В качестве носителя в данном случае применяется силикагель с ковалентно присоединёнными углеводородными радикалами, содержащими 8 или 18 углеродных атомов. Связывание белков с такими носителями обусловлено гидрофобными взаимодействиями между алкильными цепями и гидрофобными участками белковой молекулы. Чем выше гидрофобность белковой молекулы, тем прочнее она связывается с частицами модифицированного силикагеля. Белки наносят в составе растворов с высоким содержанием соли, например (NH4)2SO4, и элюируют раствором с понижающейся концентрацией этой же соли. При элюции вначале выделяются наиболее гидрофильные белки, а в последнюю очередь – наиболее гидрофобные (рисунок 4.7).
Методы разделения белков по биологической активности
Способность белков избирательно взаимодействовать с определёнными лигандами составляет основу метода аффинной или биоспецифической хроматографии.
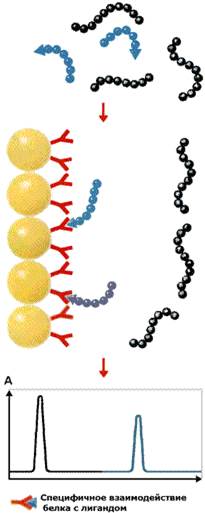
Рисунок 4.8. Разделение пептидов методом аффинной хроматографии
Достоинством этого метода очистки является то, что он позволяет избирательно извлекать из сложной смеси белков один конкретный белок или по крайней мере небольшое их число. Метод основан на использовании иммобилизованного лиганда, который специфически взаимодействует с тем белком, который требуется получить в очищенном виде. Из всех белков, присутствующих в смеси, с этим иммобилизованным лигандом связываются только те белки, которые способны вступать с ним в сильное взаимодействие. После удаления всех прочих несвязавшихся белков нужный фермент элюируют с иммобилизованного лиганда либо концентрированными солевыми растворами, либо раствором, содержащим растворимую форму лиганда (рисунок 4.8). Применение метода аффинной хроматографии позволяет добиться в ходе очистки результатов, обычно превосходящих результаты последовательного применения многочисленных классических методов.
Как известно, ферменты обладают высокой специфичностью по отношению к своим субстратам и коферментам, поэтому наиболее подходящими лигандами служат производные субстратов и коферментов, ковалентно связанные с носителем, например с сефадексом. Они могут быть присоединены к носителю либо непосредственно, либо через связующую «ножку» (линкер) из 3—8 атомов углерода.
Примером успешного применения аффинной хроматографии может служить очистка множества различных дегидрогеназ на аффинных носителях с НАД+ в качестве лиганда. При этом с лигандом могут связываться несколько дегидрогеназ, которые при элюировании их раствором НАД+ выходят вместе, и их дальнейшее разделение проводят, используя уже не коферментные, а субстратные аффинные носители.
С аффинной хроматографией во многом сходна хроматография, при которой в качестве лигандов используются красители (голубая, зеленая или красная сефароза), а также хроматография на гидрофобных лигандах, где носителем является октил- или фенилсефароза. В первом случае в качестве иммобилизованного лиганда используют органический краситель, являющийся аналогом субстрата, кофермента или аллостерического эффектора. Элюирование обычно осуществляют солевым раствором увеличивающейся концентрации.
Раздел 4.3
Принципы и методы определения активности ферментов в биологическом материале.
Ферменты, по сравнению с другими веществами белковой природы, обладают уникальным свойством ускорять химические реакции. Это свойство может быть использовано для количественного определения содержания ферментов в биологическом материале (тканевом экстракте, сыворотке крови и т.д.). При правильно подобранных экспериментальных условиях почти всегда существует пропорциональность между количеством фермента и скоростью катализируемой реакции, поэтому по активности фермента можно судить о количественном содержании его в исследуемой пробе.
Измерение ферментативной активности основывается на сравнении скорости химической реакции в присутствии активного биокатализатора со скоростью реакции в контрольном растворе, в котором фермент отсутствует или инактивирован.
Исследуемый материал помещают в инкубационную среду, где созданы оптимальные температура, рН среды, концентрации активаторов и субстратов. Одновременно осуществляют постановку контрольной пробы, в которую фермент не добавляют. Спустя некоторое время реакцию останавливают путём добавления различных реагентов (изменяющих рН среды, вызывающих денатурацию белков и т.д.) и проводят анализ проб.
Для того чтобы определить скорость ферментативной реакции, необходимо знать: 1) разность концентраций субстрата или продукта реакции до и после инкубации; 2) время инкубации; 3) количество материала, взятое для анализа.
Наиболее часто активность фермента оценивают по количеству образовавшегося продукта реакции. Так поступают, например, при определении активности аланинаминотрансферазы, катализирующей следующую реакцию:
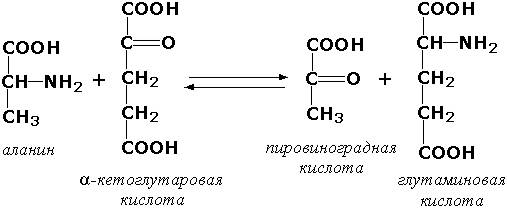
Определяя содержание одного из продуктов реакции – пировиноградной кислоты – в пробе после инкубации и вычитая из этого значения количество пировиноградной кислоты в контрольной пробе (в неё исследуемый материал добавляется после инкубации), находят количество продукта реакции, образовавшегося за время инкубации.
Активность фермента можно рассчитывать также исходя из количества израсходованного субстрата. В качестве примера можно привести способ определения активности α-амилазы – фермента, расщепляющего крахмал. Измерив содержание крахмала в пробе до и после инкубации и вычислив разность, находят количество субстрата, расщеплённого за время инкубации.
Методы определения активности ферментов
Существует большое количество методических приёмов для определения активности ферментов, различающихся по технике исполнения, специфичности, чувствительности.
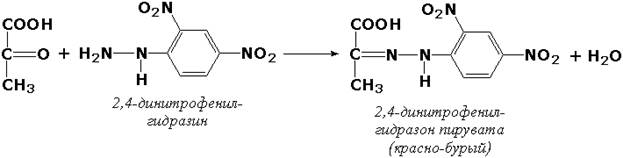
Чаще всего для определения применяются фотоэлектроколориметрические методы. В основе этих методов лежат цветные реакции с одним из продуктов действия ферментов. При этом интенсивность окраски получаемых растворов (измеренная на фотоэлектроколориметре) пропорциональна количеству образовавшегося продукта. Например, в процессе реакций, катализируемых аминотрансферазами, накапливаются α-кетокислоты, которые дают с 2,4-динитрофенилгидразином соединения красно-бурого цвета:
Если исследуемый биокатализатор обладает низкой специфичностью действия, то можно подобрать такой субстрат, в результате реакции с которым образуется окрашенный продукт. Примером может служить определение щелочной фосфатазы – фермента, широко распространённого в тканях человека, его активность в плазме крови существенно меняется при заболеваниях печени и костной системы. Этот фермент в щелочной среде гидролизует большую группу фосфорнокислых эфиров, как природных, так и синтетических. Одним из синтетических субстратов является паранитрофенилфосфат (бесцветный), который в щелочной среде расщепляется на ортофосфат и паранитрофенол (жёлтого цвета).
За ходом реакции можно наблюдать, измеряя постепенно нарастающую интенсивность окраски раствора:
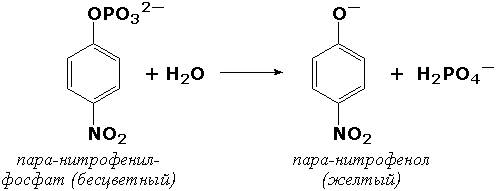
Для ферментов, обладающих высокой специфичностью действия, такой подбор субстратов, как правило, невозможен.
Спектрофотометрические методы основаны на изменении ультрафиолетового спектра химических веществ, принимающих участие в реакции. Большинство соединений поглощает ультрафиолетовые лучи, причём поглощаемые длины волн характерны для присутствующих в молекулах этих веществ определённых групп атомов. Ферментативные реакции вызывают внутримолекулярные перегруппировки, в результате которых меняется ультрафиолетовый спектр. Эти изменения можно зарегистрировать на спектрофотометре.
Спектрофотометрическими методами, например, определяют активность окислительно-восстановительных ферментов, содержащих в качестве коферментов НАД или НАДФ. Эти коферменты действуют как акцепторы или доноры атомов водорода и, таким образом, либо восстанавливаются, либо окисляются в процессах метаболизма. Восстановленные формы этих коферментов имеют ультрафиолетовый спектр с максимумом поглощения при 340 нм, окисленные формы этого максимума не имеют. Так, при действии лактатдегидрогеназы на молочную кислоту происходит перенос водорода на НАД, что приводит к увеличению поглощения НАДН при 340 нм. Величина этого поглощения в оптических единицах пропорциональна количеству образовавшейся восстановленной формы кофермента.
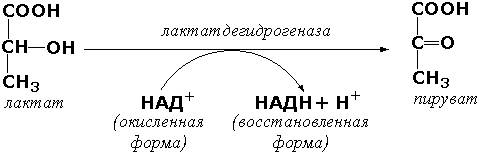
По изменению содержания восстановленной формы кофермента можно определить активность фермента.
Флюориметрические методы. В основе этих методов лежит явление флюоресценции, которое заключается в том, что исследуемый объект под влиянием облучения излучает свет с более короткой длиной волны. Флюориметрические методы определения активности ферментов более чувствительны, чем спектрофотометрические. Сравнительно новыми и ещё более чувствительными являются хемилюминесцентные методы с применением люциферин-люциферазной системы. Такие методы позволяют определять скорость реакций, протекающих с образованием АТФ. При взаимодействии люциферина (карбоновой кислоты сложного строения) с АТФ образуется люцифериладенилат. Это соединение окисляется при участии фермента люциферазы, что сопровождается световой вспышкой. Измеряя интенсивность световых вспышек, удаётся определять количества АТФ порядка нескольких пикомолей (10–12 моль).
Титрометрические методы. Ряд ферментативных реакций сопровождается изменением рН инкубационной смеси. Примером такого фермента является липаза поджелудочной железы. Липаза катализирует реакцию:
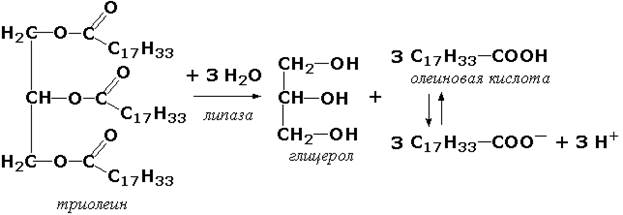
Образующиеся жирные кислоты могут быть оттитрованы, причём количество щёлочи, израсходованное на титрование, будет пропорционально количеству выделившихся жирных кислот и, следовательно, активности липазы. Определение активности этого фермента имеет клиническое значение.
Манометрические методы основаны на измерении в закрытом реакционном сосуде объёма газа, выделившегося (или поглощённого) в ходе энзиматической реакции. С помощью таких методов были открыты и изучены реакции окислительного декарбоксилирования пировиноградной и α-кетоглутаровой кислот, протекающие с выделением СО2. В настоящее время эти методы используются редко.
Основные условия работы с ферментами
Ферменты, как все белки, являются относительно неустойчивыми веществами. Они легко подвергаются денатурации и инактивации. Поэтому при работе с ними необходимо выполнять определенные требования.
1. При хранении объекта изучения свыше нескольких часов при комнатной температуре фермент почти полностью инактивируется. Поэтому анализ определения активности фермента следует проводить в возможно короткие сроки. При необходимости длительное хранение возможно, если раствор фермента высушивают из замороженного состояния в высоком вакууме (лиофильная сушка). В этом случае фермент почти полностью сохраняет активность при дальнейшем его хранении при комнатной температуре. Некоторые ферменты хорошо сохраняются в концентрированных растворах солей, например, в насыщенном сульфате аммония (процесс высаливания). При надобности осадок фермента можно отцентрифугировать и растворить в физиологическом растворе или соответствующем буфере. Если необходимо, от избытка соли можно избавиться диализом.
2. Необходимо помнить о чувствительности ферментов к колебаниям рН среды. За небольшим исключением большинство ферментов инактивируется в растворах с рН ниже 5 или выше 9, а оптимум действия ферментов появляется в зоне нескольких единиц или десятых долей единицы значения рН. Определение рН буферных растворов, используемых при работе с ферментами, рекомендуется проводить очень точно с помощью рН-метра.
3. Ферменты легко разрушаются сильнодействующими реагентами: кислотами, щелочами, окислителями, солями тяжелых металлов. Необходимо работать с химически чистыми реактивами и бидистиллированной водой, т. к. даже небольшое загрязнение реактивов, особенно примесью металлов, которые могут действовать как модуляторы, приводит к изменению активности фермента.
4. При работе с ферментами как нигде обязательно строгое соблюдение стандартизации условий исследования: точное выдерживание температурного и временного режимов, использование реактивов из одной партии, а при смене реактивов надо снова откалибровать получаемые данные. Если развивающаяся окраска в цветной реакции неустойчива во времени, необходимо строго соблюдать сроки фотометрирования.
5. Рекомендуется работать в условиях достаточной степени насыщения фермента субстратом, так как это обстоятельство существенно сказывается на конечном результате, недостаток субстрата нивелирует различия между вариантами.
6. При работе с ферментами необходимо учитывать органоспецифичный изоферментный спектр. Часто такая специфичность затрагивает условия действия энзима. На ход реакции может повлиять различное сродство к субстрату, иная чувствительность к рН, свойственные изоэнзимам того или иного органа или ткани. Переносить метод исследования активности фермента с одного объекта на другой (например, с сыворотки на ткань или с одного органа на другой) нужно крайне осторожно, с учетом всех известных данных о ферменте и его множественных формах, а также с тщательной проверкой результатов.
Для широкого внедрения различных биохимических (ферментативных) реакций вводится автоматизация наиболее общепризнанных и необходимых анализов, а также унификация и стандартизация лабораторных тестов. Это рационально и необходимо как для повышения точности, качества проведения проб, так и для сравнения данных, которые получены в разных лабораториях.
Общепринятым является и обязательное параллельное исследование, наряду с изучаемой патологией, физиологического контроля — группы практически здоровых для установления нормальных, физиологических колебаний. Понимая относительность понятия «нормальная величина», следует принять, что для выявления различий в патологии и оценки патологического признака, за «норму», как правило, принимается средняя арифметическая М±1σ или 2σ (при нормальном Гауссовом распределении) в зависимости от степени колебания показателя.
Раздел 4.4
Единицы активности ферментов, их применение.
Международная комиссия по ферментам предложила за единицу активности любого фермента принимать такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля (10–6 моль) субстрата в единицу времени (1 мин, 1 час) или одного микроэквивалента затронутой группы в тех случаях, когда атакуется более одной группы в каждой молекуле субстрата (белки, полисахариды и другие). Должна быть указана температура, при которой проводится реакция. Результаты измерений активности ферментов могут быть выражены в единицах общей, удельной и молекулярной активности.
Общая активность фермента
За единицу общей активности фермента принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата в единицу времени в расчёте на количество материала, взятого для исследования. Так, активность аланинаминотрансферазы в печени крыс равна 1670 мкмоль пирувата в час на 1 г ткани; активность холинэстеразы в сыворотке крови человека составляет 250 мкмоль уксусной кислоты в час на 1 мл сыворотки при 37°C.
Особого внимания исследователя требуют высокие значения активности фермента как в норме, так и в патологии. Рекомендуется работать с небольшими показателями активности фермента. Для этого источник фермента берут в меньшем количестве (сыворотку разводят в несколько раз физиологическим раствором, а для ткани готовят меньший процентный гомогенат). По отношению к ферменту в таком случае создаются условия насыщения субстратом, что способствует проявлению его истинной активности.
Общая активность фермента рассчитывается с помощью формулы:
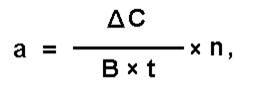
где а – активность фермента (общая), ΔС – разность концентраций субстрата до и после инкубации; В – количество материала, взятого на анализ, t - время инкубации; n - разведение.
Следует иметь в виду, что показатели активности ферментов сыворотки крови и мочи, исследуемых в диагностических целях, выражают в единицах общей активности.
Удельная активность фермента
Поскольку ферменты являются белками, важно знать не только общую активность фермента в исследуемом материале, но и ферментативную активность белка, находящегося в данной пробе. За единицу удельной активности принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата в единицу времени в расчёте на 1 мг белка пробы. Для вычисления удельной активности фермента необходимо общую активность разделить на содержание белка в пробе:
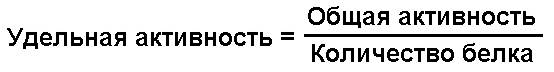
Например, содержание белка в ткани печени составляет 160 мг/г. Разделив общую активность аланинаминотрансферазы (см. выше) на это значение, получаем 10,4 мкмоль пирувата/мг белка × час.
Чем хуже очищен фермент, тем больше в пробе находится посторонних балластных белков, тем ниже удельная активность. В ходе очистки количество таких белков уменьшается, и соответственно удельная активность фермента повышается. Предположим, в исходном биологическом материале, являющемся источником фермента (измельчённая печень, кашица из растительной ткани), удельная активность была равна 0,5 мкмоль/ (мг белка× мин). После дробного осаждения сульфатом аммония и гель-фильтрации через сефадекс она повысилась до 25 мкмоль/ (мг белка× мин), т.е. увеличилась в 50 раз. К оценке эффективности очистки ферментных препаратов прибегают при производстве лекарственных средств энзиматической природы.
Удельную активность определяют в том случае, когда нужно сопоставить активность разных препаратов одного и того же фермента. Если требуется сравнить активность разных ферментов, рассчитывают молекулярную активность.
Молекулярная активность фермента
Молекулярная активность (или число оборотов фермента) – это количество моль субстрата, подвергающееся превращению под действием 1 моль фермента в единицу времени (обычно в 1 минуту). Разным ферментам присуща неодинаковая молекулярная активность. Уменьшение числа оборотов ферментов происходит под действием неконкурентных ингибиторов. Изменяя конформацию каталитического центра фермента, эти вещества понижают сродство фермента к субстрату, что приводит к уменьшению числа молекул субстрата, реагирующих с одной молекулой фермента в единицу времени.
Раздел 4.5
Энзимодиагностика.
Некоторые ферменты, проферменты и их субстраты в норме постоянно циркулируют в крови человека и выполняют физиологические функции. Примерами таких ферментов плазмы являются липопротеинлипаза, псевдохолинэстераза, а также проферменты компонентов систем свертывания крови и растворения кровяного сгустка. Эти ферменты называются секреторными, большинство из них синтезируется в печени и секретируются в кровь. Концентрация таких энзимов в крови либо такая же, как в тканях, либо более высокая.
Кроме секреторных ферментов, в плазме крови присутствуют ферменты, которые не выполняют в крови никаких известных физиологических функций. Их субстраты в плазме обычно не обнаруживаются, и в норме их концентрация в крови человека почти в миллион раз ниже, чем в тканях. Такие ферменты называются индикаторными. Появление их в плазме крови в повышенных концентрациях указывает на повышенную скорость разрушения тканей. Таким образом, измерение в крови уровня индикаторных ферментов плазмы дает врачу ценную диагностическую и прогностическую информацию.
Индикаторные ферменты обычно обнаруживаются в плазме в малых количествах, и появляются в ней вследствие постоянно протекающих процессов разрушения клеток организма. Появление этих ферментов в плазме в повышенных концентрациях указывает на повышенную скорость разрушения тканей. Поступлением в плазму значительных количеств мышечных ферментов сопровождается и выполнение тяжелой физической работы. Для клеток разных органов характерен свой набор ферментов, поэтому повышение в крови активности того или иного фермента может указывать на заболевание соответствующего органа.
В клинической практике используется количественное определение различных индикаторных ферментов плазмы. В клетках поджелудочной железы вырабатываются ферменты трипсин (трипсиноген), липаза и амилаза; при остром воспалении поджелудочной железы (острый панкреатит) активность этих ферментов в крови возрастает; повышенная активность амилазы обнаруживается и в моче.
Довольно часто в целях диагностики проводят анализ изоферментного спектра некоторых ферментов, в частности ЛДГ. В клетках миокарда преобладает изофермент ЛДГ1. При заболеваниях, связанных с повреждением сердечной мышцы, концентрация и активность этого изофермента в плазме крови значительно возрастает. При некоторых заболеваниях печени (в том числе инфекционной природы) в крови возрастает содержание ЛДГ4 и ЛДГ5 - изоферментов, характерных для клеток печени.
В настоящее время для получения этой ценной диагностической и прогностической информации в большинстве случаев используются автоанализаторы. В таблице 4.1 приведен перечень ферментов, активность которых чаще всего исследуют в диагностической энзимологии.
Таблица 4.1.
Основные ферменты сыворотки, используемые в клинической диагностике.
Аспартатаминотрансфераза
Инфаркт миокарда
Аланинаминотрансфераза
Вирусный гепатит
Амилаза
Острый панкреатит
Церулоплазмин
Гепатолентикулярная дегенерация (болезнь Вильсона)
Креатинфосфокиназа
Заболевание мышц и инфаркт миокарда
γ-Глутамилтранспептидаза
Различные заболевания печени
Лактатдегидрогеназа (изозимы)
Инфаркт миокарда
Липаза
Острый панкреатит
Кислая фосфатаза
Рак предстательной железы
Щелочная фосфатаза (изозимы)
Различные заболевания костей, закупорка протоков печени
Высокая специфичность ферментов позволяет использовать их для обнаружения и количественного определения нормальных и патологических компонентов крови и мочи. Например, с помощью фермента уреазы, действующего только на мочевину, можно проводить определение этого вещества в биологических жидкостях. Фермент глюкозооксидаза применяется для определения глюкозы в крови и моче у больных сахарным диабетом.
Дата добавления: 2016-04-02; просмотров: 753;
