Энзимология как учение о ферментах. Простые и сложные ферменты. 3 страница
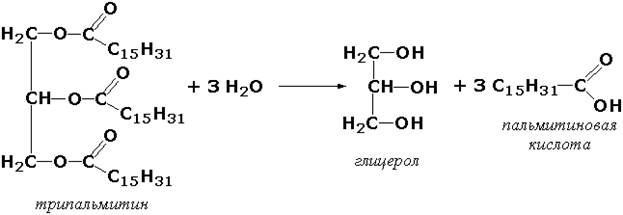
Другие представители эстераз расщепляют сложноэфирные связи в ацетилхолине (ацетилхолинэстераза), фосфолипидах (фосфолипазы), нуклеиновых кислотах (нуклеазы), фосфоорганических эфирах (фосфатазы).
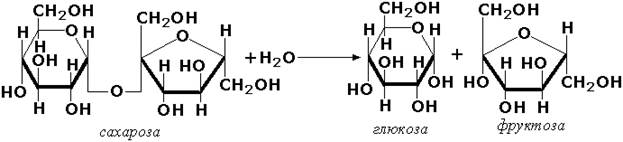
Гидролазы, действующие на гликозидные связи (гликозидазы) ускоряют реакции гидролиза олиго- и полисахаридов, а также других соединений, содержащих моносахаридные остатки (например, нуклеозидов). Характерным представителем является сахараза (β-D-фруктофуранозид-фруктогидролаза, КФ 3.2.1.26). катализирующая расщепление сахарозы:
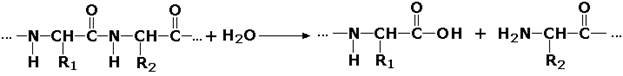
Гидролазы, действующие на пептидные связи (пептидазы), катализируют реакции гидролиза пептидных связей в белках и пептидах. К этой группе относятся пепсин, трипсин, химотрипсин, катепсин и другие протеолитические ферменты. Гидролиз пептидных связей происходит по следующей схеме:
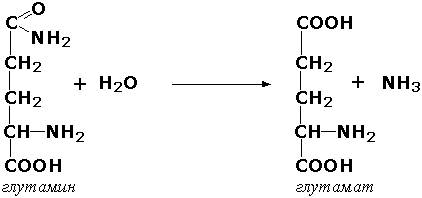
Гидролазы, действующие на C-N-связи, отличающиеся от пептидных, - ферменты, ускоряющие гидролиз амидов органических кислот. Представитель этого подкласса - глутаминаза (L-глутамил-амидогидролаза, КФ 3.5.1.2) - участвует в поддержании кислотно-основного состояния организма, катализируя в почках гидролиз глутамина:
IV. ЛИАЗЫ
Лиазы - класс ферментов, катализирующих негидролитические реакции расщепления субстратов с образованием двойных связей или, наоборот, присоединения по месту разрыва двойной связи. Общая схема этих реакций:
, 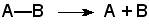
где А—В - субстрат, А и В - продукты реакции. В результате таких реакций часто выделяются простые вещества, например, СО2, NH3, H2О.
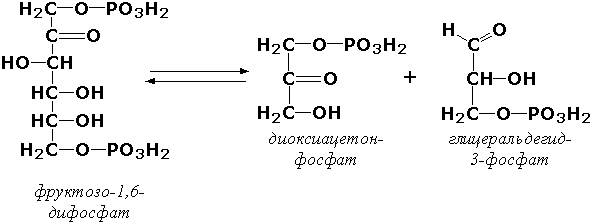
Углерод-углерод-лиазы катализируют разрыв связи между двумя атомами углерода. Среди них наибольшее значение имеют карбокси-лиазы (декарбоксилазы), под влиянием которых осуществляется декарбоксилирование a-кето- и аминокислот, лиазы кетокислот , к которым относится цитратсинтаза, альдегид-лиазы (альдолазы). К последним относится фруктозодифосфатальдолаза (фруктозо-1,6-дифосфат-D-глицеральдегид-З-фосфат-лиаза, КФ 4.1.2.13), катализирующая реакцию:
Углерод-кислород-лиазы катализируют разрыв связи между атомами углерода и кислорода. В этот подкласс входят прежде всего гидро-лиазы, участвующие в реакциях дегидратации и гидратации. Примером может служить сериндегидратаза (L-серин-гидро-лиаза (дезаминирующая), КФ 4.2.1.3), осуществляющая превращение:
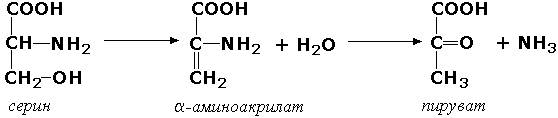
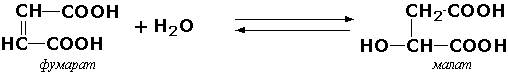
Иногда за основу рабочего названия может быть принята обратная реакция с применением термина "гидратаза". Так, для фермента цикла трикарбоновых кислот L-малат-гидро-лиазы (КФ 4.2.1.2) рекомендовано название "фумаратгидратаза":
Углерод-азот-лиазы участвуют в отщеплении азотсодержащих групп. Представителем этого подкласса является гистидин-аммиак-лиаза (L-гистидин-аммиак-лиаза, КФ 4.3.1.3), участвующая в дезаминировании гистидина:
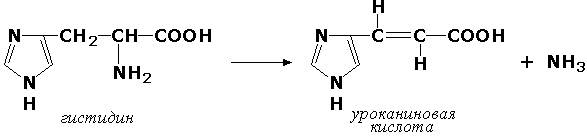
Углерод-сера-лиазы катализируют отщепление сульфгидрильных групп. К этому подклассу относятся десульфгидразы серу содержащих аминокислот, например, цистеиндесульфгидраза (L-цистеин-сероводород-лиаза (дезаминирующая), КФ 4,4.1.1).
V. ИЗОМЕРАЗЫ
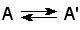
Изомеразы - класс ферментов, ускоряющих процессы внутримолекулярных превращений с образованием изомеров. Схематически реакции такого типа могут быть представлены следующим образом:
,
где А и А' - вещества-изомеры.
Изомеразы - сравнительно немногочисленный класс ферментов, он подразделяется на следующие подклассы в зависимости от типа катализируемой реакции изомеризации:
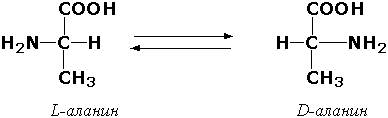
Рацемазы и эпимеразы катализируют взаимопревращение изомеров, содержащих асимметрические атомы углерода. Рацемазами называются ферменты, действующие на субстраты с одним асимметрическим атомом, например, превращающие L-аминокислоты в D-аминокислоты. Одним из таких ферментов является aлaнинрацемаза (аланин-рацемаза. КФ 5.1.1.1), катализирующая реакцию:
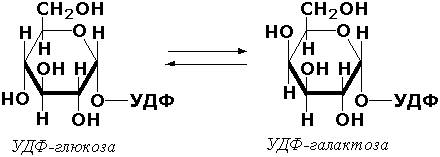
Эпимеразами называются ферменты, действующие на субстраты с несколькими асимметрическими атомами углерода. К таким ферментам относится УДФ-глюкозо-эпимераза (УДФ-глюкоза-4-эпимераза, КФ 5.1.3.2). участвующая в процессах взаимопревращения моносахаридов:
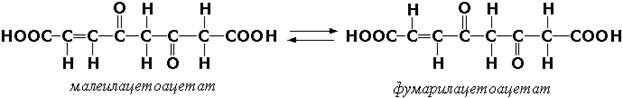
Цис-транс-изомеразы - ферменты, вызывающие изменение геометрической конфигурации относительно двойной связи. Примером такого фермента является малеилацетоацетатизомераза (малеилацетоацетат-цис-транс-изомераза, КФ 5.2.1.2), участвующая в катаболизме фенилаланина и тирозина и переводящая малеилацетоацетат (см. выше реакцию 10) в фумарилацетоацетат:
Внутримолекулярные оксидоредуктазы - изомеразы, катализирующие взаимопревращения альдоз и кетоз. При этом происходит окисление СН-ОН-группы с одновременным восстановлением соседней С=О-группы. Так, триозофосфатизомераза (D-глицеральдегид-3-фосфат-кетол-изомераза, КФ 5.3.1.1) катализирует одну из реакций углеводного обмена:
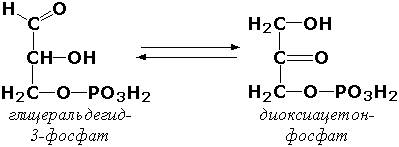
К изомеразам относятся также внутримолекулярные трансферазы, осуществляющие перенос одной группы с одной части молекулы субстрата на другую часть той же молекулы, и внутримолекулярные лиазы, катализирующие реакции дециклизации, а также превращения одного типа кольца в другой.
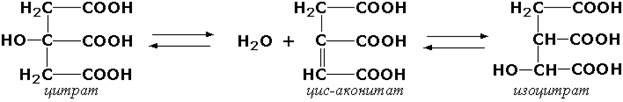
Следует подчеркнуть, что не все биохимические процессы. результатом которых является изомеризация, катализируются изомеразами. Так, изомеризация лимонной кислоты в изопимонную происходит при участии фермента аконитатгидратазы (цитрат (изоцитрат)-гидро-лиаза, КФ 4.2.1.3), катализирующей реакции дегидратации-гидратации с промежуточным образованием цис-аконитовой кислоты:
VI. ЛИГАЗЫ
Лигазы - класс ферментов, катализирующих синтез органических соединений из активированных за счет распада АТФ (или ГТФ, УТФ, ЦТФ) исходных веществ. Для ферментов этого класса сохраняется также тривиальное название синтетазы. В связи с этим, согласно рекомендациям IUBMB, термин "синтетазы" не должен применяться для ферментов, в действии которых не участвуют нуклеозидтрифосфаты. Реакции, катализируемые лигазами (синтетазами), протекают по схеме:
, 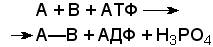
где А и В - взаимодействующие вещества; А—В - вещество, образующееся в результате взаимодействия.
Поскольку в результате действия этих ферментов образуются новые химические связи, подклассы VI класса формируются в зависимости от характера вновь образованных связей.
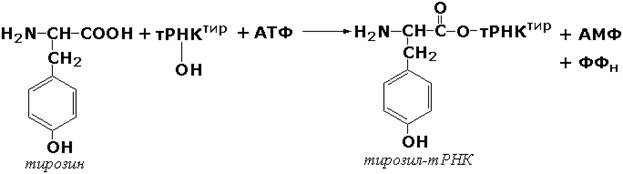
Лигазы, образующие связи углерод-кислород. К ним относится группа ферментов, известных как аминокислота-тРНК-лигазы (аминоацил-тРНК-синтетазы). которые катализируют реакции взаимодействия аминокислот и соответствующих транспортных РНК. В этих реакциях образуются активные формы аминокислот, способные участвовать в процессе синтеза белка на рибосомах. Примером фермента может служить тирозил-тРНК-синтетаза (L-тирозин:тРНК-лигаза (АМФ), КФ 6.1.1.1), участвующая в реакции:
Лигазы, образующие связи углерод-сера. Этот подкласс представлен в первую очередь ферментами, катализирующими образование тиоэфиров жирных кислот с коэнзимом А. При участии этих ферментов синтезируются ацил-КоА - активные формы жирных кислот, способные вступать в различные реакции биосинтеза и распада. Рассмотрим одну из реакций активации жирных кислот, протекающую в присутствии фермента ацил-КоА-синтетазы (карбоновая кислота:коэнзим А-лигаза (АМФ). КФ 6.2.1.2):
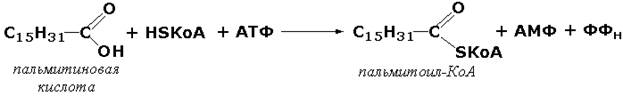
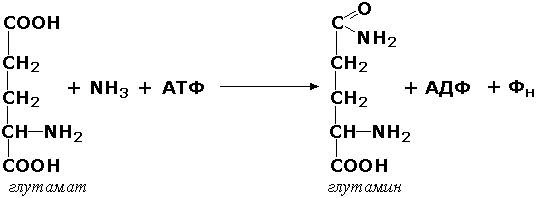
Лигазы, образующие связи углерод-азот, катализируют многочисленные реакции введения азотсодержащих групп в органические соединения. Примером может служить глутаминсинтетаза (L-глутамин:аммиак-γ-лигаза (АДФ), КФ 6.3.1.2). участвующая в обезвреживании токсичного продукта обмена - аммиака - в реакции с глутаминовой кислотой:
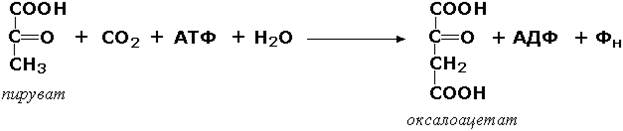
Лигазы, образующие связи углерод-углерод. Из этих ферментов наиболее изучены карбоксилазы, обеспечивающие карбоксилирование ряда соединений, в результате чего происходит удлиннение углеродных цепей. Важнейшим представителем данного класса является пируваткарбоксилаза (пируват:СО2-лигаза (АДФ), КФ 6.4.1.1), ускоряющая реакцию образования оксалоацетата - ключевого соединения цикла трикарбоновых кислот и биосинтеза углеводов:
Напомним, что реакции с участием АТФ катализируются не только ферментами VI класса, но и некоторыми ферментами II класса (фосфотрансферазами или киназами). Важно уметь отличать эти типы реакций. Их различие заключается в том, что в трансферазных реакциях АТФ является донором фосфатных групп, поэтому в результате этих реакцию не происходит выделения Н3РО4 (примеры см. выше). Наоборот, в синтетазных реакциях АТФ служит источником энергии, выделяемой при её гидролизе, поэтому одним из продуктов такой реакции будет являться неорганический орто- или пирофосфат.
Свойства ферментов. Ферменты сочетают в себе свойства катализаторов и свойства, присущие всем остальным белкам.
Как и все белки, ферменты:
состоят из многих сотен аминокислотных остатков, соединённых в определённой последовательности при помощи пептидных связей;
они имеют глобулярную пространственную структуру, определяющую их функциональные возможности;
различаются по молекулярной массе, электрофоретической подвижности,
образуют коллоидные растворы.
Подобно неорганическим катализаторам, ферменты:
не расходуются в процессе реакции,
увеличивают скорость как прямой, так и обратной реакции,
не изменяют положения равновесия.
Белковая природа ферментов обусловливает появление у них ряда свойств, в целом нехарактерных для неорганических катализаторов: олигодинамичность, специфичность, зависимость скорости реакции от температуры, рН среды, концентрации фермента и субстрата, присутствия активаторов и ингибиторов.
Олигодинамичность
Ферменты обладают высокой эффективностью даже в очень небольших количествах. Такая высокая эффективность объясняется тем, что молекулы ферментов в процессе своей каталитической деятельности непрерывно регенерируют. Типичная молекула фермента может регенерировать миллионы раз в минуту. Надо сказать, что и неорганические катализаторы также способны ускорять превращение такого количества веществ, которое во много раз превышает их собственную массу. Но ни один неорганический катализатор не может сравниться с ферментами по эффективности действия.
Примером может служить фермент реннин, вырабатываемый слизистой оболочкой желудка жвачных животных. Одна молекула его за 10 минут при 37°С способна вызывать коагуляцию (створаживание) порядка миллиона молекул казеиногена молока.
Другой пример высокой эффективности ферментов даёт каталаза. Одна молекула этого фермента при 0°С расщепляет за секунду около 50 000 молекул пероксида водорода:
2 Н2О2 2 Н2О + О2
Действие каталазы на пероксид водорода заключается в изменении величины энергии активации этой реакции приблизительно от 75 кДж/моль без катализатора до 21 кДж/моль в присутствии фермента. Если же в качестве катализатора этой реакции используется коллоидная платина, то энергия активации составляет всего 50 кДж/моль.
Специфичность действия ферментов
Важное свойство, отличающее ферменты от неорганических катализаторов – специфичность. Структура активного центра фермента комплементарна структуре его субстрата. Поэтому фермент из всех имеющихся в клетке веществ выбирает и присоединяет только свой субстрат. Для ферментов характерна специфичность не только по отношению к субстрату, но и в отношении пути превращения субстрата.
У ферментов различают абсолютную, относительную и стереохимическую специфичность.
Абсолютная специфичность – избирательная способность фермента катализировать только единственное из возможных превращений одного субстрата. Это можно объяснить конформационной и электростатической комплементарностью молекул субстрата и фермента.
Например, фермент аргиназа катализирует только гидролиз аминокислоты аргинина, фермент уреаза – только расщепление мочевины и не действуют на другие субстраты.
Относительная специфичность – избирательная способность фермента катализировать однотипные превращения сходных по строению субстратов.
Такие ферменты оказывают воздействие на одинаковые функциональные группы или на один и тот же тип связей в молекулах субстратов. Так, например, разные гидролитические ферменты действуют на определённый тип связей:
амилаза – на гликозидные связи;
пепсин и трипсин – на пептидные связи;
липаза и фосфолипаза – на сложноэфирные связи.
Действие этих ферментов распространяется на большое число субстратов, что позволяет организму обойтись малым количеством пищеварительных ферментов - иначе их потребовалось бы намного больше.
Стереохимическая (оптическая) специфичность - избирательная способность фермента катализировать превращение только одного из возможных пространственных изомеров субстрата.
Так, большинство ферментов млекопитающих катализирует превращение толькл L-изомеров аминокислот, но не D-изомеров. ферменты, участвующие в обмене моносахаридов, наоборот, катализируют превращение только D-, но не L-фосфосахаров. Гликозидазы специфичны не только к моносахаридному фрагменту, но и характеру гликозидной связи. Например, α-амилаза расщепляет α–1,4-гликозидные связи в молекуле крахмала, но не действует на α–1,2-гликозидные связи в молекуле сахарозы.
Раздел 2.5
Зависимость скорости ферментативной реакции от концентрации субстрата, температуры и рН среды.
При изучении влияния какого-либо фактора на скорость ферментативной реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальное значение.
Мерой скорости ферментативных реакций служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Изменение скорости проводят на начальной стадии реакции, когда продукт ещё практически отсутствует, и обратная реакция не идёт. Кроме того, на начальной стадии реакции концентрация субстрата соответствует его исходному количеству.
Зависимость скорости ферментативной реакции (V) от концентрации фермента [Е] (рисунок 2.3). При высокой концентрации субстрата (многократно превышающей концентрацию фермента) и при постоянстве других факторовскорость ферментативной реакции пропорциональна концентрации фермента. Поэтому зная скорость реакции, катализируемой ферментом, можно сделать вывод о его количестве в исследуемом материале.
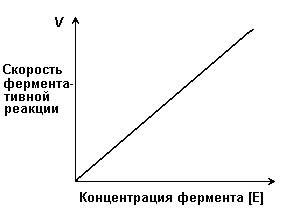
Рисунок 2.3. Зависимость скорости ферментативной реакции от концентрации фермента
Зависимость скорости реакции от концентрации субстрата [S]. График зависимости имеет вид гиперболы (рисунок 2.4). При постоянной концентрации фермента скорость катализируемой реакции возрастает с увеличением концентрации субстрата до максимальной величины Vmax, после чего остаётся постоянной. Это следует объяснить тем, что при высоких концентрациях субстрата все активные центры молекул фермента оказываются связанными с молекулами субстрата. Любое избыточное количество субстрата может соединиться с ферментом лишь после того, как образуется продукт реакции и освободится активный центр.
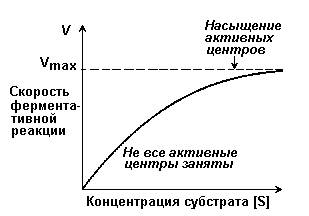
Рисунок 2.4. Зависимость скорости ферментативной реакции от концентрации субстрата.
Зависимость скорости реакции от концентрации субстрата может быть выражена уравнением Михаэлиса — Ментен:
, 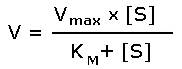
где V — скорость реакции при концентрации субстрата [S] , Vmax —максимальная скорость и KM —константа Михаэлиса.
Константа Михаэлиса равна концентрации субстрата, при которой скорость реакции составляет половину максимальной. Определение KM и Vmax имеет важное практическое значение, так как позволяет количественно описать большинство ферментативных реакций, включая реакции с участием двух и более субстратов. Различные химические вещества, изменяющие активность ферментов, по-разному воздействуют на величины Vmax и KM.
Зависимость скорости реакции от t – температуры, при которой протекает реакция (рисунок 2.5), имеет сложный характер. Значение температуры, при котором скорость реакции максимальна, представляет собой температурный оптимум фермента. Температурный оптимум большинства ферментов организма человека приблизительно равен 40°С. Для большинства ферментов оптимальная температура равна или выше тойц температуры, при которой находятся клетки.
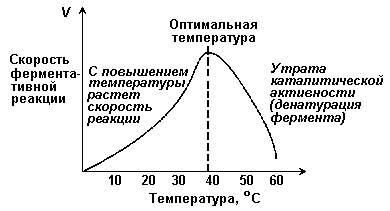
Рисунок 2.5. Зависимость скорости ферментативной реакции от температуры.
При более низких температурах (0° — 40°С) скорость реакции увеличивается с ростом температуры. При повышении температуры на 10°С скорость ферментативной реакции удваивается (температурный коэффициент Q10 равен 2). Повышение скорости реакции объясняется увеличением кинетической энергии молекул. При дальнейшем повышении температуры происходит разрыв связей, поддерживающих вторичную и третичную структуру фермента, то есть тепловая денатурация. Это сопровождается постепенной потерей каталитической активности.
Зависимость скорости реакции от рН среды (рисунок 2.6). При постоянной температуре фермент работает наиболее эффективно в узком интервале рН. Значение рН, при котором скорость реакции максимальна, представляет собой оптимум рН фермента. У большинства ферментов организма человека оптимум рН находится в пределах рН 6 – 8, но есть ферменты, которые активны при значениях рН, лежащих за пределами этого интервала.
Изменение рН как в кислую, так и в щелочную сторону от оптимума приводит к изменению степени ионизации кислых и основных групп аминокислот, входящих в состав фермента (например, СООН-группы аспартата и глутамата, NН2-группы лизина и т.д.). Это вызывает изменение конформации фермента, в результате чего изменяется пространственная структура активного центра и снижение его сродства к субстрату. Кроме того, при экстремальных значениях рН происходит денатурация фермента и его инактивация.
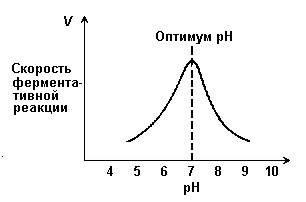
Рисунок 2.6. Зависимость скорости ферментативной реакции от рН среды.
Следует отметить, что свойственный ферменту оптимум рН не всегда совпадает с рН его непосредственного внутриклеточного окружения. Это позволяет предположить, что среда, в которой находится фермент, в какой-то мере регулирует его активность.
Зависимость скорости реакции от присутствия активаторов и ингибиторов. Активаторы повышают скорость ферментативной реакции. Ингибиторы понижают скорость ферментативной реакции.
В качестве активаторов ферментов могут выступать неорганические ионы. Предполагают, что эти ионы заставляют молекулы фермента или субстрата принять конформацию, способствующую образованию фермент-субстратного комплекса. Тем самым увеличивается вероятность взаимодействия фермента и субстрата, а следовательно и скорость реакции, катализируемой ферментом. Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
Раздел 3.2
Особенности структурной организации активного центра фермента.
Каким же образом ферменты повышают скорость химических реакций? Представим себе смесь двух веществ. Реакция между этими веществами возможна, но она не пойдёт без затраты некоторого количества энергии. Энергия, необходимая для того, чтобы заставить вещества вступить в реакцию, называется энергией активации [Ea] (рисунок 3.1). Чем больше необходимая энергия активации, тем ниже скорость реакции при данной температуре.
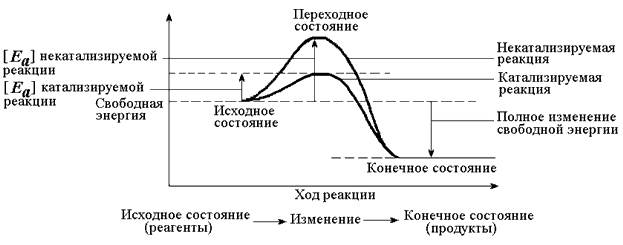
Рисунок 3.1. Энергетические барьеры катализируемой и некатализируемой реакций.
В любой совокупности молекул того или иного вещества индивидуальные молекулы при постоянной температуре сильно различаются по количеству содержащейся в них энергии. Лишь небольшая часть их может преодолеть активационный барьер и вступить в реакцию в отсутствие катализатора. Поэтому скорость реакции в таких условиях будет очень низкой.
Фермент, соединяясь с субстратом, образует короткоживущий фермент-субстратный комплекс (рисунок 3.2), которому соответствует более низкая энергия активация по сравнению с субстратом в некатализируемой реакции; такой энергией обладает уже значительно больше молекул субстрата. По завершении реакции фермент-субстратный комплекс распадается на продукт (или продукты) и фермент. Фермент по окончании реакции остаётся таким же, как был до неё, и может взаимодействовать с новой молекулой субстрата.
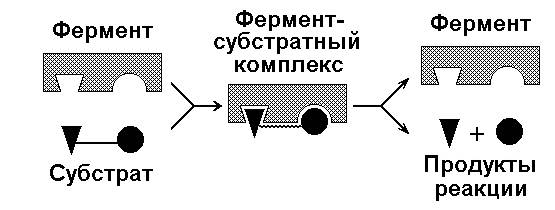
Рисунок 3.2. Образование фермент-субстратного комплекса в ходе катализируемой реакции.
Именно таким образом ферменты снижают энергетический барьер реакции: в их присутствии гораздо большее число молекул вступает в реакцию за единицу времени.
Активный центр фермента
В процессе формирования фермент-субстратного комплекса субстрат присоединяется к специфическому участку на молекуле фермента, который называется активным центром.
Активный центр – участок молекулы фермента, который связывает субстраты и от которого зависит специфичность каталитического действия ферментов; активный центр содержит функциональные группы остатков аминокислот и коферментов, пространственно сближенных и определённым образом ориентированных.
Несмотря на огромное разнообразие структуры ферментов, их специфичности и механизма действия, существует ряд общих закономерностей формирования активных центров.
Во-первых, на активный центр приходится относительно малая часть объёма фермента. Роль остальных аминокислотных остатков, составляющих основную массу фермента, состоит в том, чтобы обеспечить молекуле фермента правильную глобулярную форму.
Во-вторых, активный центр – это сложная трёхмерная структура, и в её образовании принимают участие группы, принадлежащие разным частям линейной последовательности аминокислот. Радикалы аминокислот, образующих активный центр, оказываются вблизи друг от друга в результате формирования третичной структуры белка (рисунок 3.3). Поэтому при воздействии факторов, вызывающих денатурацию (нагревание, концентрированные кислоты и щёлочи) утрачивается конформация активного центра и фермент теряет свою активность.
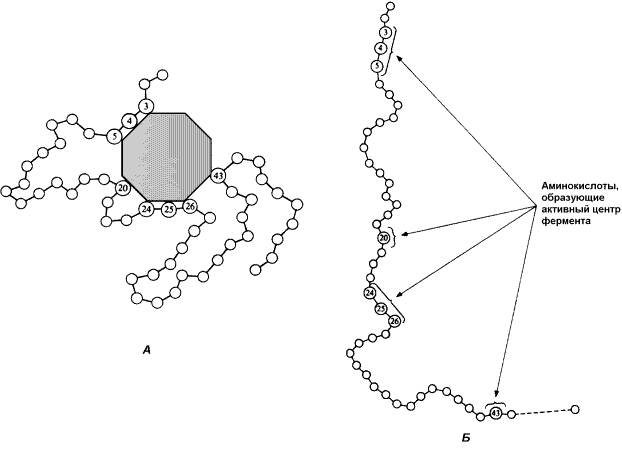
Рисунок 3.3. А. Участие аминокислотных остатков, образующих активный центр фермента, во взаимодействии с субстратом. Б. Положение этих аминокислотных остатков в первичной структуре фермента.
В-третьих, активный центр имеет форму узкого углубления или щели, в которую ограничен доступ воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания субстрата и катализа.
В-четвёртых, в составе активного центра можно условно выделить две части: а) контактный или якорный участок, где происходит связывание субстрата в нужной ориентации; б) каталитический участок, обеспечивающий протекание реакции.
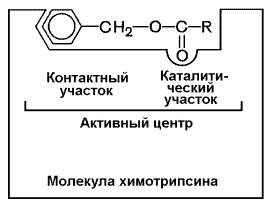
Рисунок 3.4. Состав активного центра фермента (на примере химотрипсина).
В-пятых, субстраты относительно слабо связываются с ферментами. В связывании и превращении субстрата принимают участие следующие группировки аминокислотных радикалов:
полярные заряженные: карбоксильные группы глутамата и аспартата, аминогруппы лизина; гуанидиновые группы аргинина; имидазольные группы гистидина;
полярные незаряженные: гидроксильные группы серина и треонина; сульфгидрильные группы цистеина; фенольные группы тирозина;
неполярные группы: углеводородные цепи алифатических аминокислот; ароматические кольца фенилаланина и триптофана.
У сложных ферментов в формировании активных центров принимают участие также функциональные группы коферментов.
В образовании фермент-субстратных комплексов принимают участие те же молекулярные взаимодействия, что и обеспечивают формирование пространственной структуры макромолекул, межклеточные контакты и другие процессы в биологических системах:
водородные связи между полярными незаряженными группировками субстрата и фермента;
ионные связи между противоположно заряженными группировками субстрата и фермента;
гидрофобные взаимодействия между неполярными группировками субстрата и фермента.
Эти три основных типа нековалентных связей различаются по своей геометрии, энергии, специфичности.
Раздел 3.3
Взаимодействие активного центра с субстратом: модели жёсткого и индуцированного соответствия.
Cпецифичность связывания субстрата с ферментом зависит от строго определённого расположения атомов в активном центре. Субстрат входит в активный центр, если он соответствует ему по форме. Существует две модели, описывающие взаимодействие субстрата с активным центром:
1. Модель жёсткого соответствия («ключ – замок»), предложена Э. Фишером в 1890 году. Активный центр считается заранее подогнанным под форму молекулы субстрата (рисунок 3.5). Эта модель не утратила своего значения для понимания некоторых свойств ферментов, например, их способности к строго определённому связыванию двух или большего числа субстратов или для объяснения кинетики насыщения субстратом.
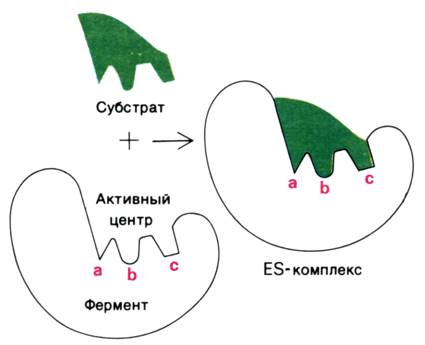
Рисунок 3.5. Взаимодействие субстрата с ферментом согласно модели жёсткого соответствия (Л.Страйер, 1984).
2. Модель индуцированнного соответствия («рука – перчатка»), предложена Кошлендом в 1950-е годы. Согласно этой модели, субстрат вызывает (индуцирует) конформационные изменения фермента, и лишь в результате этих изменений аминокислотные остатки фермента принимают пространственную ориентацию, необходимую для связывания субстрата и катализа (рисунок 3.6). При этом другие аминокислотные остатки могут погрузиться вглубь молекулы фермента.
Дата добавления: 2016-04-02; просмотров: 1888;
