Каталітична очистка газових викидів від оксидів азоту методом відновлення на платиновому каталізаторі
Метод заснований на здатності оксидів азоту відновлюватися до азоту під дією високих температур у присутності рідких, твердих і газоподібних відновників і каталізаторів. Процес розкладання оксидів супроводиться наступними реакціями:
Перша стадія незалежно від роду відновлення:
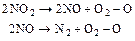 (5.112)
(5.112)
Друга стадія при використанні природного газу:
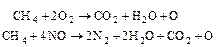 (5.113)
(5.113)
При використанні водню:
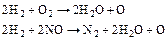 (5.114)
(5.114)
При використанні аміаку:
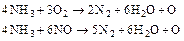 (5.115)
(5.115)
При використанні СО:
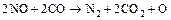 (5.116)
(5.116)
Реакції розкладання оксидів азоту до елементарного азоту зрушуються управо, якщо в газі відсутній кисень, скріплення його протікає по перших реакціях (див. вище). Економічна доцільність процесу каталітичного відновлення оксидів азоту значною мірою залежить від природи вживаного газу-відновника. Як останній переважно використовувати водень, оскільки в цьому випадку реакція йде при нижчих первинних температурах. Цим досягається повніше відновлення оксидів азоту. На практиці в більшості випадків вигідно використовувати природний газ як доступнішу і дешевшу сировину, що володіє високою теплотворною здатністю. Недоліком природного газу є підвищена температура початку реакції (350-450 0С) і високий вміст окислу вуглецю в газах, що відходять. При використанні чистої CO температура початку реакції 250 0С, проте концентрація СО в газах, що відходять, вище, ніж при використанні природного газу. При використанні аміаку відновлення оксидів азоту на деяких типах каталізаторів протікає селективно без участі кисню. Цей метод каталітичного очищення газів може бути застосований для систем з високим вмістом кисню, оскільки його присутність не змінює хід реакції.
До недоліків каталітичних методів очищення газів від оксидів азоту слід віднести велику вартість і дефіцит використовуваних каталізаторів. Крім того, каталітичні методи відновлення прийнятні для систем, у відходах газів яких міститься не більше 0,5 % оксидів азоту, а вміст кисню не перевищує 4-5 % і відсутні з'єднання сірки. Каталітичні методи очищення не дозволяють утилізувати оксиди азоту, що приводить до втрати коштовної хімічної сировини. Проте, завдяки забезпеченню високого ступеню очищення газів каталітичні методи знаходять усе більш широке вживання в промисловості.
Процес з використанням аміаку вигідно відрізняється від високотемпературного тим, що протікає в основному селективно: використовуваний відновник реагує переважно з NOх і майже не взаємодіє з киснем, який знаходиться в нітрозних газах, у зв’язку з чим його витрачають у кількостях, еквівалентних вмісту в знешкоджуваних газах оксидів азоту, перевищуючих стехіометрію на 10-50 %, з метою більш повного протікання наступних екзотермічних реакцій:
6NO + 4NH3 → 5N2 + 6H2O, (5.117)
6NO2 + 8NH3 → 7N2 + 12H2O, (5.118)
8NO + 2NH3 → 5N2O + 3H2O, (5.119)
5NO2 + 2NH3 → 7NO + 3H2O (5.120)
Таким чином, нешкідливі продукти реакцій (азот і вода) є ще однією вигідною відмінністю цього методу. Присутність кисню в газах, що відходять, добре сприяє реалізації каталітичного відновлення, реакції прискорюються, і процес йде таким чином:
4NO + 4NH3 + O2 → 4N2 + 6H2O (5.121)
Селективне каталітичне відновлення відбувається при відносно низьких температурах (180—360 °С) з виділенням невеликих кількостей тепла. Унаслідок цього температура конвертованих газів збільшується в зоні каталізу лише на 10—20 °С.
При надлишку аміаку його основна кількість окисляється присутнім у нітрозних газах киснем за екзотермічною реакцією:
4NH3 + 3O2 → 2N2 + 6H2O (5.122)
Процес досить простий щодо апаратурного оформлення і впроваджений у виробництво азотної кислоти під тиском 0,35 МПа. Нітрозні гази, що відходять, у таких виробництвах містять до 0,2 % (об.) NO + NO2. Технологічна схема процесу представлена на рисунку 5.51.
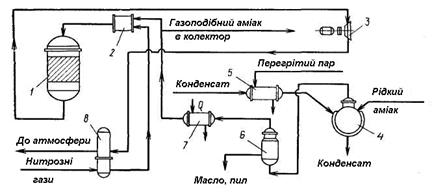
Рисунок 5.51 - Схема установки каталітичного очищення нітрозних газів, що відходять, виробництв азотної кислоти під тиском 0,35 МПа
1 - реактор; 2 — змішувач; 3 — рекупераційна турбіна; 4 — випарник; 5, 7, 8 — підігрівники; 6 — фільтр.
Нітрозні гази при 20—30 оС подають у підігрівник, де їх нагрівають до 240—280 оС і направляють у змішувач. Подаваний в установку рідкий аміак випаровують нагрітим конденсатом. Пари аміаку, що утворяться, при тиску (3,5-3,7) · 105 Па очищають у фільтрі, нагрівають до 120 °С и змішують з нагрітими нітрозними газами, регулюючи відношення NН3 : NOX на рівні (1,2—1,3) : 1. Отриману суміш направляють у реактор, де на алюмо-ванадієвому каталізаторі АВК-Ю йде відновлення оксидів азоту аміаком. Знешкоджені нітрозні гази при 300 оС із реактора з метою часткового використання їхньої енергії подають на рекупераційну турбіну, відкіля їх направляють у підігрівник, після якого при 150—170 °С викидають в атмосферу. При можливому утворенні в системі амонійних солей передбачають періодичну зупинку і пропарювання турбіни насиченою парою низького тиску.
Такий процес забезпечує знешкодження нітрозних газів не менш чим на 96 %. Зміст суми NO і NO2 у знешкоджених газах не перевищує 0,01 % (об.), NH3 — до 0,015 % (об.). При цьому на 1 т азотної кислоти (у розрахунку на 100 % HNO3) витрачають 6,12 кг рідкого аміаку. 16,7-10-3 кг каталізатора, 4,03 кг насиченого водяної пари, 52,3 кг парового конденсату, 1,1-10-4 м3 свіжої води і 9·10-4 кВт-г електроенергії.
Як ефективні каталізатори при відновленні нітрозних газів, що містять 1-30 % NOх, аміаком можуть бути використані цеоліти. Адсорбція на них NH3 і NOX прискорює їхню взаємодію, забезпечуючи при 330—480 °С високу ефективність процесу знешкодження оксидів азоту. Вартість каталізаторів досягає 20—30 % усіх витрат на знешкодження нітрозних газів, тому питанням розробки стійких до отруєнь і дешевих каталізаторів із тривалим терміном експлуатації постійно приділяється велика увага.
Дата добавления: 2016-03-27; просмотров: 1690;
