Производство метанола.
Метанол по значению и объемам производства является одним из важнейших многотоннажных продуктов, выпускаемых современной химической промышленностью.
Области применения: для получения пластических масс, синтетических волокон, синтетического каучука, в качестве растворителя, для микробиологического синтеза и т.д.
Метанол впервые был обнаружен Р. Бойлем в 1661 году в продуктах сухой перегонки древесины (отсюда название метанола – древесный спирт). В чистом виде выделен в 18344 году Ж. Дюма и Э. Пелиго, установившими его формулу.
Промышленное производство метанола из водорода и оксида угдерода (II) впервые было осуществлено в 1923 году и с тех пор непрерывно совершенствуется.
В нашей стране производство метанола впервые организовано в 1934 году в объеме 30 т в сутки на Новомосковском химическом комбинате из водяного газа газификацией кокса.
В качестве сырья для получения метанола могут использоваться: природный газ, синтез-газ производства ацетилена, газы нефтепереработки, твердое топливо.
Твердое топливо сохраняет в качестве сырья определенное значение. Разработка процесса газификации угля с целью получения синтез-газа, содержащего Н2, СО, СО2, может изменить структуру сырьевой базы производства метанола, и неудобный для транспортировки уголь будет превращен в удобный для хранения, транспортировки и использования метанол.
Синтез метанола основан на обратимых реакциях, описываемых уравнениями:
СО + 2Н2 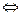 СН3ОН; ΔH = -90,8 кДж (7.4.)
СН3ОН; ΔH = -90,8 кДж (7.4.)
СО2 +3Н2 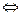 СН3ОН + Н2О; ΔH = -49,6 кДж (7.5.)
СН3ОН + Н2О; ΔH = -49,6 кДж (7.5.)
Реакции (5.4.) и (5.5.) – обратимы, экзотермичны и протекают с уменьшением объема.
С термодинамической точки зрения для смещения равновесия в сторону образования метанола необходимо проводить процесс при низких температурах и высоком давлении. Однако, для увеличения скорости реакции необходимо повышение температуры. При этом выбирая температурный режим, следует учитывать образование побочных продуктов: метана, высших спиртов, кетонов и эфиров.
Приведем некоторые побочные реакции:
СО + 3Н2 = СН4 + Н2О (7.6.)
2СО + 4Н2 = (СН3)2О + Н2О (7.7.)
4СО + 8Н2 = С4Н9ОН + 3Н2О (7.8.)
2СО = СО2 + С (7.9.)
т.е. процесс получения метанола является сложным.
Побочные реакции обуславливают бесполезный расход синтез-газа и удорожают очистку метанола.
Применяемый для синтеза метанола катализатор должен обладать высокой селективностью, т.е. максимально ускорять образование метанола при одновременном подавлении побочных реакций. Для синтеза метанола предложено много катализаторов. Лучшими оказались катализаторы, основными компонентами которых являются оксид цинка или медь.
Катализаторы синтеза метанола весьма чувствительны к каталитическим ядам, поэтому первой стадией процесса является очистка газа от сернистых соединений. Сернистые соединения отравляют цинк-хромовые катализаторы обратимо, а медьсодержащие катализаторы – необратимо. Необходима также тщательная очистка газа от карбонила железа, который образуется в результате взаимодействия оксида углерода с железом аппаратуры. На катализаторе карбонил железа разлагается с выделением элементного железа, что способствует образованию метана.
Процесс получения метанола осуществляется либо на цинк-хромовом катализаторе при давлении 30 МПа, либо на низкотемпературном медьсодержащем катализаторе при давлении 5 МПа.
Цинк-хромовый катализатор работает в области температур 370-3900С, медьсодержащий – 220-2800С.
Таким образом, процесс получения метанола является гетерогенно-каталитическим. Лимитирующая стадия – адсорбция водорода на поверхности катализатора.
Для смещения равновесия реакции вправо процесс проводят с избытком водорода, при следующем соотношении исходных компонентов- Н2: СО= 2,15-2,30. Кроме того, водород ускоряет процесс, обладая высокой теплопроводностью, позволяет проводить процесс в узком температурном интервале, гидрирует продукты уплотнения на катализаторе, чем повышает срок его службы.
С возрастанием объемной скорости газа выход метанола падает. Такая закономерность основана на том, что с увеличением объемной скорости уменьшается время контакта газа с катализатором и, следовательно, концентрация метанола в газе, выходящем из реактора.
С увеличением объемной скорости подачи сырья содержание метанола в газе снижается, однако за счет большего объема газа, проходящего в единицу времени через тот же объем катализатора, производительность последнего увеличивается. На практике процесс синтеза метанола осуществляют при объемных скоростях 20 000-40 000 ч-1. Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержится только –4% метанола.
С целью возможно более полной переработки синтез-газа необходимо его возвращение в цикл после выделения метанола и воды.
При циркуляции в синтез-газе накапливаются инертные примеси, что приводит к снижению давления в системе и повлечет за собой снижение выхода и скорости процесса. Поэтому концентрацию инертных примесей регулируют частичной отдувкой циркуляционного газа. Отдувка проводится с таким расчетом, чтобы количество инертов, поступающих со свежем синтез-газом, было равно количеству инертов, удаляемых с отдувкой.
Дата добавления: 2016-03-27; просмотров: 952;
