Состав природных газов
Природные газы, добываемые' из газовых, газоконденсатных и нефтяных месторождений, состоят из углеводородных компонентов (СН4 - С22Н46), а также неуглеводородных компонентов (H2S, N2, СО, С02, Аг, Н2, Не).
При нормальных и стандартных условиях в газообразном состоянии бывают только углеводороды C1-C4. Углеводороды С5 и выше в нормальных условиях находятся в жидком состоянии.
Газы добываемые из чисто газовых месторождений, содержат более 95% метана (табл 3.1).
Химический состав газа газовых месторождений, об. %
Таблица 3.1
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | N2 | СО2 | Относит, плотность |
| Северо-Ставропольское | 98.9 | 0,29 | 0,16 | 0,05 | - - | 0,4 | 0,2 | 0,56 |
| Уренгойское | 98,84 | 0,1 | 0,03 | 0,02 | 0,01 | 1.7 | 0,3 | 0,56 |
| Шатлыкское | 95,58 | 1,99 | 0,35 | 0,1 | 0,05 | 0,78 | 1,15 | 0,58 |
| Медвежье | 98,78 | 0,1 | 0,02 | - | - | 1,0 | 0.1 | 0,56 |
Содержание метана на газоконденсатных месторождениях - 75-95% (табл. 3.2).
Химический состав газа газоконденсатных месторождений, об. %
Таблица 3.2
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | N2 | СО2 | Относит, плотность |
| Вуктыльское | 74,80 | 7,70 | 3,90 | 1,80 | 6,40 | 4,30 | 0,10 | 0,882 |
| Оренбургское | 84,00 | 5,00 | 1,60 | 0,70 | 1,80 | 3,5 | 0,5 | 0,680 |
| Ямбургское | 89,67 | 4,39 | 1,64 | 0,74 | 2,36 | 0,26 , | 0,94 | 0,713 |
| Уренгойское | 88,28 | 5,29 | 2,42 | 1,00 | 2,52 | 0,48 | 0,01 | 0,707 |
Газы, добываемые вместе с нефтью (попутный газ) представляют собой смесь метана, этана, пропан-бутановой фракции (сжиженного газа) и газового бензина. Содержание метана - около 35-85%. Содержание тяжёлых углеводородов в попутном газе 20-40%, реже - до 60% (табл. 3.3).
Химический состав газа нефтяных месторождений (попутного газа), об. %
Таблица 3.2
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | N2 | СО2 | Относит, плотность |
| Бавлинское | 35,0 | 20,7 | 19,9 | 9,8 | 5,8 | 8,4 | 0,4 | 1,181 |
| Ромашкинское | 19,1 | 17,8 | 8,0 | 6,8 | 8,0 | 1,5 | 1,125 | |
| Самотлорское | 53,4 | 7,2 | 15,1 | 8,3 | 6,3 | 9,6 | 0,1 | 1,010 |
| Узеньское | 50,2 | 20,2 | 16,8 | 7,7 | 3,0 | 2,3 | - | 1,010 |
Тяжёлым нефтям свойственны сухие нефтяные газы (с преобладанием метана).
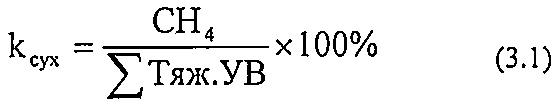
Под тяжелыми УВ понимаются углеводороды от этана (С2Н6) и выше.
Лёгким нефтям свойственны жирные газы:

3.1.2. Физико-химические свойства углеводородных газов
Нефтяной газ при нормальных условиях - неполярная, аддитивная система (смесь компонентов от C1 до С4). Следовательно, к нему при нормальных условиях применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
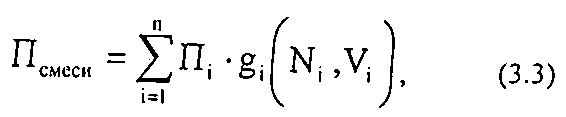
где gi - весовая доля;
Нi - мольная доля;
Vi - объёмная доля;
Пi- параметр i-гo компонента.
Плотность смеси газов рассчитывается следующим образом:
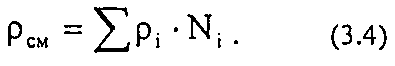
При нормальных условиях плотность газа рг = Мi/ 22,414.
Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств необходимо знать, как выражается состав смеси.
Массовая доля (gi) - отношение массы i-гo компонента, содержащегося в системе к общей массе системы:
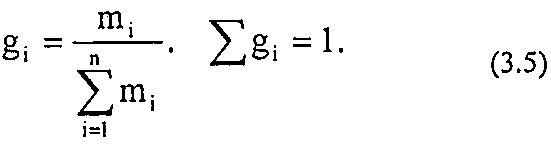
Молярная (мольная) доля (Ni) - отношение числа молей i-гo компонента к общему числу молей в системе:
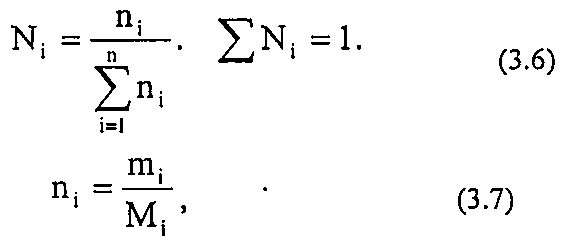
Где mi - масса i-го компонента;
Mi - молекулярный вес.
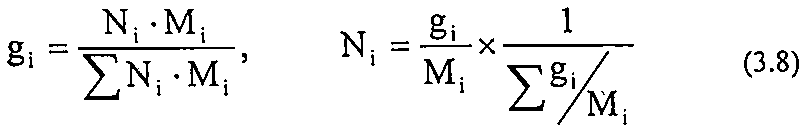
Объемная доля(Vi) - доля, которую занимает компонент в объёме системы.

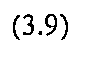
Для идеального газа соблюдается соотношение Vi = Ni.
Молекулярная масса смеси рассчитывается следующим образом:
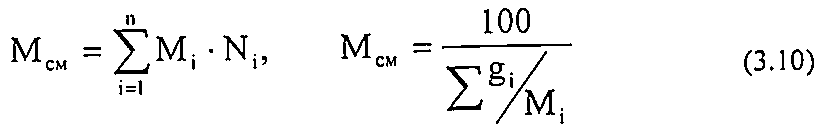
Относительная плотность газа по воздуху:
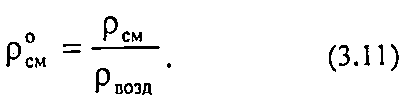
Для нормальных условий рOсм ≈1,293; для стандартных условий рOсм≈ 1,205.
Если плотность газа задана при атмосферном давлении (0,1013 МПа), то пересчёт её на другое давление (при той же температуре) для идеального газа производится по формуле:

Смеси идеальных газов характеризуются аддитивностью парциальных давлений и парциальных объёмов.
Для идеальных газов давление смеси равно сумме парциальных давлений компонентов (закон Дальтона):
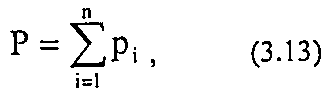
где Р - давление смеси газов;
рi - парциальное давление i-гo компонента в смеси,
или

Т. е. парциальное давление газа в смеси равно произведению его молярной доли в смеси на общее давление смеси газов.
Аддитивность парциальных объёмов компонентов газовой смеси выражается законом Амага:

где V - объём смеси газов;
Vi - объём i-гo компонента в смеси.

Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами описывающими изменение состояние вещества. В качестве таких параметров используется давление, температура, объём.
Состояние газа при стандартных условиях характеризуется уравнением Менделеева-Клайперона:

где Р- абсолютное давление, Па;
V - объём, м3;
Q - количество вещества, кмоль;
Т - абсолютная температура, К;
R-универсальная газовая постоянная Па*м3/(кмоль-град).
У этого уравнения есть свои граничные условия. Оно справедливо для идеальных газов при нормальном (1 атм.) и близких к нормальному давлениях (10-12 атм.)
При повышенном давлении газ сжимается. За счёт направленности связи С-Н происходит перераспределение электронной плотности, и молекулы газов начинают притягиваться друг к другу.
Для учёта этого взаимодействия в уравнение (3.18) вводится коэффициент сверхсжимаемости z, предложенный голландским физиком Ван-дер-Ваальсом, показывающий отклонения реального газа от идеального состояния:

где Q количество вещества, моль.
Физический смысл коэффициента сверхсжимаемости заключается в выражении граничных условий уравнения Клайперона-Менделеева для высоких давлений.
Коэффициент z зависит от давления и температуры, природы газа (критических давлений и температуры).
Критическое давление - давление, при котором газообразный углеводород переходит в жидкое состояние.
Критическая температура - температура, при которой жидкий углеводород переходит в газообразное состояние.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа отклоняются от критических:
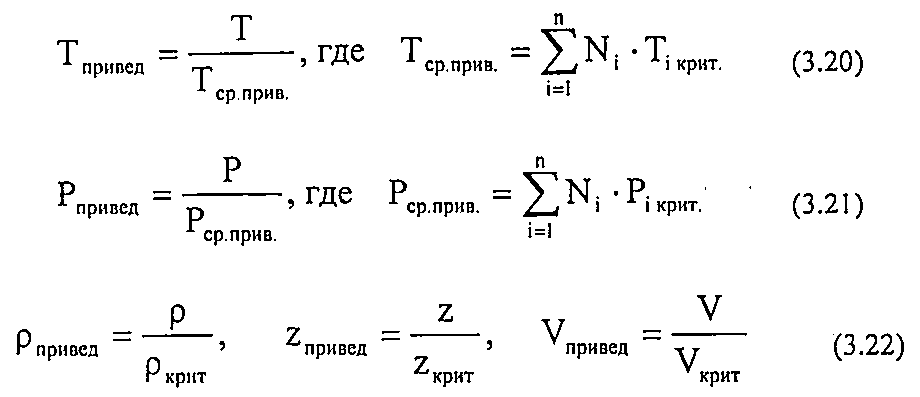
Существуют графики, эмпирические формулы и зависимости для оценки коэффициента сверхсжимаемости от приведенных давлений и приведенных температур.
Зная коэффициент сверхсжимаемости, можно найти объём газа в пластовых условиях по закону Бойля-Мариотта:
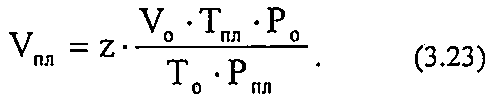
Объёмный коэффициент газа используется при пересчёте объёма газа в нормальных условиях на пластовые условия и наоборот (например, при подсчёте запасов):
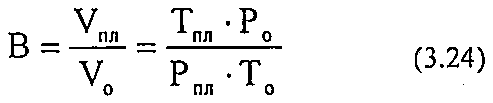
Вязкость газа - свойство газа оказывать сопротивление перемещению одной части газа относительно другой.
Различают динамическую вязкость µ. и кинематическую вязкость v. Кинематическая вязкость учитывает влияние силы тяжести.
Динамическая вязкость зависит от средней длины пробега молекул газа и от средней скорости движения молекул газа:
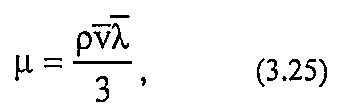
где ρ - плотность газа;
λ - средняя длина пробега молекулы;
v - средняя скорость молекул.
Кинематическая вязкость природного газа при нормальных условиях невелика и не превышает 0,01 сантипуаза.
Динамическая вязкость газа увеличивается с ростом температуры (при повышении температуры увеличивается средняя скорость и длина пробега молекул), однако при давлении более 3 МПа вязкость с ростом температуры начинает снижаться. От давления вязкость газа практически не зависит (снижение скорости и длинны пробега молекул при увеличении давления компенсируется ростом плотности).
3.1.3;Растворимость газов в нефти и воде
От количества растворённого в пластовой нефти газа зависят все её важнейшие свойства: вязкость, сжимаемость, термическое расширение, плотность и •д.
Распределение компонентов нефтяного газа между жидкой и газообразной фазами определяется закономерностями процессов растворения. Способность газа растворятся в нефти и воде имеет большое значение на всех этапах разработки месторождений от добычи нефти до процессов подготовки и транспортировки.
Процесс растворения для идеального газа при небольших давлениях и температурах описывается законом Генри:

где Vж - объём жидкости-растворителя;
а - коэффициент растворимости газа;
Vr - количество газа, растворённого при данной температуре;
Р - давление газа над поверхностью жидкости
К - константа Генри (К=f(a)).
Коэффициент растворимости газа а показывает, какое количество газа растворяется в единице объёма жидкости при данном давлении:
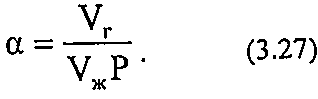
Коэффициент растворимости зависит от природы газа и жидкости, давления, температуры.
Минимальное давление, при котором весь газ растворяется в жидкости (т.е. переходит в жидкое состояние), называется давлением насыщения.
Если пластовое давление меньше давления насыщения, то часть газа находится в свободном состоянии (залежь имеет газовую шапку). Если пластовое давление больше давления насыщения, то говорят, что нефть "недонасыщена" газом и весь газ растворён в нефти.
Природа воды и углеводородов различается, а, следовательно, углеводородная составляющая нефтяного газа растворяется в воде хуже, чем в нефти.
Неуглеводородные компоненты нефтяного газа, такие как СО, СО2, H2S, N2 растворяются в воде лучше. Например, пластовая вода сеноманского горизонта очень газирована (5 м3 газа СО и С02 на 1 т воды).
С повышением давления растворимость газа растёт, а с повышением температуры - падает. Растворимость газа зависит также от минерализации воды.
Разные компоненты нефтяного газа обладают разной способностью растворятся в жидкостях, причём с увеличением молекулярной массы газового компонента растёт коэффициент растворимости.
Количество выделившегося из нефти газа зависит не только от содержания газа в нефти, но и от способа дегазирования. Различают контактное разгазирование, когда выделившийся газ находится в контакте с нефтью, и дифференциальное разгазирование, когда выделившийся из нефти газ непрерывно отводится из системы.
Строгое соблюдение условий дифференциального дегазирования затруднено, поэтому используется многократное (ступенчатое) дегазирование.
В процессе добычи нефти встречаются оба способа дегазирования. В начальные периоды снижения давления от давления насыщения, когда газ ещё неподвижен относительно нефти, происходит контактное разгазирование. В последующий период, по мере выделения газа из нефти, газ быстрее движется к забою скважины и происходит дифференциальное разгазирование.
Коэффициент разгазирования - количество газа, выделившегося из единицы объёма нефти при снижении давления на единицу.
При движении газа по пласту наблюдается т.н. дроссельный эффект -уменьшение давления газового потока при его движении через сужения в каналах. При этом наблюдается изменение температуры. Интенсивность изменения температуры при изменении давления характеризуется коэффициентом Джоуля-Томсона:

где ΔТ - изменение температуры:
а - коэффициент Джоуля-Томсона (зависит от природы газа, давления,
температуры);
ΔР - изменение давления.
Дата добавления: 2016-03-22; просмотров: 1327;
