Тема 8 Ионное произведение воды и РН растворов кислот и оснований
Ионное произведение воды – константа равная произведению концентраций протонов и гидроксид-ионов КН2О =[H+][OH-]
Вода – слабый электролит и диссоциирует на ионы в малой степени по реакции: H2O ↔ H+ + OH Kдисс воды=[H+][OH-])/[H2O] = 1,8 • 10-16 (при 22°С)
Концентрацию недиссоциированных молекул [H2O] можно считать постоянной и в 1 л (1000 г) воды содержится
[H2O] =n=mH2O /МH2O=1000/18 = 55,56 молей
Тогда ионное произведение КН2О =[H+][OH-]=Kдисс*H2O] = 1,8*10*16·55,56=10-14
В дистилированной воде [H+][OH-]=10-7
Чаще пользуются значениями не самих концентраций, а их десятичными логарифмами, взятыми с обратными знаком (отрицательными логарифмами).
рОН= –lg[OH] гидроксильный показатель,
рН= – lg[H+] – водородный показатель; характеристика кислотности среды
тогда pH +рОН=–lg КН2О pH +рОН=14 В дистиллированной воде pH =рОН =–lg 10-7=7
Кислотность среды (раствора) определяют индикаторами.
Таблица 6
Зависимость окраски индикаторов от соотношения концентрации [H+] и [OH-]
| Среда | |||
| Кислая | Нейтральная | Щелочная | |
| Концентрация ионов | [H+]>[OH-] | [H+]=[OH-] | [OH]>[H+] |
| Величина рН | рН<7 | рН=7 | рН>7 |
| Величина рОН | рОН>7 | рОН=7 | рОН<7 |
| Лакмус | красный | фиолетовый | синий |
| фенолфталеин | бесцветный | бесцветный | малиновый |
| метилоранж | розовый | оранжевый | желтый |
Пример 1Вычислите концентрации ионов Н+ и ОН- и pH раствора едкого кали КОН, молярность которого составляет 0,01 моль/л (принять α = 1) .
РешениеДля расчета используем выражения ионного произведения воды и рН. Величина α=1 означает, что в растворе все молекулы КОН находятся в состоянии диссоциации, т.е.
[ОН–] = [К+] = [КОН] = 0,01 = 10-2моль/л
рОН = =-lg [ОН–]==-lg 10-2= 2, pH = 14–рОН = 14–2 = 12
Задание 8-1 контрольной работы
Рассчитайте концентрации ионов Н+ и ОН– и рН раствора сильной кислоты или сильного основания, V мл которого содержит m г кислоты или основания ( 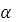 = 1).
= 1).
| Номер задания | Соеди-нение | V, мл | m, г | Номер задания | Соеди-нение | V, мл | m, г |
| HCl | 1,46 | HI | 0,0256 | ||||
| HCl | 0,365 | HBr | 1,62 | ||||
| HCl | 0,73 | HBr | 0,81 | ||||
| HCl | 0,365 | HBr | 0,81 | ||||
| NaOH | 0,04 | HBr | 0,162 | ||||
| NaOH | 0,02 | NaOH | 0,2 | ||||
| NaOH | 0,1 | NaOH | 0,4 | ||||
| NaOH | 0,40 | NaOH | 0,8 | ||||
| KOH | 0,56 | NaOH | 6,0 | ||||
| KOH | 0,112 | KOH | 8,4 | ||||
| KOH | 0,112 | KOH | 2,8 | ||||
| KOH | 1,12 | KOH | 1,68 | ||||
| HI | 2,56 | KOH | 0,28 | ||||
| HI | 0,256 | HCl | 1,46 | ||||
| HI | 1,28 | HCl | 0,73 |
Пример 3 Сравните концентрацию ионов Н+ в растворах уксусной кислоты Кдис =1,74·10–5 и соляной кислоты (α=0,8), концентрация которых См=1моль/л.
Решение
В растворе уксусной кислоты, равновесие процесса диссоциации сдвинуто в сторону недиссоциированных молекул:

 СН3СООН H+ + Н3СОО– , СH+ = √(1,7*10-5*1) =4,17*103моль/л.
СН3СООН H+ + Н3СОО– , СH+ = √(1,7*10-5*1) =4,17*103моль/л.
В растворе соляной кислоты равновесие диссоциации сдвинуто в сторону продуктов диссоциации, на ионы диссоциировано 80% молекул (α=0,8):
 HCl H+ + Cl– , СH+= α·Ск-ты = 0,8·1= 0,8 моль/л.
HCl H+ + Cl– , СH+= α·Ск-ты = 0,8·1= 0,8 моль/л.
0,8/4,17 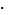 10-3= 800/4,17=192, т.е. концентрация ионов в растворе соляной кислоты почти в 200 раз выше, чем в растворе уксусной кислоты.
10-3= 800/4,17=192, т.е. концентрация ионов в растворе соляной кислоты почти в 200 раз выше, чем в растворе уксусной кислоты.
Дата добавления: 2016-03-15; просмотров: 1395;
