Гипофункция коры надпочечников
Термин «гипофункция коры надпочечников» объединяет все состояния, при которых секреция стероидных гормонов надпочечников оказывается ниже потребностей организма в ней. Надпочечниковую недостаточность можно разделить на две большие категории:
1) связанную с первичной неспособностью надпочечников вырабатывать достаточные количества гормонов и 2) связанную с вторичной недостаточностью, обусловленной малой продукцией АКТГ (табл. 325-9).
Первичная недостаточность коры надпочечников (аддисонова болезнь). Описанные Аддисоном симптомы — «общее недомогание и упадок сил, выраженная слабость сердечной деятельности, раздражение желудка и своеобразное изменение цвета кожи» суммируют основные клинические проявления заболевания. В далеко зашедших случаях диагноз
Таблица 325-9. Классификация недостаточности надпочечников
I. Первичная недостаточность надпочечников
Анатомическая деструкция желез (хроническая или острая) «Идиопатическая» атрофия (аутоиммунная) Хирургическое удаление Инфекции (туберкулез, грибковые) Кровоизлияние Метастазы из других тканей Метаболические нарушения в продукции гормонов Врожденная гиперплазия надпочечников Введение ингибиторов ферментов (метопирон) Действие цитотоксических агентов (хлодитан)
II. Вторичная недостаточность надпочечников
Гипопитуитаризм вследствие гипоталамо-гипофизарной патологии Подавление гипоталамо-гипофизарной оси Введение экзогенных стероидов Избыток эндогенных стероидов, продуцируемых опухолью обычно установить легко, но распознавание болезни на ее ранних стадиях может представлять реальные трудности.
Распространенность. Первичная недостаточность коры надпочечников встречается сравнительно редко. Она может возникать в любом возрасте и с равной частотой поражает представителей обоего пола. Из-за все увеличивающегося применения экзогенных стероидов в лечебных целях вторичная надпочечниковая недостаточность развивается относительно часто.
Этиология и патогенез. Аддисонова болезнь обусловливается прогрессирующей деструкцией коры надпочечников, которая может захватывать более 90% ткани железы, прежде чем появятся признаки надпочечниковой недостаточности. В надпочечниках часто локализуются хронические гранулематозные процессы, особенно туберкулез, а также гистиоплазмоз, кокцидиоидоз и криптококкоз. В предыдущие годы при посмертном исследовании в 70—90% случаев находили туберкулез. Однако в настоящее время чаще всего обнаруживается идиопатическая атрофия, в основе которой лежит, вероятно, аутоиммунный механизм. Реже встречаются другие повреждения, такие как двусторонние опухолевые метастазы, амилоидоз или саркоидоз.
Возможность аутоиммунной природы первичной недостаточности надпочечников подтверждается данными о том, что у половины больных в крови присутствуют антитела к ткани надпочечников. У некоторых больных в крови имеются и антитела к ткани щитовидной, околощитовидных желез и/или гонад (см. также гл. 334). При идиопатической недостаточности надпочечников нарушается и клеточный иммунитет. Например, у больных с недавно начавшейся аддисоновой болезнью описана экспрессия 1а (связанного с иммунной реакцией) — антигена на Т-лимфоцитах, что отражает, вероятно, активацию иммунной системы. Среди больных с идиопатической недостаточностью надпочечников чаще, чем в общей популяции, встречаются хронический лимфоцитарный тиреоидит (болезнь Хашимото), преждевременная недостаточность яичников, сахарный диабет I типа, болезнь Грейвса и первичный гипопаратиреоз. Сочетание двух или более из этих аутоиммунных эндокринных заболеваний у одного и того же человека формирует полигландулярный эндокринный синдром II типа. Кроме того, у таких больных встречаются пернициозная анемия, витилиго, алопеция, спру (нетропического типа) и злокачественная миастения. Многие поколения в пределах одной семьи страдают одним или несколькими из перечисленных заболеваний. Наследование заболеваний, формирующих полигландулярный синдром II типа, ассоциируется с аллелями HLA B8 и DR3.
Сочетание недостаточности околощитовидных желез и надпочечников с хроническим кандидозом слизистых оболочек и кожи формирует другой семейный синдром (полиглан-дулярный эндокринный синдром I типа). Среди таких больных в большей степени распространены также и другие аутоиммунные заболевания (например, пернициозная анемия, хронический активный гепатит, тиреоидная патология, алопеция и преждевременная недостаточность половых желез). Ассоциация с антигенами HLA отсутствует; этот синдром наследуется как аутосомно-рецессивный признак, часто проявляясь у многих сиблингов одной семьи. Синдром I типа проявляется обычно в детстве, тогда как максимальная частота экспрессии синдрома II типа приходится на возраст 20—60 лет. Механизмы взаимодействия генетической предрасположенности и/или аутоимунности в патогенезе этого патологического состояния неизвестны.
Клинические признаки и симптомы. Недостаточность коры надпочечников характеризуется незаметным началом и медленным нарастанием утомляемости, мышечной слабостью, анорексией, тошнотой и рвотой, снижением массы тела, пигментацией кожи и слизистых оболочек, гипотензией и иногда гипогликемией (табл. 325-10). Однако в зависимости от продолжительности и выраженности гипофункции надпочечников спектр симптомов может варьировать от жалоб на легкую хроническую утомляемость до явного шока, связанного с острой массивной деструкцией надпочечных желез, как при синдроме, описанном Уотерхаусом и Фридериксеном.
Кардинальным симптомом является астения. Вначале она может быть спорадической, проявляющейся в основном в периоды стрессов, но по мере дальнейшего нарушения функции надпочечников слабость нарастает, пока больной не оказывается инвалидом, вынужденным постоянно оставаться в постели.
Очень ярким признаком может быть гиперпигментация, но ее отсутствие не исключает диагноза аддисоновой болезни. Она часто принимает вид диффузного коричневого, рыжего или бронзового потемнения как открытых, так и закрытых частей тела, таких как локти или кожные складки на руках, а также и в норме пигментированных участков, таких как ареолы вокруг сосков. На слизистых оболочках могут появляться синевато-черные
Таблица 325-10. Частота симптомов и признаков при аддисоновой болезни,%
| Слабость | Боли в животе | ||
| Пигментация кожи | Потребность в соли | ||
| Пигментация слизистых оболочек | Понос | ||
| Снижение массы тела | Запоры | ||
| Анорексия, тошнота и рвота | Обмороки | ||
| Гипотензия (менее 110/70 мм рт.ст.) | Витилиго |
пятна. У некоторых больных появляются темные веснушки, а иногда образуются парадоксальные неправильной формы пятна витилиго. В качестве раннего признака больные могут отмечать необычную сохранность загара после пребывания на солнце.
Часто встречается артериальная гипотензия, ав тяжелых случаях артериальное давление может падать до 80/50 мм рт. ст. и ниже. При переходе больного в вертикальное положение гипотензия обычно усиливается.
Больные нередко предъявляют жалобы на нарушения функции желудочно-кишечного тракта. Симптомы могут варьировать от легкой анорексии с похуданием до изнуряющей тошноты, рвоты, поноса и разлитых болей в области живота, которые иногда достигают такой силы, что могут быть приняты за симптом острого живота. Кроме того, у больных с недостаточностью надпочечников часто отмечаются выраженные изменения личности, обычно в форме повышенной раздражимости и беспокойства. Нередко обостряются чувства вкуса, обоняния и слуха, нормализующиеся при лечении. У женщин из-за выпадения продукции надпочечниковых андрогенов часто уменьшается оволосение подмышечных впадин и лобка.
Лабораторные данные. При сравнительно легких формах заболевания даже лабораторные показатели могут находиться в пределах нормы; результаты определения уровней стероидов в плазме и моче, хотя и несколько снижены, но не выходят за пределы нормальных колебаний. Однако при оценке реакции надпочечников на стимуляцию АКТГ даже на этой стадии заболевания обнаруживаются нарушения. В более далеко зашедших случаях снижается содержание в сыворотке натрия, хлорида и бикарбоната, тогда как уровень калия возрастает. Гипонатриемия обусловливается как потерей натрия с мочой (из-за дефицита альдостерона), так и его перемещением во внутриклеточное пространство. Такие потери натрия из внесосудистого пространства уменьшают объем последнего и усиливают гипотензию. В развитии гипонатриемии может играть роль повышение уровней вазопрессина и ангиотензина II в плазме, что нарушает клиренс свободной воды. К гиперкалиемии приводит сочетание ряда факторов, включая дефицит альдостерона, нарушение фильтрации в клубочках и ацидоз. У 10—20% больных развивается легкая или умеренная гиперкальциемия. Причина этого остается неясной. На электрограмме могут выявляться неспецифические изменения, а при электроэнцефалографии — генерализованное снижение и замедление волновой активности. Развиваются нормоцитарная анемия, относительный лимфоцитоз и обычно умеренная эозинофилия.
Диагностика. Диагноз недостаточности надпочечников следует устанавливать только с помощью стимуляционного теста с АКТГ, позволяющего оценить резервную способность коры надпочечников продуцировать стероиды (детали теста с АКТГ— см. выше). При тяжелой недостаточности надпочечников скорость секреции кортизола резко снижена, о чем косвенно свидетельствует низкое содержание или полное отсутствие кортизола, 17-гидроксикортикоидов и 17-кетостероидов в суточной моче. При легкой и умеренной недостаточности надпочечников экскреция стероидов с мочой может находиться в пределах нормы. Поэтому диагноз надпочечниковой недостаточности нельзя исключать только на основании нормального уровня стероидов в моче в базальных условиях. Содержание кортизола в плазме колеблется от нуля до нижней границы нормы. Секреция альдостерона обычно снижена, что приводит к потере соли и вторичному повышению уровня ренина в плазме. При первичной недостаточности надпочечников концентрация АКТГ и родственных пептидов в плазме возрастает, так как
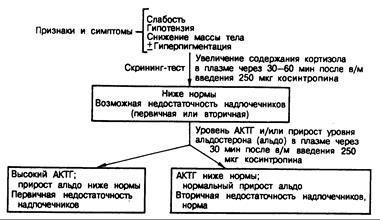
Рис. 325-11. Диагностическая схема, применяемая при обследовании больных с подозрением на недостаточность надпочечников.
При вторичной недостаточности надпочечников уровень АКТГ в плазме крови снижен. При недостаточности надпочечников, обусловленной опухолями гипофиза или идиопатическим пангипопитуитаризмом, отмечается дефицит и других гипофизарных гормонов. С другой стороны, недостаточность АКТГ может быть изолированной, как это имеет место после длительного применения экзогенных глюкокортикоидов.
Поскольку результаты отдельных определений уровней гормонов в ходе этих скрининг-тестов могут оказаться сомнительными, диагноз всегда следует подтверждать результатами непрерывной инфузии АКТГ в течение 24 ч. Здоровых лиц и больных с вторичной недостаточностью надпочечников можно различить по результатам теста толерантности к инсулину или теста с метопироном. исчезает обычная петля обратной связи в системе кортизол — гипоталамус — гипофиз. При вторичной же недостаточности уровни АКТГ в плазме снижены или «неадекватно» нормальны (рис. 325-11).
Дифференциальная диагностика. В силу распространенности таких жалоб, как слабость и утомляемость, клиническая диагностика ранних стадий недостаточности надпочечников часто затруднена. Однако легкие нарушения со стороны желудочно-кишечного тракта с уменьшением массы тела, анорексией и подозрением на усиленную пигментацию оправдывают проведение стимуляционного теста с АКТГ для исключения недостаточности надпочечников, особенно до начала стероидной терапии. Снижение массы тела помогает оценить значение слабости и недомогания. Увеличение массы тела в сочетании с утомляемостью более характерно для депрессивных синдромов. Трудности могут возникать в связи с расовыми особенностями пигментации у многих больных, но пациенты с аддисоновой болезнью отмечают, что пигментация у них появилась недавно и интенсивность ее нарастает. Гиперпигментацией сопровождаются и другие заболевания, но аддисонова болезнь характеризуется своеобразным цветом и распределением пигмента. В сомнительных случаях определяют уровень АКТГ и проводят оценку надпочечниковых резервов.
Лечение. Все больные с аддисоновой болезнью должны получать специфическую заместительную терапию гормонами. Подобно больным диабетом, эти лица нуждаются в тщательном и постоянном обучении по вопросам своего заболевания. Поскольку надпочечные железы вырабатывают гормоны трех основных классов, два из которых — глюкокортикоиды и минералокортикоиды — имеют особое клиническое значение, заместительная терапия должна предусматривать коррекцию обоих дефицитов. Краеугольным камнем лечения служит кортизон (или кортизол). Дозы кортизона варьируют от 12,5 до 50 мг в день, причем большинство больных получают 25—37,5 мг в дробных дозах. Применяют также кортизол (30 мг в день) или преднизолон (7,5 мг в день) в дробных дозах. Учитывая действие стероидов на слизистую оболочку желудка, больным следует рекомендовать прием кортизона с твердой пищей или, если это трудно, с молоком и антацидными препаратами. Кроме того, большую часть суточной дозы (например, 25 мг кортизона) следует принимать по утрам, а остальную — вечером, чтобы имитировать нормальный суточный ритм секреции надпочечников. У некоторых больных в начале лечения возникают бессонница, раздражительность и психическое возбуждение; дозы гормонов в таких случаях следует уменьшить. Другими показаниями к снижению доз глюкокортикоидов являются гипертензия, диабет или острый туберкулез.
Поскольку такие низкие количества кортизона или кортизола не могут заместить дефицит секреции минералокортикоидов, необходимо назначать дополнительные препараты. Для этой цели используют пероральный прием 0,05—0,1 мг фторкортизона в сутки. Если имеются показания к парентеральному введению, можно ежедневно вводить внутримышечно 2—5 мг дезоксикортикостерона в масле.
Осложнения глюкокортикоидной терапии, за исключением гастрита, при дозах, используемых для лечения по поводу аддисоновой болезни, возникают редко. Осложнения минералокортикоидной терапии встречаются чаще; к ним относятся гипокалиемия, отеки, повышение артериального давления, увеличение размеров сердца и даже застойная сердечная недостаточность, связанная с задержкой натрия. В процессе лечения больных с аддисоновой болезнью следует периодически регистрировать массу тела, уровень калия в сыворотке крови и артериальное давление.
Все больные с недостаточностью надпочечников, включая и перенесших двустороннюю адреналэктомию, должны всегда иметь при себе медицинскую карту; их нужно обучать способу парентерального самовведения стероидов и ставить на учета национальной системе скорой помощи.
Специальные проблемы лечения. В периоды интеркуррентных заболеваний дозу кортизона или кортизола следует повысить до 75—150 мг в сутки. Если пероральный прием препарата невозможен, нужно использовать парентеральные пути введения. Подобно этому, дополнительное количество глюкокортикоидов следует вводить перед хирургической операцией или удалением зубов. Больные должны также знать о необходимости увеличивать дозу фторкортизона и добавлять к нормальной диете излишек соли в периоды тяжелой физической нагрузки, сопровождающейся потоотделением, при очень жаркой погоде, а также в случае желудочно-кишечных расстройств. Примерная схема стероидной терапии больных с недостаточностью надпочечников, направляемых на крупную хирургическую операцию, приведена в табл. 325-11. Эта схема предусматривает в день оперативного вмешательства имитацию секреции кортизола у здоровых лиц, подвергающихся длительному тяжелому стрессу (10 мг/ч, 250—300 мг/24 ч). Затем, при нормальном течении послеопера-
Таблица 325-11. Схема стероидной терапии у больных с аддисоновой болезнью, подвергающихся крупному хирургическому вмешательству1
| Сроки | Кортизона ацетат (внутримышечно) | Непрерывная инфузия кортизола, мг/ч | Кортизона ацетат (перорально) | Фторкортизон (перорально) 8 ч утра | ||
| 7 ч утра | 7 ч вечера | 8 ч утра | 4 ч дня | |||
| Обычное лечение | 12,5 | 0,1 | ||||
| День перед операцией | 12,5 | 0,1 | ||||
| День операции | ||||||
| После операции | ||||||
| 1-й » | 5—7,5 | |||||
| 2-й » | 2,5—5 | |||||
| 3-й » | ||||||
| 4-й » | 0,1 | |||||
| 5-й » | 37,5 | 0,1 | ||||
| 6-й » | 0,1 | |||||
| 7-й » | 12,5 | 0,1 |
1 Дозы всех стероидов даны в миллиграммах. ционного периода и отсутствии субфебрилитета, дозы кортизола снижают на 20—30% в сутки. При дозах кортизола выше 100 мг в сутки в парентеральном введении минералокортикоидов нет необходимости, поскольку и сам кортизол в столь большой дозировке вызывает минералокортикоидные эффекты.
Вторичная недостаточность коры надпочечников. Недостаточность гипофизарного АКТГ вызывает вторичную недостаточность коры надпочечников. Дефицит АКТГ может быть избирательным, как это наблюдается после длительного введения избытка глюкокортикоидов, или сочетаться с множественной недостаточностью тропных гормонов гипофиза (пангипопитуитаризм) (см. гл. 321). У больных с вторичной гипофункцией коры надпочечников отмечают большинство тех же признаков и симптомов, что и у больных с аддисоновой болезнью, но для них характерно отсутствие гиперпигментации, так как уровни АКТГ и родственных пептидов снижены. Действительно, больные с первичной и вторичной недостаточностью надпочечников различаются по уровню АКТГ в плазме: он повышен у первых и снижен (или вообще отсутствует) у вторых. У больных с полной недостаточностью гипофиза имеются также признаки и симптомы, характерные для дефицита многих гормонов. Дополнительным признаком, позволяющим отличить первичную недостаточность коры надпочечников от вторичной, является близкий к норме уровень секреции альдостерона, наблюдающийся при гипофизарной недостаточности или изолированном дефиците АКТГ (см. рис. 325-11). У больных с гипофизарной недостаточностью может иметь место гипонатриемия, обусловленная разведением крови или меньшим, чем в норме, приростом секреции альдостерона в ответ на резкое ограничение приема натрия. Однако данные о тяжелой дегидратации, гипонатриемии и гиперкалиемии характерны для выраженного дефицита минералокортикоидов и наводят на мысль о первичной недостаточности коры надпочечников.
У больных, длительно получающих стероидную терапию, несмотря на внешние признаки синдрома Кушинга, развивается недостаточность надпочечников в силу продолжительного подавления гипоталамо-гипофизарной оси и атрофии надпочечников, обусловленной отсутствием эндогенного АКТГ. Таким образом, у этих больных имеется два дефицита: потеря реактивности надпочечников по отношению к АКТГ и отсутствие секреции гипофизарного АКТГ. Для таких больных характерны низкие уровни кортизола и АКТГ в крови, низкая фоновая экскреция стероидов и нарушение реакций на АКТГ и метопирон. У большинства больных с вызванной стероидами недостаточностью надпочечников в конце концов восстанавливается нормальная реактивность гипоталамо-гипофизарно-надпочечниковой системы, но сроки такого восстановления колеблются в отдельных случаях от дней до месяцев. Восстановление функции гипоталамо-гипофизарно-надпочечниковой системы удобно оценивать с помощью быстрого теста с АКТГ. Так как концентрации кортизола в плазме после введения косинтропина и в ходе инсулиновой гипогликемии тесно коррелируют, быстрый тест с АКТГ позволяет получить интегральную оценку гипоталамо-гипофизарно-надпочечниковой функции. Дополнительную оценку гипофизарного резерва эндогенного АКТГ проводят с помощью стандартных метопиронового и инсулинотолерантного тестов.
Заместительная глюкокортикоидная терапия у больных с вторичной недостаточностью коры надпочечников не отличается от таковой у больных с аддисоновой болезнью. В заместительной минералокортикоидной терапии обычно нет нужды, поскольку секреция альдостерона сохраняется. Во всем остальном лечение больных с вторичной недостаточностью коры надпочечников базируется на тех же принципах.
Острая недостаточность коры надпочечников. В основе острой недостаточности коры надпочечников лежат несколько процессов. Один из них — адреналовый криз, представляет собой быстрое и резкое нарастание симптомов хронической надпочечниковой недостаточности, вызываемое обычно сепсисом или хирургическим стрессом. Другой заключается в острой геморрагической деструкции обоих надпочечников, связанной обычно с тяжелой септицемией (синдром Уотерхауса—Фридериксена). Описано также кровоизлияние в надпочечники на фоне повышенной активности их коркового слоя при антикоагулянтной терапии в ближайшие сроки после инфаркта миокарда. Кровоизлияние в надпочечники вследствие родовой травмы иногда встречается у новорожденных. Оно наблюдалось также во время беременности, при идиопатическом тромбозе надпочечниковых вен и в качестве осложнения венографии (например, инфаркт аденомы). Третья и, вероятно, наиболее частая причина острой недостаточности надпочечников — быстрая отмена стероидной терапии у больных с атрофией надпочечников на почве хронического введения стероидов. У больных с врожденной гиперплазией надпочечников и у лиц, получающих фармакологические средства, способные подавлять синтез стероидов (такие как ми готан), тяжелый стресс также может вызвать острую недостаточность надпочечников
Адреналовый криз. Прогноз у больных с аддисоновой болезнью зависит в основном от профилактики и лечения адреналовых кризов. Поэтому в случае инфекции, травмы (включая хирургические операции), желудочно-кишечных расстройств или других видов стресса необходимо немедленно увеличить дозы принимаемого гормона. У нелеченых больных обостряются предсуществующие симптомы, усиливаются тошнота, рвота и боли в животе, возможна тяжелая лихорадка. Сонливость переходит в ступор, а артериальное давление и пульс падают до уровня, характерного для тяжелого гиповолемического сосудистого шока. В отличие от этого у больных, ранее находившихся на хронической глюкокортикоидной терапии, до самого конца может и не возникать резкого обезвоживания или гипотензии, так как секреция минералокортикоидов обычно сохраняется. Во всех случаях криза необходимо искать его причину. Часто ею служит интеркуррентная инфекция, когда забывают или не могут увеличить дозу поддерживающего препарата.
Лечение должно быть направлено прежде всего на быстрое повышение уровня глюкокортикоидов в крови и восполнение дефицита натрия и воды. Поэтому следует немедленно начать внутривенную инфузию 5% раствора глюкозы в обычном физиологическом растворе с разовым внутривенным введением 100 мг кортизола и последующей непрерывной его инфузией со скоростью 10 мг/ч. В случае закупорки системы или неожиданного прекращения инфузии подругой причине следует внутримышечно ввести 50 мг кортизона ацетата. Гипотензию корригируют интенсивным восполнением дефицита натрия и воды. Если кризу предшествовали длительная тошнота, рвота или дегидратация, может потребоваться вливание нескольких литров солевого раствора уже за первые часы. В качестве дополнения к мерам коррекции объема жидкости в крайних ситуациях иногда возникает необходимость в сосудосуживающих средствах. При введении больших доз стероидов, например 100—200 мг кортизола, достигается максимальный минералокортикоидный эффект и дополнительное введение минералокортикоидов оказывается излишним. После улучшения состояния больной должен получать питье, а дозы стероидов постепенно снижают в течение нескольких следующих дней до поддерживающего уровня с возобновлением при необходимости заместительной минералокортикоидной терапии (см. табл. 325-11).
Гипоальдостеронизм
Изолированный дефицит альдостерона при нормальной продукции кортизола встречается в связи с гипоренинизмом как наследственный дефект биосинтеза, после хирургического удаления альдостеронпродуцирующих аденом, при длительном введении гепарина или сходных веществ, заболеваниях нервной системы и тяжелой постуральной гипотензии.
Общим признаком у всех больных с гипоальдостеронизмом является отсутствие адекватного повышения секреции альдостерона при ограничении потребления соли. У большинства больных обнаруживается необъяснимая гиперкалиемия, часто усиливающаяся при ограничении приема натрия с пищей. В тяжелых случаях потеря натрия с мочой происходит на фоне нормального потребления соли, тогда как при более легких формах заболевания избыточные потери натрия с мочой проявляются только в условиях ограниченного потребления соли.
Изолированный гипоальдостеронизм в большинстве случаев встречается у больных с недостаточной продукцией ренина (так называемый гипоренинемический гипоальдостеронизм). Этот синдром чаще всего развивается у взрослых лиц с легкой почечной недостаточностью и сахарным диабетом в сочетании с гиперкалиемией и метаболическим ацидозом, не соответствующим степени нарушения функции почек. После ограничения потребления соли и изменения позы уровень ренина в плазме не повышается. Патогенез синдрома остается неясным. Возможно, в его развитии играют роль патология почек (что наиболее вероятно), автономная нейропатия, увеличение внеклеточного объема жидкости и нарушение превращения гипотетических предшественников ренина в активный ренин. Уровень альдостерона также не возрастает после ограничения соли и уменьшения объема потребляемой жидкости. Это. по-видимому, связано с гипоренинизмом, так как в большинстве случаев биохимические дефекты в секреции альдостерона выявить не удается. Секреция альдостерона после стимуляции АКТГ у таких больных быстро увеличивается, хотя имеет ли эта реакция нормальную величину, неизвестно. С другой стороны, уровень альдостерона по отношению к степени гиперкалиемии оказывается сниженным.
Гипоальдостеронизм может иметь место и при высоком уровне ренина. Во многих подобных случаях обнаружено нарушение биосинтеза, заключающееся в отсутствии превращения С-18-метильной группы кортикостерона в С-18-альдегидную группу альдостерона из-за недостаточности фермента 18-гидроксистероид-дегидрогеназы. У таких больных отмечают не только снижение или полное отсутствие секреции альдостерона и повышение уровня ренина в плазме, но и возрастание содержания интермедиатов биосинтеза альдостерона (кортикостерона и 18-гидроксикортикостерона).
Прежде чем диагностировать у больного с гиперкалиемией изолированный гипоальдостеронизм, следует определить уровень калия в плазме и исключить «псевдогиперкалиемию» (например, гемолиз, тромбоцитоз). Затем нужно убедиться в том, что реакция кортизола на стимуляцию АКТГ не нарушена. Далее оценивают стимулированные (ортостазом, ограничением натрия) уровни ренина и альдостерона. Если снижены и тот, и другой, устанавливают диагноз гипоренинемического гипоальдостеронизма. Высокий уровень ренина и низкое содержание альдостерона говорят о нарушении биосинтеза альдостерона или об избирательной нечувствительности клубочковой зоны к ангиотензину II. Наконец, повышенные уровни и ренина, и альдостерона позволяют предполагать первичную нечувствительность почек к альдостерону, так называемый псевдогипоальдостеронизм.
Лечение больных с изолированным гипоальдостеронизмом должно быть направлено на возмещение дефицита минералокортикоидов. С практической точки зрения, для восстановления баланса электролитов было бы достаточно назначить внутрь фторкортизол в суточной дозе 0,1—0,2 мг. Тем не менее больным с гипоренинемическим гипоальдостеронизмом для нормализации калиемии требуются обычно более высокие дозы минералокортикоидов. Однако в связи с тем, что подобные больные часто страдают гипертензией и легкой почечной недостаточностью, это может быть опасным. Поэтому в качестве альтернативного метода предлагают вводить фуросемид, который смягчает ацидоз и гиперкалиемию. Иногда эффективным оказывается сочетание обоих методов.
Дата добавления: 2016-03-05; просмотров: 37766;
