Анатомия и эмбриология
Питуитарная железа (гипофиз) расположена в турецком седле основной кости в основании черепа и состоит из передней (аденогипофиз) и задней (нейрогипофиз) долей. Промежуточная доля у человека рудиментарна. В норме масса гипофиза составляет 0,5—0,91
От мозга гипофиз отделяет диафрагма турецкого седла, являющаяся выростом твердой мозговой оболочки, а от сфеноидального синуса спереди и снизу — тонкий слой кости. Латеральные стенки турецкого седла примыкают к кавернозным синусам, где проходят внутренние сонные артерии, а также III, IV, V и VI пары черепных нервов. Несколько кпереди от ножки гипофиза тотчас над диафрагмой турецкого седла расположен перекрест зрительных нервов. Поэтому опухоли гипофиза могут сопровождаться нарушением полей зрения, параличом черепных нервов или прорастанием в сфеноидальные синусы (рис. 321 -2 и 321 -3).
Гипоталамус занимает пространство, спереди ограниченное перекрестом зрительных нервов, а сзади включающее сосковидные тельца. Сверху гипоталамус отделяется от мозгового бугра (таламуса) бороздой III желудочка. Округлое нижнее основание гипоталамуса образует серый бугор. Центральная часть основания (называемая воронкой, или срединным возвышением) образует дно III желудочка (см. рис. 321-3) и продолжается вниз, образуя ножку гипофиза. Рилизинг-факторы синтезируются в нейронах, лежащих по краям III желудочка, волокна которых оканчиваются в срединном возвышении по соседству с капиллярами портальной системы.
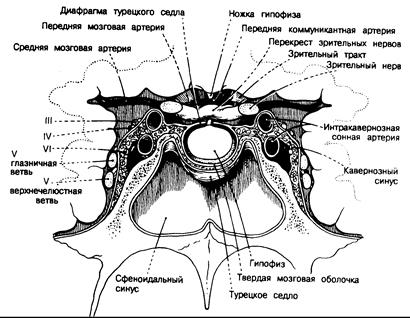
Рис. 321-2. Соотношения между гипофизом, черепными нервами и кавернозными синусами. Вид снизу. (Из J. А. Тагеп, — In: R. С. Schneider et al. (eds). Correlative Neurosm-serv 3d ed, Springfield, 111., Charles C. Thomas, 1982.)
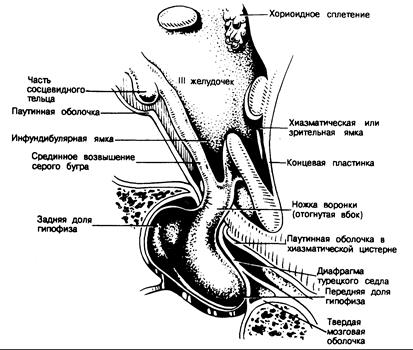
Рис. 321-3. Сагиттальный разрез через гипоталамо-гипофизарный комплекс человека Показаны анатомические соотношения между перекрестом зрительных нервов и ножкой гинойиза (Из Reichlin in: Post et al.) '
Клеточные тела супраоптических и паравентрикулярных ядер гипоталамуса продуцируют вазопрессин и окситоцин, которые по аксонам нервов супраоптикогипофизарного и паравентрикулогинофизарного трактов попадают в заднюю долю гипофиза.
Связь гипоталамуса с передней долей гипофиза имеет химическую, а не физическую природу. Образуемые гипоталамическими нейронами рилизинг-факторы попадают в переднюю долю гипофиза через портальную систему и стимулируют или ингибируют продукцию гипофизарных гормонов. Некоторые нейроны, содержащие вазопрессин, оканчиваются и в срединном возвышении, причем вазопрессин может стимулировать секрецию АКТГ и ГР.
Кровоток через переднюю долю гипофиза (0,8 мл/г в 1 мин) выше, чем через любой другой орган тела. Передняя доля снабжается кровью кружным путем через гипоталамус. Две ветви внутренних сонных артерий — верхние гипофизарные артерии (ВГА) разделяются в субарахноидальном пространстве вокруг ножки гипофиза и образуют капиллярную сеть в срединном возвышении. Эндотелий этих капилляров фенестрирован и легко пропускает гипоталамические рилизинг-гормоны. Перенос веществ из капилляров в срединное возвышение также происходит беспрепятственно, поскольку оно расположено вне гематоэнцефалического барьера. Затем капилляры сливаются, образуя 6—10 прямых вен, которые и называют гипоталамо-гипофизарной портальной системой. Эти вены играют основную роль в снабжении передней доли гипофиза кровью и питательными веществами, равно как и информацией из гипоталамуса. Небольшая часть артериальной крови приносится в переднюю долю гипофиза трабекулярными ветвями ВГА. Задняя доля гипофиза получает всю кровь из нижних гипофизарных артерий.
Передняя доля гипофиза образуется преимущественно из латеральной стенки кармана Ратке — эмбрионального выпячивания задней стенки ротовой полости зародыша. Пролиферируя, карман Ратке сливается с распространяющимся книзу дивертикулом дна III желудочка, который образует заднюю долю гипофиза.
Карман Ратке закрывается растущими долями гипофиза, и впоследствии от него остается в железе тонкая щель (щель Ратке). Это небольшое пространство может сохраняться в виде кисты, выстланной кубическим или цилиндрическим эпителием. Поскольку в процессе своего роста гипофиз поворачивается, такие кисты располагаются обычно над ним. Рост и пролиферация этих кист может привести к образованию краниофарингиом — опухолей, занимающих, как правило, супраселлярное положение. Развивающаяся основная кость отделяет гипофиз от ротовой полости. Внутри или ниже основной кости могут сохраняться остатки гипофиза, называемые глоточными гипофизами. Эти остатки могут продуцировать гипофизарные гормоны и иногда перерождаются в опухоли.
Клетки передней доли гипофиза, подразделяющиеся на пять типов, секретируют шесть разных гормонов: лактотрофы — пролактин, соматотрофы — ГР, гонадотрофы — ЛГ и ФСГ, тиреотрофы — ТТГ и кортикотрофы — АКТГ.
Пролактин
Физиология. В норме на долю лактотрофов приходится 10—25% клеток гипофиза, а во время беременности их число достигает 70%. Ген пролактина, располагающийся на 6-й хромосоме, кодирует молекулу предшественника, большую по размерам, чем выделяющийся в кровь гормон. Преобладающая форма окончательного гормона содержит 198 аминокислотных остатков (мол. масса 23 000) в одной цепи, имеющей три дисульфидных мостика. В крови здоровых людей и в большем количестве у больных с аденомами гипофиза могут присутствовать и формы пролактина с более высокой мол. массой, вплоть до 100 000 («большой» и «большой-большой» пролактин). Эти формы обнаруживаются при иммунологическом определении пролактина, но не обладают нормальной биологической активностью.
Пролактин необходим для лактации. У человека его рецепторы локализуются в молочных железах и гонадах, но у животных они найдены во многих тканях. У грызунов пролактин способствует развитию рака молочной железы, но у человека такая зависимость не установлена (см.гл. 295).
Возрастающая при беременности продукция плацентарных эстрогенов стимулирует рост и размножение лактотрофов гипофиза и приводит к повышению секреции пролактина. Во время нормальной беременности размеры гипофиза увеличиваются вдвое, а после родов возвращаются к исходным. Секреция пролактина во время беременности подготавливает молочные железы к послеродовой лактации. Эстрогены ингибируют действие пролактина на молочные железы, так что до послеродового снижения уровня эстрогенов лактация не начинается.
У плода, начиная примерно с 25-недельного возраста, уровень пролактина увеличивается, вероятно, в результате переноса к плоду материнских эстрогенов, стимулирующих фетальный гипофиз. После рождения содержание пролактина быстро уменьшается, достигая минимума к 2—4-недельному возрасту. В амниотической жидкости содержится большое количество пролактина, но откуда он попадает сюда и какова его функциональная роль здесь — неизвестно.
В нормальных условиях секреция пролактина передней долей гипофиза «сдерживается» гипоталамусом. При разрушении гипоталамуса или перерезке ножки гипофиза секреция пролактина увеличивается, и его концентрация в сыворотке крови возрастает. Роль гипоталамического ингибирующего фактора играет, по-видимому, дофамин, хотя описаны ингибирующие факторы и пептидной природы. Главным местом синтеза дофамина в гипоталамусе является дугообразное ядро. Дофамин спускается по аксонам к нервным окончаниям в срединном возвышении, где и высвобождается (тубероинфундибулярная дофаминовая система). Затем он проникает в портальную систему и достигает передней доли гипофиза, ингибируя секрецию пролактина. Внутривенное введение дофамина (2 мкг/мин на 1 кг массы тела) или пероральный прием его предшественников (например, леводопа) или агонистов (например, бромкриптин) ингибирует секрецию пролактина. Увеличение уровня пролактина в крови, по-видимому, стимулирует гипоталамическую продукцию дофамина, что в свою очередь частично снижает секрецию пролактина через «короткую» петлю механизма обратной связи.
Возрастание секреции пролактина во время кормления грудью требует, очевидно, действия пролактин-рилизинг-фактора, который пока еще окончательно не идентифицирован. Им может быть вазоактивный интестинальный пептид (ВИП), так как он является мощным стимулятором секреции пролактина. Индуцируемое грудным кормлением повышение секреции пролактина блокируется антагонистами серотонина, такими как метизергид, что свидетельствуете влиянии серотонина на секрецию пролактина. Мощным стимулятором секреции пролактина является и ТРГ. Действительно, наименьшая доза ТРГ, способная стимулировать секрецию ТТГ, одновременно стимулирует и секрецию пролактина. Однако в большинстве физиологических ситуаций секреция ТТГ и пролактина контролируется независимо друг от друга: лактация не приводит к повышению секреции ТТГ, а первичный гипотиреоз редко сопровождается избыточной продукцией пролактина.
Концентрация пролактина повышается во время сна. Этот феномен предполагает существование в гипоталамусе входа для влияний высших центров. Секрецию пролактина, индуцируемую стрессом, можно заблокировать антагонистами опиатов, такими как налоксон, и она опосредуется, вероятно, эндогенными опиоидами. Действительно, морфин стимулирует секрецию пролактина, что может объяснять аменорею, встречающуюся у наркоманок, но на базальную секрецию пролактина антагонисты опиатов не влияют.
Гиперпролактинемия. Клинические проявлния. Избыток пролактина (гиперпролактинемия) сопровождается гипогонадизмом и/или галактореей и может быть важным признаком наличия аденомы гипофиза или поражения гипоталамуса. У 10_40% женщин с аменореей отмечается гиперпролактинемия, а у 30% женщин с аменореей и галактореей имеются пролактинсекретирующие опухоли гипофиза.
Гипогонадизм, связанный с гиперпролактинемией, обусловлен, по-видимому, ингибированием гипоталамической секреции ЛГРГ, что приводит к снижению секреции ЛГ и ФСГ. Этот функциональный гипогонадизм можно рассматривать отчасти как физиологический (адаптивный) механизм, так как кормление грудью сопровождается снижением фертильности и более поздним возобновлением менструаций. В целом, чем выше уровень пролактина в плазме, тем больше вероятность аменореи. При менее выраженной гиперпролактинемии у женщин отмечается нерегулярность менструаций или бесплодие из-за укороченной лютеальной фазы цикла. Недостаточность эстрогенов, сопровождающая гиперпролактинемию, может привести к остеопорозу.
У мужчин избыток пролактина вызывает импотенцию и бесплодие. По данным ряда исследований, гиперпролактинемия обнаруживается у 8% мужчин с импотенцией и у 5% бесплодных мужчин. При повышении уровня пролактина содержание ФСГ и ЛГ у мужчин снижается, концентрация тестостерона у них также часто снижается.
Галакторея, определяемая как выделение молока вне связи с послеродовым периодом, наблюдается у 30—90% женщин с гиперпролактинемией (см. гл. 332). Различия в частоте встречаемости этого признака отчасти объясняют разницей в тщательности опроса больных. Галакторея может встречаться и в отсутствие гиперпролактинемии, особенно у рожавших женщин. Тем не менее галакторея зачастую служит важным указанием на избыток пролактина. При сочетании галактореи с аменореей гиперпролактинемия имеется у 75% женщин. У мужчин гиперпролактинемия редко вызывает гинекомастию или галакторею (см. гл. 332).
Дифференциальная диагностика. Избыток пролактина может быть связан со следующими причинами: 1) автономной продукцией гормона (аденомы гипофиза); 2) уменьшением уровня дофамина или его ингибирующего действия (например, из-за патологии гипоталамуса или приема средств, блокирующих синтез, секрецию или действие дофамина); 3) наличием стимулов, преодолевающих нормальное дофаминергическое ингибирование (например, эстрогены или, возможно, гипотиреоз); 4) снижением клиренса пролактина (почечная недостаточность). Разграничить физиологические, фармакологические и патологические причины гиперпролактинемии с помощью какого-либо единственного супрессивного теста невозможно (табл. 321-2).
У женщин концентрация пролактина (менее 20 нг/мл) несколько выше, чем у мужчин (менее 15 нг/мл). Во время беременности концентрация пролактина начинает возрастать со 11 триместра и достигает максимума к моменту родов. Максимальные цифры колеблются от 100 до 300 нг/мл, но обычно ниже 200 нг/мл. Тест на беременность необходимо проводить у всех женщин с гиперпролактинемией и аменореей, равно как и только аменореей. После родов средняя концентрация пролактина снижается, но при каждом кормлении ребенка возрастает. Постепенно за несколько месяцев уменьшается как базальная, так и стимулируемая актом кормления концентрация пролактина; через 4—6 мес после родов базальный уровень его нормализуется и больше не возрастает при кормлении грудью, несмотря на его продолжение.
Больных с гиперпролактинемией следует тщательно расспрашивать о принимаемых лекарствах. Частой причиной гиперпролактинемии являются средства, блокирующие действие дофамина (например, фенотиазины, бутирофеноны, метоклопрамид) или снижающие его уровень (например, метилдофа и резерпин). Прием таких средств редко сопровождается возрастанием концентрации пролактина выше 100 нг/мл, если нет почечной недостаточности. Хотя высокие дозы эстрогенов вызывают гиперпролактинемию, прием пероральных контрацептивов, содержащих низкие дозы эстрогенов, не сопровождается повышением уровня пролактина
Таблица 321-2. Причины гиперпролактинемии
I. Физиологические состояния (беременность, ранние сроки кормления грудью, стресс, сон, раздражение сосков молочной железы)
II. Фармакологические средства
Антагонисты дофаминовых рецепторов (фенотиазины, бутирофеноны, тиоксантены, метоклопрамид)
Средства, снижающие уровень дофамина (метилдофа, резерпин)
Эстрогены
Опиаты
III. Патологические состояния
Опухоли гипофиза [пролактиномы; аденомы, секретирующие ГР и пролактин; аденомы, секретирующие АКТГ и пролактин (синдром Нельсона и болезнь Кушинга); нефункционирующие хромофобные аденомы со сдавлением ножки гипофиза]
Поражения гипоталамуса и ножки гипофиза (гранулематозные заболевания, особенно саркоидоз; краниофарингиомы и другие опухоли; облучение черепа: перерезка ножки гипофиза; синдром «пустого» турецкого седла; сосудистая патология, включая аневризмы)
Первичный гипотиреоз
Хроническая почечная недостаточность
Цирроз печени
Травма грудной стенки (включая операционную и опоясывающий герпес)
Конечная стадия почечной недостаточности приводит к гиперпролактинемии у 70— 90% женщин и 25—60% мужчин. Это обусловливает гипогонадизм у части больных с почечной недостаточностью. Повышение уровня пролактина в таких случаях может определяться не только снижением его клиренса, но и увеличением секреции. Повышение концентрации пролактина в сыворотке крови при циррозе печени объяснить трудно.
Причиной умеренного повышения концентрации пролактина в сыворотке может быть тяжелый первичный гипотиреоз. Это происходит либо за счет повышения уровня ТРГ, либо за счет снижения дофаминергического тонуса. Поскольку при первичном гипотиреозе может наблюдаться и увеличение турецкого седла, имитирующее аденому гипофиза, тиреоидную функцию следует проверять у всех больных с повышенным уровнем пролактина в сыворотке крови. Изредка обратимое повышение концентрации пролактина в сыворотке отмечается при первичной недостаточности надпочечников.
Если гиперпролактинемия развилась не на фоне беременности, послеродового состояния или приема соответствующих лекарств, если больной не страдает циррозом печени, гипотиреозом или почечной недостаточностью, то остается предполагать патологию гипофиза или гипоталамуса. Эктопическая продукция пролактина внегипофизарными опухолями практически не встречается. Патология гипоталамуса или ножки гипофиза сопровождается умеренным повышением уровня пролактина (обычно ниже 150 нг/мл). Гиперпролактинемия имеется у 20—50% больных с опухолями гипоталамуса.
Пролактинсекретирующие аденомы гипофиза (пролактиномы) представляют собой либо маленькие опухоли, локализующиеся в паренхиме железы (так называемые микроаденомы), либо крупные опухоли, вызывающие увеличение размеров гипофиза (макроаденомы). Крупные нефункционирующие аденомы гипофиза также могут вызывать умеренное повышение уровня пролактина вследствие сдавления ножки гипофиза и создания препятствия для поступления дофамина в железу. Повышенный уровень пролактина обычно наблюдается и у больных акромегалией (у 25—45%), а также при синдроме Нельсона (опухоль гипофиза после адреналэктомии у больных с болезнью Кушинга). При нелеченой болезни Кушинга гиперпролактинемия встречается реже.
Результаты лабораторных исследований. У всех больных с гипогонадизмом или галактореей необходимо определять уровень пролактина в сыворотке крови. Если базальная концентрация пролактина повышена и доказано, что это небольшое ее увеличение (например, ниже 30 нг/мл) не связано со стрессом, целесообразно проводить дальнейшие исследования. Хотя какого-то одного теста для дифференциации причин гиперпролактинемии не существует, все же уровень пролактина в сыворотке выше 300 нг/мл свидетельствует в пользу аденомы гипофиза; содержание пролактина в сыворотке выше 100 нг/мл в отсутствие беременности также обусловливается обычно аденомой гипофиза. Введение агонистов дофамина, таких как бромкриптин, снижает уровень пролактина независимо от причины его повышения и поэтому не может служить дифференциально диагностическим тестом (рис. 321 -4). Стимуляционные тесты также не позволяют дифференцировать причины гиперпролактинемии. Например, у большинства больных с пролактиномами повышение уровня пролактина в ответ на ТРГ минимально или вообще отсутствует, тогда как в норме это повышение превышает 200%, а для больных с патологией гипоталамуса или принимающих дофаминблокирующие средства характерна промежуточная величина (обычно наблюдается удвоение уровня пролактина в сыворотке). К сожалению, реакция на ТРГ слишком непостоянна, чтобы быть полезным тестом в каждом отдельном случае.
Всем больным с необъяснимой гиперпролактинемией необходимо производить контрастную компьютерную томографию (КТ) гипоталамуса и гипофиза или магнитную резонансографию (МРГ) этой области. При КТ-сканировании легко визуализируются макроаденомы гипофиза, но микроаденомы (менее 10 мм) увидеть сложнее. Если рентгенологических изменений нет, то состояние квалифицируют как «идиопатическую гиперпролактинемию», не исключая при этом возможности существования маленькой микроаденомы. Томография турецкого седла — также ненадежный скрининг-тест на небольшие аденомы гипофиза, так как часто дает ложноположительные и ложноотрицательные результаты.
Микропролактиномы не сопровождаются гипопитуитаризмом (не считая гипогонадизма). При выявлении у больного с гипопитуитаризмом и гиперпролактинемией небольшого нарушения в гипофизе следует подозревать саркоидоз или другую патологию с вовлечением ножки гипофиза, а не микропролактиному. У больных с макропролактиномами или гипоталамическими нарушениями необходимо оценивать функцию гипофиза и проверять поля зрения.
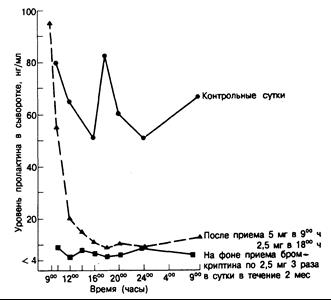
Рис. 321 -4. Изменение концентрации пролактина в сыворотке крови у женщин с «идиопатической» гиперпролактинемией» после первичного приема бромкриптина в дозе 5 мг и на фоне поддерживающей терапии — по 7,5 мг в сутки. (По G. H. Besser, М. О. Thorner, Postgrad. Med. J, 1976,52:66.)
Пролактиномы. Патологические изменения. Пролактиномы —это наиболее частый вид функционирующих аденом гипофиза. Небольшие микроаденомы, о существовании которых при жизни больного и не подозревали, обнаруживают в 15—25% всех аутопсий; в 40% этих маленьких опухолей методами иммунологического окрашивания выявляют пролактин, но как часто они действительно секретировали данный гормон — неизвестно. Примерно 70% макроаденом, ранее считавшихся не4)ункционирующими, на самом деле являются пролактиномами. Пролактинсекретирующие карциномы гипофиза встречаются редко.
Размеры пролактиномы коррелируют с уровнем секреции гормона; в целом, чем крупнее опухоль, тем выше уровень пролактина. Большие опухоли гипофиза с умеренным повышением уровня пролактина (50—100 нг/мл) — это не истинные пролактиномы. Они и проявляются своеобразно. Микропролактиномы сопровождаются только гиперпролактинемией и гипогонадизмом, тогда как макропролактиномы могут изменять уровень и других гипофизарных гормонов и сопровождаться головной болью, изменением полей зрения и другими признаками структурных нарушений.
Клинические проявления. Микропролактиномы встречаются чаще, чем макропролактиномы, причем 90% больных с микропролактиномами — женщины, тогда как 60% больных с макропролактиномами — мужчины. Нерегулярность менструаций, аменорея и галакторея способствуют ранней диагностике опухоли, а это, вероятно, объясняет преимущественное выявление микроаденом именно у женщин. У большинства мужчин с пролактиномами тоже отмечаются половые нарушения, но первой жалобой они бывают лишь в 15% случаев или меньше. Однако, хотя более позднее обращение мужчин за медицинской помощью объясняет, по-видимому, больший размер опухолей у них, нельзя исключить и более агрессивный рост опухоли у мужчин.
Эстрогены способствуют росту лактотрофов, но роль пероральных контрацептивов в патогенезе пролактином не установлена. У многих женщин с пролактиномами галакторея впервые развивается на фоне приема контрацептивов или аменорея впервые развивается после их отмены. У некоторых из таких больных нерегулярность менструаций, обусловленная пролактиномой, совпадает по времени с применением пероральных контрацептивов. Хотя аменорея после отмены этих препаратов встречается редко (примерно в 2% случаев), примерно у 30% больных с такой аменореей (после отмены пилюль) имеются пролактиномы. Развитие галактореи у женщин в период приема пероральных контрацептивов оправдывает определение у них уровня пролактина. Примерно у 5—7% больных с пролактиномой никогда не было менструаций (первичная аменорея), что делает эту опухоль важной курабельной причиной первичной аменореи. Пролактиномы могут расти во время беременности, и у 15% больных с пролактиномой диагноз впервые устанавливается в послеродовой период.
Желающие забеременеть женщины с пролактиномами требуют особого внимания. При медикаментозном лечении больных с микропролактиномами 95—98% срока беременности протекает без осложнений; в остальное время могут появиться головная боль или нарушения полей зрения из-за увеличения опухоли, что редко требует специальной терапии. Бессимптомное увеличение микропролактином, судя по результатам рентгенологических исследований, встречается примерно у 5% больных. При макропролактиномах рост опухоли в период беременности чаще дает осложнения. Симптомы увеличения размеров опухоли встречаются примерно у 15% таких больных, хотя в отдельных группах эта цифра достигала 35%. У большинства больных симптомы роста опухоли появляются в I триместре беременности.
Влияние беременности на секрецию пролактина у больных с пролактиномой проявляется по-разному. У некоторых больных, даже несмотря на рост опухоли, уровень пролактина в дальнейшем не увеличивается. Концентрацию последнего у женщин с пролактиномами следует периодически определять на всем протяжении беременности. При заметном повышении уровня пролактина (более 300—400 нг/мл) во время беременности он обычно остается выше исходного и после родов, причем увеличивается вероятность роста опухоли. У больных со стабильной или снижающейся концентрацией пролактина во время беременности уровень гормона после родов может быть ниже, чем до беременности. У таких больных во время беременности может происходить инфаркт или инволюция аденом.
Лечение больных с пролактиномами требует учета естественной эволюции заболевания. Хотя крупные аденомы гипофиза вырастают из маленьких опухолей, большинство микроаденом не прогрессирует до макроопухолей. Сведения о естественной эволюции не леченых микропролактином неполны; у 90—95% больных уровень пролактина в сыворотке за 7-летний срок наблюдения остается стабильным или снижается. У большинства больных с «идиопатической гиперпролактинемией» предположительно имеются маленькие микропролактиномы. У 30% таких больных уровень пролактина в сыворотке за 5-летний срок нормализуется без всякого лечения. При базальном уровне пролактина менее 40 нг/мл нормализация его содержания за этот срок отмечается у 60% больных.
Лечение. Не все больные с микропролактиномами нуждаются в лечении. Женщинам с микропролактиномами лечение необходимо, если они хотят забеременеть, если у них снижается либидо или беспокоит галакторея, если они хотят, чтобы менструации у них стали регулярными или имеется риск остеопороза. Мужчин с микропролактиномами следует лечить при снижении потенции или либидо, а также в случае предъявления жалоб на бесплодие. При наличии макропролактином лечение требуется в большинстве случаев.
Антагонисты дофамина снижают концентрацию пролактина практически у всех больных с гиперпролактинемией (см. рис. 321-4). Овуляторные циклы и фертильность восстанавливаются у 90% женщин пременопаузального возраста, что подчеркивает прямую связь между гиперпролактинемией и аменореей. В США в настоящее время единственным разрешенным препаратом, эффективно снижающим уровень пролактина, является бромкриптин — производное алкалоидов спорыньи, обладающее свойствами агониста дофамина. Бромкриптин следует назначать дважды в день с пищей во избежание раздражения желудочно-кишечного тракта. Лечение нужно начинать с дозы 1,25 мг, принимаемой лежа, чтобы свести к минимуму побочные эффекты (тошнота, рвота, слабость, отек слизистой оболочки носа и постуральная гипотензия). Дозы постепенно повышают до 2,5 мг дважды в день (в среднем). Однако у некоторых больных с макропролактиномами для нормализации уровня пролактина в сыворотке может потребоваться 15 мг бромкриптина в сутки. Хотя этот препарат и дорогостоящ, он эффективен при всех формах гиперпролактинемии, а часто снимает и галакторею, не связанную с гиперпролактинемией. Один раз в день можно вводить перголид — длительно действующий агонист дофамина, но в США он не применяется. Хотя перголид и бромкриптин дают сходные побочные эффекты, отдельные больные переносят только один из этих препаратов.
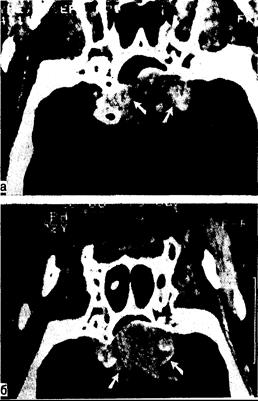
Рис. 321-5. Фронтальная КТ-сканограмма мужчины с крупной пролактинсекретирующей макроаденомой (верхний край опухоли показан стрелками). а — до лечения; б — через 1 год после начала лечения бромокриптином. (По Molitch et al.).
У больных с микропролактиномами с одним из вышеперечисленных показаний к лечению бромкриптин является средством выбора. Почти у всех, кто переносит этот препарат, концентрации пролактина нормализуются обычно через несколько дней после начала приема полной лечебной дозы (см. рис. 321-4). Менструации восстанавливаются, как правило, в течение 2 мес, однако иногда нарушения сохраняются на срок до 1 года. Поскольку беременность может наступить и в отсутствие нормальных менструаций, до установления их регулярности рекомендуется пользоваться барьерными контрацептивами. В этом случае при наступлении беременности бромкриптин можно отменить уже в первом безменструальном периоде. Однако применение бромкриптина во время беременности не сопряжено с увеличением риска врожденных пороков или выкидыша. Эффект бромкриптина обычно нестабилен, но у 15—17%о больных с микропролактиномами нормальная концентрация пролактина сохраняется и после отмены препарата.
У больных с макропролактиномами бромкриптин обычно снижает уровень пролактина в сыворотке и может уменьшать массу опухоли. Концентрация тестостерона у мужчин начинает увеличиваться через 3 мес, а через 6—8 мес может достигать нормы. У некоторых больных нормализуется и число сперматозоидов.
Одна из групп больных с крупными пролактиномами, супраселлярно распространенными (средний уровень пролактина 1441 нг/мл у женщин и 3451 нг/мл у мужчин) представляет особый интерес. Хотя у 96% больных уровень пролактина снизился на 10% от исходного, у большинства не произошло его нормализации, несмотря на дозы бромкриптина от 7,5 до 20 мг/сут. Нарушения полей зрения уменьшились у 90% больных (рис. 321 -5). Таким образом, бромкриптин может служить средством выбора у больных с небольшими макропролактиномами. Однако у больных с более крупными опухолями, у которых сохраняются нарушения полей зрения или симптомы гиперпролактинемии, а также у женщин с крупными опухолями, желающими забеременеть, бромкриптин в качестве единственного средства лечения не рекомендуется. У таких больных рост опухоли может возобновиться после отмены бромкриптина, будь то из-за небрежности, беременности или возникновения заболеваний, при которых его применение противопоказано. Крупные нефункционирующие аденомы гипофиза, сопровождающиеся гиперпролактинемией из-за сдавления ножки гипофиза, обычно не уменьшаются под действием бромкриптина, хотя концентрация пролактина нормализуется. У больных с крупными пролактиномами, резистентными к бромкриптину и другим лечебным средствам, некоторого эффекта можно добиться с помощью тамоксифена — антагониста эстрогенов.
После транссфеноидальной резекции микропролактином концентрация пролактина в сыворотке крови нормализуется обычно за 24 ч у 80—90% больных. Эта операция дает небольшой процент осложнений и смертности. К сожалению, частота рецидивов после «успешной» операции составляет в среднем 17%, а за 6 лет может достигать 40%. Операция для женщин с микропролактиномами является разумной альтернативой только в случае их желания забеременеть и при непереносимости агонистов дофамина или отказе от их приема.
Операция в сочетании с приемом бромкриптина и/или облучением показана всем больным с макропролактиномами при супраселлярном распространении опухоли и сохранении нарушений полей зрения, и особенно если такие женщины хотят забеременеть. Однако у больных с макропролактиномами хирургическая резекция опухоли, будь то транссфеноидальная или транскраниальная, редко обеспечивает выздоровление. Концентрация пролактина нормализуется примерно у 30% больных, но даже в этих случаях частота рецидивов может достигать 80%. Всем больным, у которых уровень пролактина после операции не нормализовался, следует назначать длительную терапию бромкриптином и/или применять облучение.
Общепринятая лучевая терапия [4500 с Гр (4500 рад) за 25 дней] по поводу пролактином приводит к медленному снижению концентрации пролактина в сыворотке крови. Через 2 года — 10 лет после облучения уровень пролактина нормализуется примерно у 30% больных. Облучение больных с микропролактиномами не рекомендуется из-за опасности развития у них гипопитуитаризма. Лучевая терапия служит полезным дополнением хирургического или консервативного лечения больных с макроплактиномами; дальнейший рост опухоли обычно прекращается, а примерно у 50% больных размер ее уменьшается. Такая терапия обычно предотвращает рост опухоли во время последующих беременностей. хотя отмечены и исключения из этого правила.
Для лечения больных с микропролактиномами без супраселлярного распространения или после-хирургического уменьшения массы крупных опухолей можно применять облучение тяжелыми частицами (протоны или альфа-частицы). Эту форму терапии предпочитают и отдельные больные с микропролактиномами. Однако отдаленные результаты такого способа лечения больных с пролактиномами неизвестны.
Недостаточность пролактина. Недостаточность пролактина проявляется неспособностью к лактации. Этот признак часто служит ранним указанием на пангипопитуитаризм, развившийся вследствие разрушения гипофиза в периродовой период. Латеральные крылья гипофиза имеют ненадежное кровоснабжение; большинство же лактотрофов располагается именно в этих областях. Во время беременности над гипертрофированными и гиперплазированными лактотрофами нависает опасность некроза. При развитии системной гипотензии, что имеет место в условиях послеродового кровотечения, гипертрофированные и гиперплазированные лактотрофы могут подвергаться инфаркту (синдром Шихена). Больные сахарным диабетом предрасположены к инфаркту гипофиза в периродовом периоде даже в отсутствие значительного кровотечения. На поздних стадиях беременности может развиться и аутоиммунное разрушение гипофиза (лимфоцитарный гипофизит).
С помощью коммерческих наборов для радиоиммунологического определения пролактина нельзя разграничить его нормальные и низкие концентрации. Поэтому для диагностики недостаточности пролактина необходимо применять стимуляционные тесты. Возрастание уровня пролактина в сыворотке после введения ТРГ или хлорпромазина менее чем на 200% указывает на недостаточность пролактина. При наличии последней необходимо определять уровень других гипофизарных гормонов, равно как и искать другие проявления гипопитуитаризма.
Гормон роста
Физиология. Гормон роста (ГР, соматотропин) секретируется соматотрофами, на долю которых приходится примерно 50% всех клеток передней доли гипофиза. Нормальный гипофиз содержит 3—5 мг ГР и секретирует в сутки 500—875 мкг этого гормона. Ген, кодирующий ГР, расположен на 17-й хромосоме. Значение дополнительных генов, имеющих отношение к синтезу ГР, неизвестно. Гормон роста человека представляет собой одноцепочечный полипептид, содержащий 191 аминокислоту (мол. масса 22 000) с двумя дисульфидными связями в цепи. ГР отщепляется от более крупной (мол. масса 28 000) молекулы предшественника. ГР запасается в цитоплазматических гранулах в форме полимера с высокой мол. массой.
Структура ГР сходна с таковой плацентарного лактогена человека (чПЛ, хорионический соматомаммотропин). Структурная гомология между двумя этими гормонами составляет 92%). Гены ГР и чПЛ расположены на одной и той же хромосоме и образуются, по-видимому, путём генной дупликации.
В крови преобладает мономерный ГР (мол. масса 22 000). Формы с большей мол. массой могут представлять собой димеры (например, «большой» ГР с мол. массой 44 000), которые, по-видимому, секретируются гипофизом. Хотя при использовании наборов для радиоиммунологического определения ГР определяется и «большой» ГР, он обладает меньшей биологической активностью. Для ГР характерна импульсная секреция, и в течение большей части суток его концентрация в крови низка. Период полужизни гормона в плазме составляет 20—30 мин.
ГР необходим для нормального линейного роста. Недостаточность гормона роста сопровождается низкорослостью, а избыток его (до закрытия эпифизарных щелей) — гигантизмом. ГР, по-видимому, не является главным непосредственным стимулятором роста, а действует косвенно через факторы сыворотки. Образование этих факторов, известных под названием соматомединов (СМ, гормоны, опосредующие действие соматотропина), или инсулиноподобных факторов роста (ИФР), зависит от ГР, и именно они, очевидно, ответственны за стимуляцию роста (см. также гл. 322). Соматомедин С (инсулиноподобный фактор роста 1, ИФР-1/СМ-С) — наиболее активный в отношении роста соматомедин — образуется в печени и в других тканях. Он представляет собой небольшой щелочной белок (мол. масса 7600), циркулирующий в связанном с крупной молекулой-носителем (мол. масса 140 000) виде. Период полужизни этого комплекса 3—18 ч, тогда как для несвязанного гормона— 20—30 мин. Поэтому концентрация ИФР-1/СМ-С на протяжении суток остается относительно постоянной в отличие от колеблющегося уровня самого ГР. Каким образом печень интегрирует импульсы секреции ГР в продукцию соматомедина, неизвестно, Больше того, локальное образование ИФР-1/СМ-С может играть важную роль в опосредовании паракринных ростовых эффектов.
Соматомедин С и второй соматомедин (соматомедин А) обладают структурной гомологией с проинсулином, причем соматомединам свойственны некоторые инсулиноподобные эффекты. Больше того, ГР является тропным фактором в отношении секреции инсулина, облегчая его выброс в ответ на различные секретогены, а у лиц с недостаточностью ГР нарушена секреция инсулина в ответ на стимуляцию глюкозой. В свете этих данных инсулин также мог бы рассматриваться как соматомедин.
В пренатальном и неонатальном периодах рост не зависит от ГР, как об этом свидетельствует нормальная длина тела новорожденных с недостаточностью ГР от матерей с той же недостаточностью. Тем не менее уровень ИФР-1 /СМ-С во время беременности увеличивается и его концентрация коррелирует с концентрацией чПЛ, которая и могла бы регулировать продукцию соматомедина. Играют ли соматомедины физиологическую роль in utero, неизвестно. У новорожденных уровень ИФР-1/СМ-С примерно вдвое ниже, чем у взрослых, и на протяжении детства постепенно увеличивается, достигая «взрослых» значений к 8—10-летнему возрасту. Уровень ИФР-1/СМ-С зависит от питания, снижаясь при его нарушении. Во время бурного роста в пубертатном периоде концентрация ИФР- 1/СМ-С увеличивается, что, вероятно, и обусловливает ускорение роста в этот период. При недостаточности эстрогенов уровень ИФР-1/СМ-С не повышается.
Хотя концентрация ИФР-1/СМ-С коррелирует с линейным ростом, корреляция эта неполная, и поэтому ГР мог бы обладать некоторым прямым влиянием на рост или вызывать продукцию соматомединов непосредственно в клетках-мишенях.
Важны и другие метаболические эффекты ГР. Он представляет собой анаболический гормон, стимулирующий включение аминокислот в белок. Хотя в значительной степени этот эффект опосредуется соматомединами, ГР способен и прямо стимулировать поглощение аминокислот в некоторых системах. Поэтому неудивительно, что отдельные аминокислоты, например аргинин, являются мощными стимуляторами секреции ГР.
Таблица 321-3. Регуляция секреции гормона роста
| Класс соединении | Стимуляция | Торможение |
| Гипоталамические факторы | ГРГ | Соматостатин |
| Амины | a -Адренергические стимулы (норадреналин, клонидин) b-Адренергические блокаторы (пропранолол) Дофаминергические стимулы (леводопа, бромкрип-тин, апоморфин) Серотонинергические стимулы (L-триптофан) | b-Адренергические стимулы a-Адренергические блокаторы (фентоламин, дибен-зилин) Блокаторы дофамина (хлорпромазин) Блокаторы серотонина (метизергид, ципрогептадин) |
| Гормоны | Снижение ИФР-1/СМ-С Эстрогены Вазопрессин Глюкагон | Повышение ИФР-1/СМ-С (ожирение) Прогестины Глюкокортикоиды |
| Пищевые факторы | Гипогликемия1 Снижение уровня содержания свободных жирных кислот Аминокислоты (аргинин) | Повышение уровня содержания сахара в крови Повышение уровня содержания жирных кислот |
| Прочие | Физическая нагрузка Стресс Сон |
1 Вероятно, опосредовано через a-адренергическую стимуляцию.
ГР может оказывать прямой эффект и как антагонист инсулина. Больные с недостаточностью ГР особенно чувствительны к инсулиновой гипогликемии; у больных с избытком ГР развивается инсулинорезистентность. ГР служит одним из контррегуляторных гормонов, способствующих восстановлению уровня сахара в крови, снизившегося под действием инсулина (см. гл. 329). Вероятно, он также играет роль в патогенезе феномена «утренней зари» — повышении уровня глюкозы в плазме у больных сахарным диабетом в ранние утренние часы. Гипогликемия служит мощным стимулом секреции ГР, а острое повышение содержания сахара в крови ингибирует его секрецию. ГР увеличивает выход свободных жирных кислот из адипоцитов. Выпадение этого эффекта может определять ожирение у детей с недостаточностью ГР. Повышение концентрации свободных жирных кислот обычно снижает секрецию ГР. Этот гормон противодействует влиянию инсулина на поглощение сахара и высвобождение жирных кислот, но способствует анаболическому эффекту инсулина в отношении захвата аминокислот тканями.
В течение большей част дня уровень ГР в сыворотке неопределим. Его пики наблюдаются после приема пищи, а во время сна он прогрессивно увеличивается. У растущих детей интегральный суточный уровень ГР выше, чем у взрослых.
ГР находится под двойной гипоталамической регуляцией (табл. 321-3). Его секрецию стимулирует рилизинг-фактор гормона роста (ГРГ, соматокринин) и ингибирует рилизингибиторный гормон гормона роста (соматостатин, соматотропин-рилизингибиторный фактор, СРИФ). Более важную роль играет, очевидно, ГРГ, так как- при перерезке ножки гипофиза секреция ГР снижается. После введения животным антител к ГРГ пики секреции ГР исчезают, рост прекращается. После введения антител к соматостатину секреторные пики ГР сохраняются, но исходный его уровень возрастает. После одновременного введения антител к ГРГ и соматостатину пики исчезают, но исходный уровень растет. Хотя ГРГ и соматостатин содержатся в разных нейронах, их терминали взаимосвязаны.
Рилизинг-фактор гормона роста. ГРГ впервые был выделен из ГРГ-секретирующей аденомы островков поджелудочной железы у больного акромегалией. Ключом к постановке диагноза явилась патоморфологическая картина гипофиза: гиперплазия соматотрофов, а не аденома, характерная для акромегалии. После этого ГРГ был идентифицирован и в гипоталамусе человека.
ГРГ состоит из 44 аминокислот, 29 из которых необходимы для его полной активности. Он принадлежит к семейству молекул, включающему секретин, глюкагон, вазоактивный интестинальный пептид (ВИП) и желудочный ингибиторный пептид (ЖИП). Главным продуцентом ГРГ является дугообразное ядро гипоталамуса, хотя немного ГРГ-нейронов обнаруживается и в вентромедиальном ядре. Аксоны, содержащие ГРГ, проецируются в срединное возвышение и оканчиваются на портальных сосудах ГРГ присутствует и в нормальной поджелудочной железе.
ГРГ стимулирует секрецию ГР in vitro и in vivo. Этот эффект зависит от кальция и опосредуется, по-видимому, циклическим аденозинмонофосфатом (цАМФ). Внутривенное введение ГРГ (0,1—3,3 мкг/кг массы тела) вызывает максимальный выброс ГР на 30—60-й минуте с возвращением к исходному уровню через 2—3 ч (рис. 321 -6). Реакция ГР на ГРГ снижается с возрастом, особенно после 40 лет.
Соматостатин. Циклический тетрадекапептид соматостатин — это не только гипоталамический рилизинг-гормон. Он присутствует во многих других тканях. В гипоталамусе соматостатин образуется в основном в перивентрикулярной и медиальной преоптической областях. Он обнаруживается в нейросекреторных гранулах аксонов, оканчивающихся в срединном возвышении. Кроме того, соматостатин синтезируется и распределяется по всему мозгу, выполняя функцию нейротрансмиттера во многих областях, включая спинной мозг, мозговой ствол и кору головного мозга. Соматостатин присутствует также в желудочно-кишечном тракте. Особые соматостатинсекретирующие клетки (D-клетки) островков поджелудочной железы принимают участие в регуляции секреции инсулина и глюкагона, что служит примером паракринной регуляторной функции соматостатина (см. гл. 327).
Соматостатин образуется в результате процессинга более крупной молекулы предшественника и существует в двух формах: 28- и 14-членного пептида. Соматостатин, состоящий из 28 аминокислотных остатков, обладает большим периодом полужизни и оказыва-
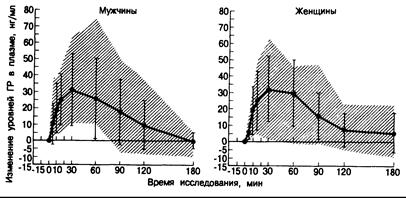
Рис. 321-6. Реакция на ГРГ-44 (1 мкг/кг) у 8 мужчин и 8 женщин.
Заштрихованные области охватывают все разнообразие реакций в каждую временную точку, а вертнкальные линии указываю г значения средних ±1 стандартное отклонение. (Но М. С. GelatoetaL.I.Clm. Endocrinol. Metab., 1984, 59:200.)
ет более мощное ингибирующее действие на секрецию РГ и инсулина. Соматостатин-14 обладает большим сродством к рецепторам гипоталамуса и коры головного мозга и сильнее тормозит секрецию глюкагона. Соматостатин и его аналоги пытаются применять в лечении акромегалии, секретирующих опухолей поджелудочной железы, панкреатита, острых язв желудка и стрессорного гастрита.
Соматостатин тормозит секрецию ГР и снижает его реакцию на средства, усиливающие секрецию. Он снижает также уровень ТТГ в сыворотке крови здорового и больного гипотиреозом человека и ослабляет реакцию ТТГ на ТРГ. Вероятно, именно соматостатин обусловливает вторичный гипотиреоз, развивающийся иногда у детей с недостаточностью ГР, которые получают соматотропин с лечебной целью. Соматостатин слабо влияет на секрецию пролактина, гонадотропинов или АКТГ у здорового человека, но может снижать концентрацию АКТГ у больных с синдромом Нельсона. Соматостатиномы представляют собой редко встречающиеся опухоли из островковых клеток поджелудочной железы или клеток двенадцатиперстной кишки, секретирующие соматостатин (см. гл. 329).
Секреция гормона роста находится под сложным физиологическим контролем (см. табл. 321 -3). Различные факторы действуют, вероятно, через ГРГ и соматостатин. Важное влияние на секрецию ГР по механизму обратной связи оказывает ИФР-1/СМ-С. Повышение концентрации последнего тормозит секрецию ГР как за счет повышения продукции соматостатина, так и благодаря непосредственному влиянию на гипофиз. Снижение уровня ИФР-1/СМ-С, вызываемое голоданием, приводит к компенсаторному усилению секреции ГР.
На секрецию ГР влияют многие нейротрансмиттеры:
1. Гипоталамический дофамин — основной пролактинингибирующий фактор — стимулирует секрецию ГР, способствуя высвобождению ГРГ. Дофамин обладает и прямым, но слабо выраженным угнетающим аффектом на секрецию ГР, хотя этот эффект преодолевается его гипоталамическим действием на секрецию ГРГ. После перорального введения предшественников или агонистов дофамина, способных проникать через гематоэнцефалический барьер (таких как леводопа, апоморфин или бромкриптин), концентрация ГР в сыворотке повышается. Эффект этих соединений можно использовать для тестирования адекватности секреции ГР (резервы ГР).
2. a-Адреиергические агонисты, такие как клонидин, стимулируют секрецию ГРГ и ГР, тогда как a-блокатор фентоламин предотвращает повышение уровня ГР. Ряд стимуляторов ГР, включая инсулиновую гипогликемию, аргинин и физическую нагрузку, действует через a-адренергические механизмы, b-Адренергические блокаторы потенцируют стимулирующий ГР эффект клонидина (и многих других веществ, включая леводопу), возможно, за счет торможения секреции соматостатина.
3. Агонисты серотонина стимулируют секрецию ГР, причем повышение его секреции ночью может быть опосредовано именно серотонином, так как ципрогептадин (антагонист серотонина) блокирует связанное со сном повышение уровня ГР.
При ожирении реакция ГР на многие стимулы, включая сам ГРГ, снижается. После уменьшения массы тела нормальная динамика ГР восстанавливается. Напротив, у лиц с недостаточным питанием, в том числе у женщин с нервной анорексией, концентрация ГР нередко повышена, что обусловлено, вероятно, снижением уровня ИФР- 1/СМ-С. В результате перорального приема глюкозы содержание ГР в сыворотке и его реакция на ГРГ снижаются.
На секрецию ГР влияют и некоторые гормоны. Большинство факторов, стимулирующих секрецию ГР, у женщин действует сильнее, чем у мужчин. Это может быть связано с эффектом эстрогенов. При тестировании резервов ГР у детей может потребоваться предварительное введение эстрогенов, чтобы полностью выявить эти резервы. Хотя эстрогены повышают концентрацию ГР, они в то же время ослабляют его биологический эффект, блокируя продукцию соматомединов. Это напоминает взаимодействия эстрогенов с пролактином, когда секреция гормона усиливается, но его лактогенный эффект ослабляется. Глюкокортикоиды ингибируют секрецию ГР и могут уменьшать также действие соматомединов, что объясняет выраженное угнетение роста у детей, получающих соответствующие препараты.
Избыток гормона роста: акромегалия и гигантизм. Клинические проявлен» я.Избыток ГР приводит к акромегалии — коварной хронической, изнурительной болезни, сопровождающейся чрезмерным ростом костей и мягких тканей (табл. 321 -4). Болеют чаще всего люди среднего возраста. Распространенность акромегалии невелика— 40 случаев на 1 млн, частота— 3 случая на 1 млн в год. При появлении избытка ГР у детей до заращения эпифизарных хрящей увеличивается линейный рост и развивается гигантизм.
У большинства больных отмечают усиленный рост мягких тканей и костей (в связи с чем им требуются перчатки, обувь и головные уборы большего размера), прогнатия, увеличение языка, расхождение зубов и огрубление черт лица. Говорят, что больные акромегалией больше похожи друг на друга, чем на своих родственников (рис. 321-7). В результате гипертрофии гортани и увеличения синусов меняется тембр голоса (он становится глухим). У больных ладони становятся влажными, тестообразными, появляются резкие кожные складки, кожа жирная, развивается папиллярно-пигментная дистрофия кожи.
Таблица 321-4. Проявления акромегалии
| Локализация | Симптомы | |
| субъективные | объективные | |
| Генерализованные | Утомляемость Повышенная потливость Непереносимость тепла Прибавка массы тела | |
| Кожа и подкожные ткани | Увеличение размера кистей, стоп Огрубление черт лица Жирная кожа Гипертрихоз | Влажные, теплые, сырые, тестообразные ладони Свободные складки кожи Утолщение пяток |
| Голова | Головные боли | Увеличение околоушных желез Шишковатый лоб |
| Глаза | Снижение остроты зрения | Дефекты полей зрения |
| Уши | Невозможность ввести зеркало отоскопа | |
| Носоглотка, | Застой в синусах | Увеличенный бороздчатый |
| параназальные синусы | Увеличение размеров языка Неправильный прикус Изменение голоса | язык Следы зубов на языке Широкие щели между зубами Прогнатия |
| Шея | Зоб Обструктивная остановка дыхания во сне Увеличение синусов | |
| Сердечно-легочная система | Застойная сердечная недостаточность | Гипертензия Кардиомегалия Гипертрофия левого желудочка |
| Мочеполовая система | Снижение либидо Импотенция Олигоменорея Бесплодие Камни в почках | |
| Нервная система | Парестезии Повышенная сонливость | Синдром канала запястья |
| Мышцы | Слабость | Проксимальная миопатия |
| Скелет | Боли в суставах (плечи, спина, колени) | Остеоартрит |

Рис. 321-7. Последовательные фотографии больного акромегалией в возрасте 28, 49, 55 и 65 лет (через 6 мес после удаления ГР-секретирующей аденомы).
Видно прогрессирующее увеличение размеров нося и губ. а также кожных складок, особенно носогубных и лобных. (По Reichlin, 1982.)
Акромегалия—это нечто большее, чем просто косметические дефекты. Больные ощущают слабость и утомляемость. Повышается основной обмен, что обусловливает повышенную потливость. Обструктивные остановки дыхания во сне могут быть основной причиной повышенной сонливости. Большинство больных предъявляют жалобы на нарушения со стороны нервной и скелетно-мышечной систем, включая головные боли, парестезии (часто вследствие синдрома канала запястья), мышечная слабость и артралгии (особенно в области плеч, спины и коленей). Гипертрофия хрящей и костные разрастания нередко вызывают дегенеративный артрит. Примерно у 30% больных возникает гипертензия, характеризующаяся сниженной секрецией ренина и альдостерона, что сопровождается увеличением объема плазмы и общего содержания натрия в организме. Почти у всех больных акромегалией с гипертонией и примерно у половины без гипертонии увеличена масса левого желудочка сердца или утолщены его стенки. Хотя неясно, развивается ли при акромегалии специфическая кардиопатия, у таких больных может иметь место застойная сердечная недостаточность в отсутствие каких-либо других ее причин. Размеры многих органов, включая печень и почки, увеличиваются, при этом нет признаков нарушения их функции. Примерно у 25% больных развивается зоб, а у 3%— гипертиреоз. При обследовании некоторые больные предъявляли жалобы на боли в животе, у других выявлены паховые грыжи (и то, и другое примерно у 30% больных). У 10% больных (иногда реже) обнаруживали внутричерепные аневризмы.
У больных акромегалией ожидаемая продолжительность жизни укорачивается. Около 25—50% больных умирали в возрасте 50 лет, а 65—90%—до 60 лет. Повышенная смертность у мужчин связана главным образом с поражением сердечно-сосудистой и дыхательной систем, а у женщин — преимущественно сосудов головного мозга и дыхательной системы. При сопутствующем сахарном диабете смертность возрастает, причем диабет способствует развитию атеросклероза. У таких больных можно было бы предполагать учащение злокачественных новообразований, поскольку акромегалия сопровождается повышением концентрации ростовых факторов в крови. Однако несмотря на то, что, по некоторым данным, частота развития рака действительно была большей среди подобных больных, эта разница не достигала статистически значимого уровня. Складчатость кожи коррелирует с частотой возникновения полипов и, возможно, рака толстого кишечника.
Результаты лабораторных исследований. Инсулинорезистентность имеется у 80% больных акромегалией, хотя нарушение толерантности к глюкозе и клинически явный сахарный диабет встречаются реже (20—40% и 13—20% соответственно). Часто отмечается гиперкальциурия, связанная, по-видимому, с повышением уровня 1,25-дигидроксивитамина D в сыворотке крови; камни в почках имеются примерно у 20% больных. Гиперкальциемия (если она имеется) обусловлена не самой акромегалией, а, по всей вероятности, первичным гиперпаратиреозом как одной из составляющих синдрома множественной эндокринной неоплазии I (МЭН I) (см. гл. 334). ГР каким-то образом усиливает реабсорбцию 4)осфата в почечных канальцах. Почти у 50% больных обнаруживают гиперпролактинемию, что и обусловливает в основном сопутствующую галакторею, аменорею и снижение либидо.
Патофизиология. Почти у всех больных акромегалией и гигантизмом находят четко отграниченные аденомы гипофиза. Чаще они располагаются в латеральных крыльях турецкого седла, где и в норме локализуется множество соматотрофов. Иногда опухоли имеют эктопическую локализацию по линии миграции кармана Ратке: в сфеноидальном синусе или вокруг глотки.
В среднем уровни ГР коррелируют с размерами опухоли. Последние обычно больше у больных молодого возраста, что указывает на более быстрый их рост у представителей этой возрастной группы. К моменту установления диагноза 75% соматотропином — макроаденомы, тогда как 60% или больше пролактином к этому моменту остаются микроаденомами. Тщательный скрининг на акромегалию с учетом малейших клинических признаков мог бы способствовать ранней диагностике заболевания, когда опухоли еще не достигают больших размеров.
Иммуногистохимическое окрашивание и электронная микроскопия соматотропином помогают прогнозировать их эволюцию. У больных с плотно гранулированными опухолями акромегалия протекает типично, с медленным неагрессивным ростом аденомы. Скудно гранулированные опухоли также вызывают акромегалию, но растут быстрее и часто внедряются в стенки турецкого села или распространяются за его пределы. Смешанные ГР- и пролактинсекретирующие аденомы содержат как соматотрофы, так и лактотрофы. Такие смешанно-клеточные опухоли вызывают акромегалию, сопровождающуюся умеренным повышением уровня пролактина, и обычно не обладают агрессивным ростом. В отличие от этого аденомы из ацидофильных стволовых клеток, часть которых окрашивается и на ГР, и на пролактин, состоят из малодифференцированных предшественников соматотрофов и лактотрофов. Такие опухоли растут быстро, часто инвазируют соседние ткани и сопровождаются выраженной гиперпролактинемией. Хотя клетки и окрашиваются па ГР, клинические признаки акромегалии обычно отсутствуют. Высокодифференцированная ацидофильная аденома также содержит клетки, окрашивающиеся на ГР и пролактин, но растет, по-видимому, медленно, представляя собой более зрелый вариант аденомы из стволовых клеток. В этом случае имеется акромегалия с тем или иным повышением концентрации пролактина. Карциномы, секретирующие гормон роста, встречаются редко, и этот диагноз следует ставить только при наличии отдаленных метастазов. Опухоли с местным инвазивным ростом называют инвазивными аденомами.
Хотя считается, что акромегалия может обусловливаться избытком гипоталамического ГРГ или дефицитом соматостатина, у большинства больных акромегалией на самом деле выявляют первичную патологию гипофиза. К доказательствам гипофизарной этиологии заболевания относятся низкий уровень ГРГ в сыворотке больных акромегалией, отсутствие гиперплазии соматотрофов вне аденомы и восстановление динамики ГР после успешного удаления соматотрофной аденомы.
Акромегалия, вызываемая ГРГ, встречается редко (менее 1%, по современным данным). Об этом диагнозе следует думать при гистологическом выявлении гиперплазии гипофизарных соматотрофов, а не аденомы. Наиболее вероятными источниками избытка ГРГ являются бронхиальный карциноид и инсулома. Гиперплазию соматотрофов с акромегалией может вызывать и ГРГ, продуцируемый гипоталамическими ганглиоцитами, которые способны вырабатывать и соматостатин. Судя по результатам иммунологического окрашивания, ГРГ содержится и в ряде других опухолей (включая мелкоклеточный рак легких, медуллярный рак щитовидной железы и карциноид тимуса), но в каком количестве он секретируется этими опухолями, неизвестно. Такие опухоли обычно сопровождаются эктопической продукцией и АКТГ.
Эктопическая продукция ГР наблюдается редко, но все же описана у больного с инсуломой. Размер опухоли в данном случае (420 г) указывал на выработку биологически неактивного ГР, поскольку вызывающие акромегалию ГР-секретирующие опухоли гипофиза обычно невелики.
Диагностика. Симптомы акромегалии существуют у больных в среднем 7—8 лет, прежде чем будет установлен правильный диагноз. Зачастую в это время больные безуспешно переходят от одного врача к другому. Независимый консультант скорее поставит правильный диагноз, чем семейный врач или члены семьи, которые могут не замечать медленного прогрессирования болезни. Если окружающие заметят характерные изменения черт лица больного, то полезно сравнить их со старыми фотографиями (см. рис. 321-7).
Базальный уровень ГР, особенно при разовых определениях, может быть повышен и у здорового человека, в частности у физически активных женщин, и эти результаты не следует использовать для скрининга акромегалии. Нужно проводить функциональные тесты на способность к снижению секреции ГР. Стандартный скрининг-тест заключается в определении концентрации ГР в сыворотке крови через 60— 120 мин после перорального приема 100 г глюкозы. Нормальной реакцию обычно считают тогда, когда концентрация ГР оказывается ниже 5 нг/мл, хотя более строгим критерием является величина менее 2 нг/мл. У больных акромегалией уровень ГР после приема глюкозы, как правило, превышает 10 нг/мл, но у некоторых он может быть ниже 5 нг/мл и лишь очень редко — ниже 2 нг/мл.
Концентрация РГ при акромегалии может колебаться в течение суток, хотя никогда не становится неопределимой, как у здоровых людей. После приема глюкозы уровень ГР у больных обычно не изменяется или даже возрастает, но у некоторых может и снижаться. У большинства больных акромегалией уровень ГР в ответ на инсулиновую гипогликемию и введение аргинина увеличивается, а реакция на ГРГ усиливается. Введение соматостатина снижает концентрацию ГР, но обычно не до нормального уровня. Кроме того, ГР-секретирующие опухоли гипофиза реагируют и на. те стимулы, которые не влияют на нормальные соматотрофы: у большинства больных (80%) уровень ГР возрастает при введении ТРГ, а примерно у 10—15%—и в ответ на введение Л ГРГ. Агонисты дофамина стимулируют секрецию ГР у здоровых лиц, но снижают ее у 75% больных акромегалией. Стимуляция под действием ТРГ и торможение под влиянием агонистов дофамина чаще характерны для тех соматотрофных опухолей, которые одновременно секретируют и пролактин.
Целесообразно определять содержание ИФР-1/СМ-С в сыворотке, хотя клинический опыт таких определений ограничен. Концентрация соматомедина, по-видимому, коррелирует с активностью болезни даже у тех больных, у которых базальная концентрация ГР не достигает 10 нг/мл. У больных акромегалией уровни ИФР-1/СМ-С обычно превышают 2,6 ед/мл, тогда как у здоровых лиц они, как правило, ниже 1,4 ед/мл. Содержание ИФР-1/СМ-С плохо коррелирует с базальной концентрацией ГР, но достаточно хорошо — с толщиной пяток и гликемией натощак. При наблюдении за больными акромегалией после лечения определения ИФР-1/СМ-С менее ин4юрмативны.
У всех больных с крупными аденомами гипофиза следует определять ГР, лучше после приема глюкозы. Крайне редко повышение уровней ГР и ИФР-1/СМ-С в сыворотке не сопровождается клиническими проявлениями акромегалии. Такой синдром пока не имеет объяснения.
В каждом случае, когда лабораторные тесты подтверждают клиническое подозрение на акромегалию, необходимо производить рентгенологическое исследование. При обычной рентгенографии черепа и, в частности, турецкого седла обнаруживают отклонения у 90% больных акромегалией. КТ-сканирование или МРГ позволяют точнее определить размеры опухоли и необходимы для разработки плана лечения. При обычной рентгенографии черепа можно обнаружить также утолщение костей черепа с увеличением плотности кости, расширение параназальных пазух, пролиферацию воздушных клеток сосцевидного отростка, прогнатию, если на снимке получено и изображение челюстей. Эти дополнительные данные свидетельствуют в пользу диагноза акромегалии. На рентгенограммах можно видеть увеличение тел позвонков с передними остеофитами, выросты концевых фаланг пальцев конечностей, утолщение и удлинение ребер и ключиц, а также изогнутость бедренных, большеберцовых и малоберцовых костей. При рентгеноскопии мягких тканей видно утолщение пяток (более 18 мм у женщин и 21 мм у мужчин).
На определенном этапе обследования у всех больных акромегалией следует проверять функцию передней доли гипофиза для исключения гипопитуитаризма и гиперпролактинемии. Крупные соматотрофные аденомы часто сопровождаются неврологической симптоматикой. Кроме того, акромегалия может сочетаться с гиперпаратиреозом и инсуломами при синдроме МЭН I и реже— с феохромоцитомой или альдостеромой. При акромегалии иногда повышается секреция альфа-субъединицы гликопротеидных гормонов, что может служить дополнительным маркером возобновления роста опухоли.
Лечение. При лечении больных в первую очередь необходимо восстановить нормальный уровень ГР, стабилизировать или уменьшить размер опухоли и сохранить нормальную функцию гипофиза. Применяющиеся в настоящее время методы обладают различной эффективностью, и ни один из них не совершенен. Хотя уровни ГР ниже 5 нг/мл нередко считают доказательством излечения, лучше ориентироваться на уровни ниже 2 нг/мл, так как при концентрациях ГР между 2 и 5 пг/мл у больных могут сохраняться симптомы заболевания и повышенное содержание ИФР-1/СМ-С.
Преимуществом транссфеноидальной операции является быстрый лечебный эффект, и ее рассматривают как средство выбора. Уже через несколько часов концентрация ГР снижается до нормы, объем мягких ткан
Дата добавления: 2016-03-05; просмотров: 1057;
