Клеточные механизмы сердечного сокращения
Миокард состоит из отдельных поперечнополосатых мышечных клеток (волокон), диаметр которых в норме составлят 10—15 мкм, а длина — 30—60 мкм (рис. 181-1, а). Каждое волокно включает в себя множество пересекающихся и соединенных между собой нитей (миофибрилл), которые идут на всем протяжении волокна и в свою очередь состоят из периодически повторяющихся структур — саркомеров. В цитоплазме между миофибриллами располагаются одно центрально расположенное ядро, многочисленные митохондрии и внутриклеточные системы мембран.
Каждый саркомер, являющийся структурной и функциональной единицей сокращений, ограничен с двух сторон темными линиями, так называемыми Z-линиями (см. рис. 181-1). Расстояние между Z-линиями зависит от степени сокращения или растяжения мышц и варьирует от 1,6 до 2,2 мкм. Внутри саркомера можно видеть чередующиеся светлые и темные полосы, придающие волокнам миокарда характерный исчерченный вид. В центре саркомера расположена широкая темная полоса постоянной ширины (1,5 мкм) — А-полоса, с двух сторон ее окружают две более светлые I-полосы, ширина которых может меняться. Саркомер сердечной мышцы, так же как и скелетной, построен из миофиламентов двух типов. Более толстые филаменты, состоящие главным образом из белка миозина, идут в продольном направлении и ограничиваются А-полосами. Их диаметр около 100 А, длина— 1,5—1,6 мкм; к периферии они сужаются. Тонкие филаменты состоят прежде всего из актина. Они протянуты между Z-линиями и проходят через I-и А-полосы Диаметр их составляет приблизительно 50 А, длина 1,0 мкм. Таким образом, толстые и тонкие филаменты накладываются друг на друга только в пределах полос А, полосы I содержат исключительно тонкие филаменты (см. рис. 181-1). При электронной микроскопии можно обнаружить, что между толстыми и тонкими филаментами, проходящими в полосе А, тянутся поперечные мостики.
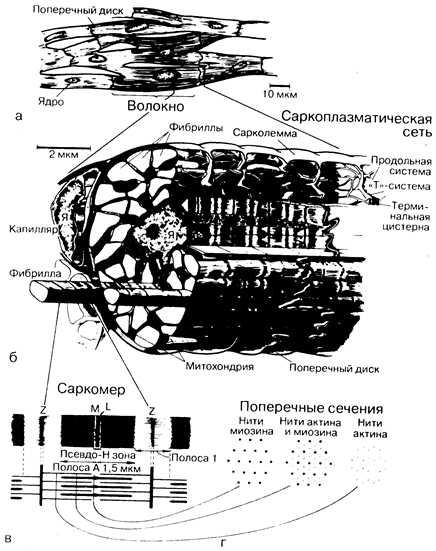
Процесс сокращения. «Скользящая» модель мышечного сокращения основана на фундаментальном положении о том, что длина как толстых, так и тонких филаментов остается постоянной и в покое, и во время сокращения. При активации саркомера нити актина и миозина начинают взаимодействовать между собой на уровне соединяющих мостиков, в результате чего нити актина продвигаются глубже внутрь полосы А. В течение всего сокращения ширина полосы А остается постоянной, в то время как полоса I становится уже, а линии Z двигаются по направлению друг к другу.
Молекула миозина представляет собой сложный, асимметричный волокнистый белок с мол. массой около 500000. Она состоит из части, похожей на удочку, длина которой составляет 1500 А, и глобулярной части, расположенной на ее конце. Эта глобулярная часть миозина обладает аденозинтрифосфатной (АТФ-азной) активностью и также участвует в образовании мостиков между миозином и актином. Удлиненная часть молекулы миозина формирует толстый миофиламент. Она располагается строго в одну линию с такими же частями других молекул миозина, и они все ориентированы в одном направлении. При этом глобулярная часть молекулы отклоняется в сторону, так что получает возможность взаимодействовать с актином, генерируя энергию и вызывая сокращение (рис. 181-2, а). Мол. масса актина 47000. Тонкие филаменты состоят из двойных спиралей, формируя две цепи молекул актина, переплетенных между собой и тесно связанных с регуляторными белками — тропомиозином и тропонином (см. рис. 181-2,6). Последний может быть разделен на три компонента: тропонины С, I и Т (см. рис. 181-2, в). В отличие от миозина актин не обладает существенной энзиматической активностью, однако он способен обратимо связываться с миозином в присутствии АТФ и ионов магния, которые активируют АТФ-азу миозина. В расслабленной мышце это взаимодействие подавляется тропомиозином. Во время активации ионы кальция присоединяются к тропонину С, что приводит к конформационным изменениям, в результате которых связывающие мостики актина перемещаются кнаружи и становятся доступными для взаимодействия. Физические изменения в связывающих мостиках вызывают скольжение актина вдоль нитей миозина, что неизбежно приводит к укорочению мышцы или развитию напряжения. Расщепление АТФ сопровождается диссоциацией соединяющих мостиков между миозином и актином. Образование и разрыв связей между нитями актина и миозина происходят циклично в соответствии с колебаниями концентрации ионов Са. Связи нарушаются, когда концентрация ионов Са снижается ниже критического уровня, а комплекс тропонин — тропомиозин предотвращает взаимодействия между соединительными мостиками миозина и нитями актина. Ионизированный кальций служит основным медиатором, регулирующим инотропное состояние сердца. Большинство препаратов, усиливающих инотропную функцию миокарда, включая сердечные гликозиды и катехоламины, опосредуют свое действие через повышение доставки ионов кальция к миофиламентам.
Саркоплазматическая сеть (см. рис. 181-1,6) представляет собой сложную цепь соединенных между собой мембранных внутриклеточных каналов, обволакивающую миофибриллы. Однако в клетках сердечной мышцы саркоплазматическая сеть менее развита, чем в клетках скелетных мышц. Она состоит из множества продольно расположенных переплетенных между собой мембранных канальцев, тесно прилегающих к поверхности каждого саркомера. Саркоплазматическая сеть не имеет непосредственного продолжения за границами клетки. С саркоплазматической сетью тесно, как функционально, так и структурально, связана система поперечных канальцев, или Т-система, образованная каналоподобными выпячиваниями сарколеммы, которые проникают внутрь миокардиального волокна вдоль Z-линий, т. е. концевых частей саркомеров.
Активация клеток миокарда. В покое клетка миокарда поляризована. т. е. внутренняя поверхность мембраны имеет отрицательный заряд по отношению к наружной поверхности. При этом трансмембранный потенциал составляет от —80 до --100 мВ (гл. 183). Главную роль в создании этого потенциала покоя играет сарколемма, которая в состоянии покоя практически непроницаема для ионов Na и имеет натрий-калийзависимый насос, изгоняющий ионы Na из клетки. Для работы этого насоса требуется аденозинтрифосфат (АТФ). Таким образом, внутри клетки накапливается относительно большое количество ионов К и значительно меньше ионов Na, в то время как внеклеточная среда богата ионами Nа и бедна ионами К. В свою очередь в состоянии покоя количество ионов Са вне клетки значительно превышает содержание свободных ионов Са внутри нее.
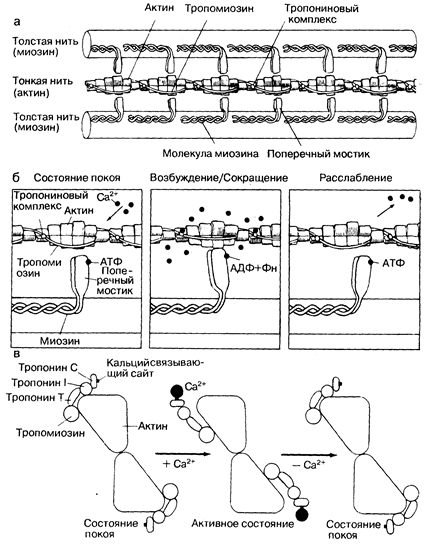
Рис.181-2. Схематически показано взаимодействие сократительных белков, а также роль кальция как активирующего посредника. а — показано относительное расположение сократительных (миозина и актина) и регуляторных белков (тропонинового комплекса и тропомиозина) в миофиламенте; б — сокращение происходит, когда головки молекул миозина, образующие поперечные мостики толстых нитей, связываются с актином. Затем меняется ориентация поперечных мостиков, что приводит к смещению тонких нитей но направлению к центру саркомера. Для активации необходимо связывание ионов Са с тропониновым комплексом, в результате чего снимается тормозящее влияние связи миозина и актина. Одной из серий химических реакций, лежащих в основе мышечного сокращения, является гидролиз АТФ, вызывающий смещение поперечных мостиков. Релаксация наступает после того, как ионы Са2+ отщепляются от тропонина; в — молекулярная перестройка на уровне тонких нитей затрагивает регуляторные белки (тропомиозин и гропонины С, I и Т) и заключается в их аллостерических изменениях. Связываясь с тропонином С, кальций ослабляет связь между тропонином I и актином. Развивающаяся диссоциация тропонина Т и актиновоп основы тонких нитей приводит к смещению тропомиозина таким образом, что его активные участки становятся доступными для взаимодействия с миозином. С разрешения: А. М. Katz, V. Е. Smith. Hosp. Proc., 1984, 19 (1), 69. |
Во время плато потенциала действия (фаза 2) отмечается медленный ток электрических зарядов внутрь клетки. Он прежде всего обусловлен движением ионов Са (рис. 181-3), хотя абсолютные количества .этого иона, пересекающие поверхностную мембрану, относительно малы и сами по себе не могут вызвать полноценную активацию контрактильного аппарата. Деполяризующий ток зарядов распространяется не только по поверхности клетки, но и проникает глубоко в нее, что обеспечивается разветвленной Т-системой. Следствием транссарколеммального движения ионов Са является высвобождение значительно больших его количеств из саркоплазматической сети. Этот процесс получил название «регенеративного высвобождения» ионов Са.
Ионы Са диффундируют по направлению к саркомеру и, как было описано выше, связываются с тропонином, блокируя этот ингибитор сокращения, и активируют миофиламенты, вызывая сокращение. Затем ионы Са вновь накапливаются в саркоплазматической сети, что, естественно, влечет снижение концентрации этого иона в миофибриллах до уровня, при котором взаимодействие актина и миозина между собой, лежащее в основе сокращения, становится невозможным. Таким образом происходит расслабление мышцы. Очевидно, что в основе периодически сменяющихся сокращений и расслаблении сердечной мышцы лежит способность клеточной мембраны, поперечных канальцев и саркоплазматической сети распространять в пространстве потенциал действия, высвобождать и вновь накапливать ионы Са.
Основным источником энергии, обеспечивающей практически всю механическую работу по сокращению клеток миокарда, служит АТФ, образующийся при субстратном окислении. Запасы высокоэнергетических фосфатов равномерно распределяются между АТФ и креатинфосфатом. Активность миозин-АТФазы определяет скорость образования и распада соединенных мостиков между актином и миозином, а следовательно, и скорость сокращения мышцы.
Значение длины мышцы. Сила сокращения поперечнополосатой мышцы любого типа, включая и сердечную мышцу, зависит от ее исходной длины. Наиболее мощное сокращение саркомера наблюдают при длине 2,2 мкм. Именно при такой длине саркомера расположение обоих видов миофиламентов по отношению друг к другу наиболее благоприятно для их взаимодействия. Фактом, подтверждающим гипотезу скольжения миофиламентов, является уменьшение создаваемой силы прямо пропорционально уменьшению площади соприкосновения толстых и тонких нитей, а следовательно, и количеству реактивных участков. Имеются данные о том, что длина саркомера определяет также степень активности контрактильной системы, т. е. степень ее чувствительности к ионам Са. Максимальная активность установлена при длине саркомера 2,2 мкм. Если длина саркомера увеличивается до 3,65 мкм, то создаваемое напряжение падает до нуля, а тонкие нити полностью выходят за пределы А-полосы. С другой стороны, если длина саркомера менее 2,0 мкм, то происходит скручивание тонких нитей и их двойной перегиб. Одновременно снижается чувствительность контрактильных локусов к ионам Са, а следовательно, и сила сокращения.
Зависимость развиваемой силы сокращения от исходной длины мышечных волокон является решающим фактором, определяющим функцию сердечной мышцы. Она лежит в основе правила Франка — Старлинга (закона сердца Старлинга), которое утверждает, что в определенных границах увеличение исходного объема желудочка, являющегося производным от длины мышцы, приводит к усилению сокращения желудочка. Было установлено, что в сердечной мышце длина саркомера прямо пропорциональна длине мышцы. Эта зависимость соответствует восходящему колену кривой «длина — активное напряжение мышцы». По мере уменьшения длины мышцы до того момента, когда создаваемое напряжение приближается к нулю, а длина саркомера — к 1,5 мкм, I-полосы сначала сужаются, а затем и вовсе исчезают, в то время как ширина А-полос остается постоянной. В этот момент Z-линии упираются в края А-полос. Таким образом, кривая зависимости силы активного напряжения мышцы от длины саркомера отражает ультраструктурный механизм Старлинга для мышцы сердца.
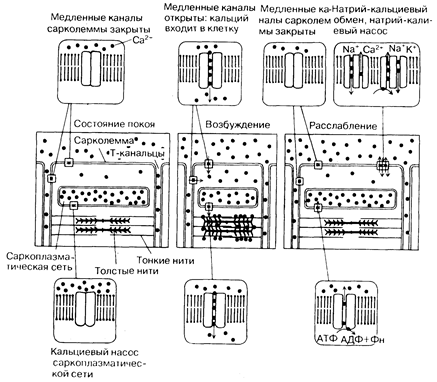
Рис.181-3. Схема движения ионов кальция. Кальциевые токи, активирующие мышечное сокращение, направлены вниз, вызывающие расслабление мышц — вверх. Как видно, в покое кальциевые каналы мембран сарколеммы клеток сердечной мышцы закрыты, а внутриклеточный кальций находится в саркоплазматической сети. При возбуждении и деполяризации мембраны натриевые каналы (не показаны), чувствительные к изменению электрического напряжения, и кальциевые каналы сарколеммы открываются, обусловливая быстрое поступление в клетку внеклеточного натрия и кальция. В настоящее время считается, что вхождение ионов Са в клетку извне вызывает его высвобождение из саркоплазматической сети, что и индуцирует сокращение. Необходимым условием расслабления сердечной мышцы является повторный захват кальция АТФ-зависимым кальциевым насосом, расположенным в саркоплазматической сети. Важно то, что сокращение активируется главным образом пассивным током ионов Са из саркоплазматической сети. Напротив, во время диастолы кальций должен активно выкачиваться из цитозоля, обеспечивая возможность релаксации. Во время диастолы также затрачивается энергия на восстановление градиентов концентраций натрия и кальция по обе стороны сарколеммы, что необходимо для обеспечения деполяризующих ионных токов, участвующих в генерации потенциала действия. Транспорт ионов Na осуществляется сарколеммальным натриевым насосом (натрия-калиевая АТФаза), использующим энергию АТФ для выкачивания натрия из клетки в обмен на калий. Образующийся в результате градиент концентрации натрия и является основным фактором, обеспечивающим активный транспорт ионов Са из клетки во время релаксации посредством натрий-кальциевого обмена. [С разрешения из: А. М, Katz, V. Е. Smith. — Hosp. Ргос., 1984, 19 (1), 69.]
Дата добавления: 2016-03-05; просмотров: 1080;
