ГЛАВА 129. ПРИНЦИПЫ ПРОТИВОВИРУСНОЙ ХИМИОТЕРАПИИ
Рафаэл Долин (Raphael Dolin)
Введение. Использование противовирусных соединений для химиотерапии и химиопрофилактики вирусных болезней представляет собой относительно новый раздел в учении об инфекционных болезнях, особенно если сравнить его с более чем 40-летним опытом использования противобактериальных антибиотиков. Принципы, лежащие в основе применения противовирусных соединений, были смоделированы после успешного использования препаратов для лечения бактериальных инфекций, что показано в гл. 88. Однако приложение этих принципов к противовирусной химиотерапии и химиопрофилактике сталкивается с рядом специфических проблем.
Во-первых, противовирусные соединения должны обладать избирательностью высокой степени, что обусловлено биологическими свойствами вирусов. Бактерии могут размножаться вне клетки и использовать для этого метаболические и структурные механизмы, значительно отличающиеся от тех, которые действуют в клетках млекопитающих. Однако вирусы размножаются только внутри клетки и часто эксплуатируют для синтеза вирусных частиц ферменты, макромолекулы и органеллы клетки-хозяина. В связи с этим безопасные и эффективные противовирусные соединения должны с высокой степенью надежности различать клеточные и вирусспецифические функции. Ингибиторы вирусной репликации, не обладающие такой селективностью, скорее всего, будут слишком токсичны для клинического применения.
Во-вторых, учитывая природу вирусной репликации, оценка чувствительности выделенных вирусов к противовирусным препаратам, проводимая в условиях in vitro, должна выполняться в сложной культуральной системе, состоящей из живых клеток (культура ткани). Результаты таких исследований варьируют в широких пределах и зависят от типа клеток используемой тканевой культуры и от условия проведения эксперимента. Кроме того, точная связь между чувствительностью изолированных вирусов in vitro и исходом противовирусной терапии еще до конца не изучена.
В-третьих, информация о фармакокинетике противовирусных препаратов, в частности в различных клинических условиях, ограничена, в особенности если сравнить ее с имеющимися данными о фармакокинетике антибактериальных антибиотиков. Для таких препаратов, как ацикловир, имеется много предварительных фармакокинетических данных. В то же время для других (ремантадин) объем существующей информации ограничен. Методы определения концентраций противовирусных препаратов, в частности их активных форм внутри клеток, не имеют еще широкого распространения. Имеется лишь несколько положений, в соответствии с которыми следует подбирать дозы препаратов для достижения максимальной противовирусной активности при минимальной токсичности. В связи с этим клиническое использование противовирусных веществ должно сочетаться с постоянной готовностью к возникновению побочных эффектов или токсических осложнений.
В-четвертых, очевидно, что чрезвычайно сложная система защиты организма хозяина играет важнейшую роль в течении вирусной инфекции. Наличие или отсутствие предшествующего иммунитета и способность обеспечить гуморальный и/или клеточный иммунный ответ являются особенно важными детерминантами исхода вирусной инфекции. Например, глубокая иммуносупрессия может привести к развитию инфекции, при которой имеет место длительная вирусная репликация. Подавление вирусной репликации в этом случае с помощью противовирусного препарата может быть особенно эффективной. С другой стороны, если защитные механизмы макроорганизма глубоко угнетены, как, например, после пересадки костного мозга, противовирусная терапия может быть сравнительно неэффективна. При использовании или изучении эффективности противовирусных препаратов необходимо учитывать состояние защитных механизмов макроорганизма и их взаимодействие с противовирусными соединениями.
В заключение, как и при противобактериальной терапии, оптимальное использование противовирусных соединений требует точного и своевременного диагноза. При некоторых вирусных инфекциях, таких как опоясывающий герпес, проявления болезни настолько характерны, что диагноз может быть поставлен только на основании клинических данных. При других вирусных инфекциях, таких как грипп А, для постановки предварительного диагноза с высокой степенью точности может быть использована эпидемиологическая информация (например, сведения о массовых вспышках заболеваний). Однако при большинстве вирусных инфекций, включая энцефалит, вызванный вирусом простого герпеса, цитомегаловирусную инфекцию и острый вирусный гастроэнтерит, диагноз только на основании клинических данных не может быть поставлен с достаточной надежностью. Для этих случаев крайне необходимы быстрые, неинвазивные диагностические методы. Для создания таких тестов прилагаются значительные усилия.
Несмотря на описанные выше сложности, эффективность нескольких противовирусных соединений была однозначно установлена в тщательно проведенных и контролируемых исследованиях. Соединения, которые уже имеются в настоящее время или станут доступны уже в недалеком будущем, обсуждаются ниже, и сведения о них суммированы в табл. 129-1.
Амантадин (мидантан) и ремантадин. Амантадин (1-адамантанамина гидрохлорид) и тесно связанное с ним соединение ремантадин (альфа-метил-1-адамантил-метиламина гидрохлорид) — это первичные симметричные амины, противовирусная активность которых ограничена вирусами гриппа А. Они угнетают репликацию вируса гриппа А на неизвестной пока стадии, которая следует за присоединением вируса к клетке. Это либо вмешательство в процесс раздевания вируса, либо нарушение первичной транскрипции вирусной РНК. В нескольких экспериментальных исследованиях установлено, что ремантадин в 2—4 раза более активен, чем амантадин по отношению к изолированным вирусам гриппа А.
Таблица 129-1. Противовирусная химиотерапия и химиопрофилактика
| Инфекция | Противовирусный препарат | Путь введения | Доза | Комментарии |
| Грипп А (профилактика) | Амантадин | Перорально | Взрослые: 200 мг/сут в период риска. Дети не старше 9 лет: 4,4—8,8 мг/кг в сут, но не более 150 мг/сут | Следует вводить на протяжении вспышки. Дозу следует снижать при почечной недостаточности и у лиц пожилого возраста. Можно вводить вместе с вакциной |
| Ремантадин | Перорально | Так же | До настоящего времени не разрешен к применению. Переносится лучше, чем мидантан | |
| Грипп А (лечение) | Амантадин | Перорально | Так же в течение 5—7 дней | Как мидантан, так и ремантадин эффективны при неосложненном гриппе. Неэффективны при осложненном гриппе (пневмония) |
| Ремантадин | Перорально | Так же в течение 5—7 дней | Изучаются возможности лечения осложненного гриппа в плацебо — контролируемом исследовании | |
| Инфекция, вызванная PC-вирусом | Рибавирин | В виде аэрозоля | Вводят постоянно в виде мелкодисперсного аэрозоля из резервуара объемом 20 мг/мл в течение 3—6 дней | Используется для лечения детей раннего и старшего возраста, госпитализированных по поводу пневмонии, вызванной PC-вирусом, и бронхиолита |
| Энцефалит, вызванный вирусом простого герпеса | Ацикловир | Внутривенно | 10 мг/кг каждые 8 ч в течение 10 дней | Ацикловир является препаратом выбора при этой инфекции, по данным сравнительного с видарабином исследования. Оптимальные результаты получают, если лечение начато на ранних стадиях заболевания |
| Видарабин | Внутривенно | 15 мг/кг в день в виде постоянной инфузии длительностью 12 ч в течение 10 дней | ||
| Инфекция новорожденных, вызванная вирусом | Видарабин | Внутривенно | 30 мг/кг в сутки в виде постоянной инфузии длительностью 12 ч в тече- | Вндарабин снижает уровень смертности, однако возможна тяжелая инвалидиза- |
| простого гер-песа | Ацикловир | Внутривенно | ние 10 дней 10 мг/кг каждые 8 ч в течение 10 дней | ция. В настоящее время проходят клинические испытания по сравнению с ацикловиром |
| Первичная генитальная инфекция, вызванная вирусом простого герпеса | Ацикловир | Внутривенно | 5 мг/кг каждые 8 ч в течение 5— 10 дней | При тяжелой инфекции, требующей госпитализации, или при неврологических осложнениях предпочтителен внутривенный путь введения |
| Перорально | 200 мг 5 раз в сутки в течение 10 дней | Предпочтительный путь введения у пациентов, не требующих госпитализации. Необходимо поддерживать адекватную гидратацию | ||
| Местное применение | 5% мазь: 4—6 аппликаций в сутки в течение 7—10 дней | В основном замещена пероральной терапией. Может быть целесообразна у беременных женщин во избежание системного приема. Не влияет на системные симптомы и области, на которые мазь не апплициро-вали | ||
| Рецидив ге-нитальной инфекции, вызванной вирусом простого герпеса (лечение) | Ацик-ловир | Перорально | 200 .мг 5 раз в сутки в течение 5 дней | Клинический эффект незначителен и усиливается, если лечение начато своевременно. Не влияет на частоту последующих рецидивов |
| Рецидив ге-нитальной инфекции, вызванной вирусом простого герпеса (подавление) | Ацик-ловир | Перорально | 200 мг 3—5 раз в сутки в течение длительного времени (до 6 мес) | Супрессивная терапия продолжительностью до 6 мес рекомендуется только для пациентов с частыми рецидивами — не менее 6—10 раз в год. Иногда возможно бессимптомное выделение вируса во внешнюю среду. В настоящее время происходят исследования по изучению длительной супрессивной терапии |
| Инфекция кожи и слизистых оболочек, вызванная вирусом простого герпеса у больных с ослабленным иммунитетом (лечение) | Ацик-ловир | Внутривенно Перорально Местное применение | 250 мг/м2 каждые 8 ч в течение 7 дней 200 мг 5 раз в сутки в течение 10 дней 5% мазь: 4—6 аппликаций в день в течение 7 дней или до заживления | Выбор пути введения препарата зависит от тяжести инфекции и возможности пациента принимать препарат перорально Пероральное и внутривенное введение вытеснили местное использование. Исключение составляют небольшие, легкодоступные поражения |
| Вида-рабин | Внутривенно | 10 мг/кг в сутки в течение 7 дней в виде инфузии длительностью 12 ч | Эффективность этого метода была установлена при ВПГ-1 и у больных в возрасте старше 40 лет. Но в этих случаях более целесообразно использовать ацикло-вир | |
| Инфекция кожи и слизистых оболочек, вызванная вирусом простого герпеса у больных с ослабленным иммунитетом (профилактика рецидивов в периоды наибольшей иммуно-супрессии) | Ацик-ловир | Перорально Внутривенно | 200 мг 4 раза в сутки 5 мг/кг каждые 12 ч | Ацикловир вводят в периоды ожидаемой интенсивной иммуно-супрессии, например во время противоопухолевой химиотерапии, после трансплантации. После прекращения лечения поражения возникают вновь |
| Простой гер-петический кератит | Трифлюоротиидин | Местное применение | Одна капля 0,1% офтальмологического раствора каждые 2 ч | Терапию следует проводить после консультации с офтальмологом |
| Во время бодрствования (максимальная доза 9 ка | ||||
| Видарабин | Местное приме- | пель в день) Полоска 0,5 дюйма 0,5% глазной мази 5 раз в сут- | См. выше | |
| Ветряная оспа у больных с ослабленным иммунитетом | Ацикловир | Внутри-венно | 500 мг/м2 каждые 8 ч в течение 7 дней | Исследования, сравнивающие эффективность ацикловира и видарабина при лечении ветряной оспы, не проводились. Ограниченное число плацебо-контролируемых исследований свидетельствует о сходстве действия обоих препаратов |
| Видарабин | Внутривенно | 10 мг/кг в сутки в виде инфузии длительностью 12 ч в течение 5 дней | ||
| Опоясывающий герпес у больных с ослабленным иммунитетом | Ацикловир Видарабин | Внутривенно Внутривенно | 500 мг/м2 каждые 8 ч в течение 7 дней 10 мг/кг в день в виде инфузии длительностью 12 ч в течение 5 дней | Эффективность ацикловера и видарабина изучали при локализованном герпе-се, в частности на ранних стадиях заболевания. Ацикловир оказался более эффективным. В настоящее время проводятся исследования по изучению их эффективности при генерализованном опоясывающем герпесе. Кроме того, проводятся исследования по изучению перорального приема ацикловира при опоясывающем герпесе при нарушениях иммунной системы и у «здорового» хозяина |
Было показано, что амантадин и ремантадин эффективны при проведении профилактики гриппа А в широких масштабах у людей молодого возраста. У детей и лиц пожилого возраста эффективность их ниже. Успех профилактики гриппоподобных заболеваний в этих исследованиях составлял 55—80%, а при подсчете динамики вирусспецифических атак эти показатели были еще выше. Было показано, что амантадин и ремантадин эффективны и при лечении гриппа А. Эти исследования были выполнены главным образом у лиц молодого возраста и в меньшей степени у детей. Введение указанных препаратов в течение 24— 72 ч после начала заболевания приводило к уменьшению выраженности симптомов его приблизительно на 50% по сравнению с плацебо-группой. Установлено, что эти изменения были более выражены, чем при использовании обычных антипиретиков и анальгетиков. Существуют отдельные сообщения, касающиеся также эффективности амантадина и ремантадина при профилактике и лечении осложнений гриппа (пневмония).
Имеются только пероральные препараты амантадина и ремантадина. Назначают препараты взрослым по 200 мг/сут 1—2 раза в день. Несмотря на структурное сходство, фармакокинетика обоих соединений различна. Амандатин не метаболизируется в организме и практически полностью выводится почками. Период полувыведения составляет 12—17 ч, максимальная концентрация в плазме— 0,4 мкг/мл. Ремантадин подвергается значительному метаболизму до гидроксилированных дериватов. Период полувыведения его составляет 30 ч. Только 30% перорально введенной дозы обнаруживают в моче. Однако ремантадин в большей степени, чем амантадин, накапливается в секрете дыхательных путей. В профилактических целях этот препарат следует вводить ежедневно на протяжении всего периода повышенного риска (продолжительность периода вспышки). С лечебной целью амантадин или ремантадин рекомендуется принимать в течение 5—7 дней.
Несмотря на то что эти вещества в целом хорошо переносятся пациентами, у 5—10% получивших амантадин развились побочные реакции со стороны центральной нервной системы умеренной степени выраженности, включавшие прежде всего головокружение, беспокойство, бессонницу и затруднение концентрации внимания. Эти побочные эффекты быстро исчезали после прекращения приема препарата. При приеме по 200 мг в сутки ремантадин переносился пациентами лучше, чем амантадин. Результаты проведенного широкомасштабного исследования у лиц молодого возраста показали, что побочные реакции у больных, получавших ремантадин, развивались не чаще, чем у лиц, получавших плацебо. Во время же приема амантадина у больных отмечали развитие судорог и усугубление застойной сердечной недостаточности, хотя причинной связи между этими явлениями не установлено.
На применение амантадина для профилактики и лечения гриппа А в США разрешение уже получено, в то время как использование ремантадина остается пока экспериментальным, как и в марте 1986 г. Благодаря своей эффективности и отсутствию токсичности ремантадин может быть особенно успешно применен с целью длительной профилактики гриппа или при лечении больных с высокой степенью риска развития токсических реакций со сторопы центральной нервной системы, в частности у лиц пожилого возраста. Рекомендуемая доза амантадина при назначении таким пациентам не должна превышать 100 мг в сутки.
Рибавирин. Рибавирин — это синтетический аналог нуклеозида, подавляющий широкий спектр вирусных РНК и ДНК. Механизм действия рибавирина полностью не определен и может быть различен при взаимодействии его с вирусами разных групп. Рибавирин-5`-монофосфат блокирует конверсию инозин-5`-монофосфата в ксантозин-5`-монофосфат, а также нарушает синтез гуаниновых нуклеотидов, РНК и ДНК. Рибавирин-5'-монофосфат подавляет также Кэппинг-феномен вирусспецифической РНК в ряде вирусных систем. В исследованиях по изучению эффективности рибавирина препарат использовали в виде мелкокапельного аэрозоля. Рибавирин применяли для лечения респираторной синцитиальной вирусной (РСВ) инфекции у детей раннего возраста и в меньшей степени—для лечения гриппа А и В у лиц молодого возраста. При лечении РСВ-инфекции у детей раннего возраста рибавирин, вводимый в течение 3—6 дней в виде аэрозоля, приводил к быстрому разрешению заболевания, меньшей выраженности признаков поражения дыхательных путей и расстройств насыщения кислородом артериальной крови по сравнению с плацебо-группой. Пероральное же введение рибавирина при лечении гриппозной инфекции типа А было неэффективно. В настоящее время изучают возможность применения рибавирина при аденовирусной и аренавирусной инфекции, включая лихорадку Ласса, а также синдрома приобретенного иммунодефицита.
Пероральное введение больших доз рибавирина (800—1000 мг в день) сопровождалось обратимыми токсическими реакциями со стороны гемогюэза, которых не наблюдалось при аэрозольном введении препарата, что, очевидно, связано с незначительной системной абсорбцией препарата при этом. Аэрозольное введение рибавирина было одобрено для купирования РСВ-инфекции у детей раннего возраста. Учитывая важность аэрозольного пути введения препаратов, рибавирин может быть использован только при этих состояниях и под тщательным контролем.
Ацикловир. Ацикловир-9- [(2-гидроксиэтокси) метил] гуанин — мощный селективный ингибитор репликации некоторых герпесвирусов, включая вирус простого герпеса 1 (ВПГ-1), вирус простого герпеса 2 (ВПГ-2), вирусы ветряной оспы и опоясывающего герпеса и вирус Эпстайна—Барра (ВЭБ). Однако препарат сравнительно неэффективен при цитомегаловирусной инфекции человека (ЦМВ)
Высокая степень избирательности действия ацикловира связана с его механизмом действия, который подразумевает первоначальное фосфорилирование его в ацикловирмонофосфат. Этот процесс эффективно протекает исключительно в клетках, пораженных вирусом герпеса, благодаря содержанию в них кодируемой вирусом тимидинкиназы, необходимой для этой реакции, В неинфицированных клетках млекопитающих фосфорилирование происходит в незначительной степени, поэтому ацикловир концентрируется преимущественно в клетках, пораженных вирусом герпеса. Затем под воздействием киназ клетки-хозяина ацикловирмонофосфат трансформируется в трифосфат, представляющий собой мощный ингибитор вирусиндуцируемой ДНК-полимеразы, но практически не влияющий на ДНК-полимеразу клетки-хозяина. Ацикловиртрифосфат также может быть включен в вирусную ДНК, приводя к ее раннему обрыванию.
В настоящее время ацикловир имеется в формах для внутривенного, перорального введения и местного применения. Внутривенное введение ацикловира показано при лечении герпетических высыпаний на коже и слизистых оболочках у лиц с ослабленным иммунитетом. При этом сокращаются время заживления, продолжительность болей и уменьшается выделение вируса во внешнюю среду. Профилактическое внутривенное введение ацикловнра в период значительной иммуносупрессии, например во время проведения химиотерапии по поводу лейкоза или трансплантации, но до появления кожных проявлений, сопровождается уменьшением частоты заболеваний, ассоциированных с вирусом простого герпеса. Однако после прекращения профилактического введения препарата развивается рецидив герпетической инфекции. Внутривенное введение ацикловира показано также при лечении энцефалита, вызванного вирусом простого герпеса. Результаты двух сравнительных исследований продемонстрировали большую по сравнению с видарабином его эффективность (см. ниже). У больных с ослабленным иммунитетом, страдающих опоясывающим герпесом, ацикловир при внутривенном введении в значительно большей степени, чем видарабин, уменьшает частоту возникновения кожных высыпаний и висцеральных осложнений.
Наиболее широко ацикловир применяют для лечения больных с генитальной инфекцией, вызванной вирусом простого герпеса. При этом как внутривенное, так и пероральное введение препарата уменьшали продолжительность симптомов, снижали объем выделения вируса во внешнюю среду и ускоряли заживление. Пероральный прием ацикловира также оказывал определенное положительное влияние в случае рецидивов заболевания. Однако как при первичной, так и при повторной инфекции прием ацикловира не уменьшает число последующих рецидивов, что указывает на неспособность препарата подавить латентное течение заболевания. Было показано, что хроническое введение ацикловира перорально (в течение 4—6 мес) заметно уменьшает частоту рецидивов в период проведения терапии. Тем не менее после прекращения приема препарата поражения кожи появляются вновь. В настоящее время проводятся исследования по изучению влияния ацикловира на течение рецидивирующеи генитальной инфекции, вызванной вирусом простого герпеса, при его приеме в течение более длительного времени.
Создание пероральных и внутривенных форм ацикловира сократило список показаний для местного применения его, хотя при лечении первичного генитального герпеса, герпетического поражения слизистых оболочек и кожи у лиц с ослабленным иммунитетом местное использование препарата оказывает некоторое положительное действие.
Ацикловир хорошо переносится больными и обычно не вызывает токсических реакций. Наиболее частым осложнением вследствие приема препарата можно считать транзиторное нарушение функции почек, особенно выраженное после быстрого внутривенного его введения или у лиц, получавших неадекватное количество жидкости. Возможны некоторые расстройства центральной нервной системы, включая сонливость и тремор, возникающие преимущественно у лиц с ослабленным иммунитетом. Однако связаны ли эти расстройства с приемом ацикловира, с какими-либо другими одновременно вводимыми препаратами или основным инфекционным заболеванием, неизвестно. Ацикловир экскретируется прежде всего почками как за счет гломерулярной фильтрации, так и канальцевой секреции. Приблизительно 15% введенной дозы препарата метаболизируется до 9-[(карбоксиметокси)метил]гуанина или других малых метаболитов. Больным, у которых клиренс креатинина менее 50 мл/мин на 1,73 м2, показано уменьшение дозы препарата. У здоровых взрослых людей период полувыведения ацикловира составляет приблизительно 3 ч, а максимальная концентрация в плазме через 1 ч инфузии в дозе 5 мг/кг составляет 9,8 мкг/мл. После перорального приема препарата абсорбируется приблизительно 22% введенной дозы, а максимальные концентрации в плазме, равные 0,3—0,9 мкг/мл, достигаются после введения дозы в 200 мг. Ацикловир сравнительно хорошо проникает в спинномозговую жидкость, при этом его концентрации достигают 50% от концентрации в плазме.
Аналог ацикловира, ДГПГ 9-[(1,3-дигидрокси-2-пропокси)-метил] гуанин, обладает более высокой активностью против вируса цитомегалии и является, по-видимому, наиболее многообещающим противовирусным препаратом из всех используемых в настоящее время против этого вируса у человека.
В настоящее время ДГПГ проходит глубокие клинические испытания при инфекции, вызванной вирусом цитомегалии.
Видарабин. Видарабин (9-бета-D-арабинофураносиладенин) —это аналог пуринового нуклеозида, обладающий активностью против ВПГ-1, ВПГ-2, вируса ветряной оспы, опоясывающего герпеса и ВЭБ. Видарабин подавляет синтез вирусной ДНК, влияя на 5'-трифосфорилированный метаболит, хотя точный молекулярный механизм его действия неизвестен. При лечении опоясывающего герпеса у больных с ослабленным иммунитетом введение видарабина в дозе 10 мг/кг в сутки в течение 5 дней привело к уменьшению случаев кожной и висцеральной диссеминации и выраженности постгерпетической невралгии. Однако по сравнению с ацикловиром его эффективность была ниже. Положительное влияние было отмечено также при лечении ветряной оспы у лиц с ослабленным иммунитетом. При проведении плацебо-контролируемого исследования было установлено, что введение видарабина в больших дозах (15 мг/кг в сутки в течение 10 дней) оказывает эффект при простом герпетическом энцефалите, снижая смертность от 70 до 40% в течение 6 мес после прекращения лечения. Однако результаты сравнительных исследований свидетельствуют о том, что ацикловир (30 мг/кг в сутки) более эффективен при лечении простого герпетического энцефалита, чем видарабин. В связи с этим ацикловир вытеснил видарабин как препарат выбора при данной инфекции. Приведенные выше исследования показали, что успех лечения тесно связан с его своевременным началом.
Применение видарабина также значительно снизило смертность от простой герпетической инфекции у новорожденных от 74% в плацебо-группе до 38% в группе, получавшей лечение. В то же время у большинства выживших больных остались тяжелые нарушения деятельности центральной нервной системы. Было обнаружено также, что видарабин эффективен при лечении кожно-слизистых проявлений ВПГ-инфекции у больных с ослабленным иммунитетом. Однако положительные результаты были получены главным образом у лиц, инфицированных ВПГ-1 и у больных в возрасте 40 лет и старше. Местное применение видарабина при простой герпетической инфекции кожи и слизистых оболочек генитальной и орофасциальной зон, как правило, было неэффективным. Положительные результаты при этом наблюдали лишь у больных с простым герпетическим кератитом.
В настоящее время для системного введения видарабин существует только в виде препарата для внутривенного введения, который, однако, обладает плохой растворимостью. В связи с этим в 1 л жидкости можно растворить не более 450 мг вещества. Необходимая доза вводится в виде постоянной инфузии в течение 12 ч. При этом существенная нагрузка жидкостью может превратиться в серьезную проблему при наличии у пациента поражения центральной нервной системы. В организме человека видарабин быстро дезаминируется под влиянием аденозиндезаминазы сыворотки до его гипоксантинового производного, арагипоксантин, противовирусная активность которого в 10 раз слабее, чем у исходного вещества. В то же время он является основным противовирусным агентом плазмы. После введения 10 мг/кг видарабина максимальные уровни арагипоксантина составляют 3—6 мкг/мл. Концентрации арагипоксантина в спинномозговой жидкости составляют у взрослых приблизительно 35% от концентраций его в плазме, хотя у детей это соотношение может быть большим. При этих условиях период полувыведения арагипоксантина составляет приблизительно 3,5 ч. Основной путь выведения его из организма — через почки.
При проведении широкомасштабных исследований такие дозы видарабина, как 10—15 мг/кг в сутки, не использовали ввиду его высокой токсичности. В еще более высоких дозах (20 мг/кг в сутки) видарабин вызывал нарушения гемопоэза, включая анемию, лейкопению и тромбоцитопению. Также имеются сообщения о нейротоксичности видарабина, особенно при его использовании в больших дозах у больных с печеночной или почечной недостаточностью. Возможно, что отрицательно сказывается сочетанное введение видарабина с интерфероном или аллопуринолом. Нейротоксические эффекты включают тремор, изменения процессов мышления, в редких случаях развиваются кома и судороги. Иногда возможны боли в конечностях. Все эти явления могут сохраняться в течение 6 мес после окончания лечения.
Противовирусные препараты для местного применения. IUdR (5`-йoдo-2`-дезоксиуридин) угнетает репликацию вирусной ДНК, включая герпесвирусы и поксвирусы. Первоначально препарат использовали для системного лечения больных с герпетической инфекцией, включая простой герпетический энцефалит. Однако из-за связанной с этим токсичности и отсутствия заметного эффекта его системное введение было приостановлено. Тем не менее в случае местного применения IUdR можно рекомендовать при лечении простого герпетического кератита, в особенности при поверхностной эпителиальной инфекции. Имеются сообщения о возникновении местных токсических реакций — воспаления, зуда и аллергических изменений. Имеющиеся в настоящее время препараты IUdR для местного применения малоэффективны при лечении герпетического поражения кожи и слизистых оболочек.
Трифлюоротимидин — это аналог дезокситимидина, препарата, также обладающего некоторой эффективностью при герпетической инфекции. Поскольку ТФТ оказывает угнетающее действие на костный мозг, его использование ограничивается местным применением при поражениях глаз. В этих случаях эффективность и переносимость трифлюоротимидина пациентами выше, чем IUdR, и сравнимы с видарабином. Кроме того, препарат позволял получить положительный результат при лечении больных, у которых местное применение IUdR или видарабина было неэффективным.
Интерфероны. С самого раннего их появления интерфероны ста»пи привлекать, вызывать большой интерес как с точки зрения профилактики, так и лечения вирусных заболеваний. Первые работы с человеческим лейкоцитарным интерфероном продемонстрировали его эффективность при профилактике экспериментально вызванной у человека риновирусной инфекции, а также при лечении ветряной оспы и опоясывающего лишая у лиц с угнетением иммунитета. Методы рекомбинирования ДНК позволили получить высокой чистоты альфа-, бета- и гамма-интерфероны, которые в настоящее время проходят всестороннюю оценку при широком спектре вирусных инфекций. Результаты, полученные при этих исследованиях, подтвердили данные об эффективности интерферона при риновирусных инфекциях, свидетельствуют о его положительном влиянии на течение некоторых папилломавирусных инфекций, хронического гепатита В и цитомегалии. По окончании проводимых в настоящее время клинических исследований можно будет определить точную роль интерферона в лечении этих и других вирусных инфекций.
ГЛАВА 130. ГРИПП
Рафаэл Долин (Raphael Dolin)
Определение. Грипп представляет собой острое респираторное заболевание, вызванное вирусом гриппа. Инфекция поражает верхние и/или нижние дыхательные пути и часто сопровождается такими системными симптомами, как лихорадка, головная боль, миалгия, слабость. Вспышки заболевания различной продолжительности и тяжести, возникающие практически каждую зиму, приводят к значительной заболеваемости среди населения в целом и повышенной смертности у пациентов «высокого риска», главным образом в результате легочных осложнений острого заболевания.
Этиология. Вирусы гриппа являются членами семейства Orthomyxovindae. Вирусы гриппа А и В составляют один род, а гриппа С—другой. Разделение вирусов гриппа на типы А, В и С основано на антигенных характеристиках белков нуклеопротеида (НП) и матрикса (М). Вирусы гриппа А подразделяются на подтипы в зависимости от антигенных свойств, поверхностного гемагглютинина (Н) и нейраминидазы (N). Также выделяют индивидуальные штаммы в зависимости от места происхождения, количества изолятов, года выделения и подтипа [например, грипп А (Виктория) 3/79 ГЗН2]. Вирусы гриппа В и С обозначаются аналогичным образом, но антигены Г и Н этих вирусов не имеют подтиповых обозначений, поскольку внутритиповые вариации этих антигенов вирусов гриппа В и С менее значительны.
Большая часть информации о молекулярной биологии вирусов гриппа была получена при изучении вирусов гриппа А. О репликационном цикле вирусов В и С известно меньше. Морфологически вирусы гриппа А, В и С сходны. Вирионы представляют собой неправильной формы вирусные частицы диаметром от 80 до 120 нм, содержащие липидную оболочку с выступающими с ее поверхности гликопротеидами гемагглютинина и нейраминидазы. Гемагглютинин служит местом связывания вируса с клеточным рецептором, в то время как нейраминидаза разрушает рецептор и, возможно, играет роль при выходе вируса из инфицированной клетки после окончания репликации. Антитела против Г-антигена являются основными детерминантами иммунитета против вируса гриппа. В свою очередь антитела к нейраминидазе ограничивают распространение вируса, предотвращая расширение масштабов инфекции. Внутренняя поверхность липидной оболочки содержит матричный протеин (М), функция которого до конца неясна, но который, возможно, участвует в сборке вируса и стабилизации его липидной оболочки. Вирион также содержит нуклеопротеид (НП), с которым связан геном вируса, а также три полимеразных (П) протеина, необходимых для транскрипции и синтеза вирусной РНК. Кроме того, в инфицированной клетке можно обнаружить три неструктурных (НС) протеина неизвестного назначения.
Геном вируса гриппа А состоит из 8 односпиральных сегментов вирусной РНК, кодирующих структурные и неструктурные белки. Благодаря сегментированному геному высока вероятность рекомбинации генов, что и происходит довольно часто с вирусом гриппа А в инфицированных клетках.
Эпидемиология. Вспышки гриппа наблюдаются практически ежегодно, хотя их масштабы и тяжесть значительно варьируют. Местные вспышки возникают через разные интервалы времени, обычно каждые 1—3 года. Глобальные эпидемии, или пандемии, происходили приблизительно каждые 10—15 лет начиная с пандемии 1918—1919 гг. (табл. 130-1).
Таблица 130-1. Появление антигенных подтипов гриппа А, связанных с пандемиями и эпидемиями заболевания
| Годы | Подтип гриппа Л | Характер вспышки |
| 1889—1890 | H2N8' | Тяжелая пандемия |
| 1900—1903 | H3N8' | Умеренная эпидемия |
| 1918—1919 | H1N12 (раньше HswNl) | Тяжелая пандемия |
| 1933—1935 | H1N12 (раньше HON1) | Нетяжелая эпидемия |
| 1946—1947 | H1N1 | Нетяжелая эпидемия |
| 1957—1958 | H2N2 | Тяжелая пандемия |
| 1968—1969 | H3N2 | Умеренная пандемия |
| 1977—1978 | H1N1 | Нетяжелая пандемия |
' Как было определено с помощью ретроспективных серологических исследований лиц, живших в те годы («сероархеология»).
2 Гемагглютинины, ранее описанные как Hsw и НО, в настоящее время классифицируются как варианты H1.
Наиболее крупные и тяжелые вспышки вызывают вирусы гриппа А. Частично это является результатом способности антигенов гемагглютинина и нейраминидазы вируса гриппа А к периодическим антигенным изменениям. Крупные антигенные вариации называются антигенным сдвигом. Наиболее вероятной причиной его служит рекомбинация сегментов генома между вирусными штаммами. Антигенные сдвиги могут быть связаны с пандемиями и происходят исключительно у вирусов гриппа А. Меньшие изменения получили название «дрейф» антигенов. Вероятнее всего, они являются следствием точечных мутаций. Эти антигенные изменения могут затрагивать только гемагглютинин или гемагглютинин и нейраминидазу. У вирусов человека выделили три больших антигенных подтипа гемагглютининов (H1, H2 и Н3) и 2 подтипа нейраминидаз (N1 и N2). Гемагглютинины, которые раньше обозначались как НО и Hswl, в настоящее время классифицируют как варианты П. Примером антигенного сдвига, затрагивающего как гемагглютинин, так и нейраминидазу, может быть сдвиг, произошедший в 1957 г. в подтипе вируса гриппа А: ПН] превратился в Г2Н2. Результатом была тяжелая пандемия, унесшая только в США 70000 жизней. В 1968 г. произошел антигенный сдвиг, затронувший только гемагглютинин (H2N2 превратили в H3N2). Последовавшая пандемия была менее тяжелой, чем пандемия 1957 г. В 1977 г. появился вирус A/H1N1, вызвавший пандемию, поражавшую прежде всего людей молодого возраста, т. е. родившихся после 1957 г. Как видно из табл. 130-1, вирусы H1N1 циркулировали с 1918 по 1956 г. В связи с этим можно ожидать, что у людей, родившихся до 1957 г., имеется некоторая доля иммунитета к вирусам H1N1. Во время большинства вспышек гриппа А в один отрезок времени циркулировал 'какой-то один его подтип. Однако начиная с 1977 г. в популяции циркулируют 2 подтипа вирусов A/H1N1 и A/H3N2 одновременно, вызывая вспышки заболевания различной тяжести.
Источник пандемических штаммов неизвестен. Поскольку первичные структуры гемагглютининов разных подтипов вирусов гриппа А (Н1, H2 и Н3) заметно различаются между собой, принято считать, что антигенный сдвиг является результатом спонтанных мутаций гемагглютинннового гена. С другой стороны, известно, что к значительным рекомбинациям вирусов гриппа может привести сег-ментированность генов. В связи с этим было высказано предположение о том, что пандемические штаммы могут возникать вследствие рекомбинации генов вирусов гриппа человека и животных. Вирусы гриппа В не имеют животного резервуара и не испытывают такого антигенного сдвига.
Несмотря на то что пандемии являются наиболее драматическим примером того, к чему может привести грипп, заболевания, возникающие между пандемиями, иногда сопровождаются даже более высокой заболеваемостью и смертностью, хотя и за больший промежуток времени. Так, с 1957 г. интерпандемические вспышки в США привели к гибели более чем 10000 человек, что превысило «сверхожидаемые уровни», вследствие чего за истекший период 15 подобных вспышек унесли 450000 жизней. Вирусы гриппа А, циркулирующие между пандемиями, испытывают антигенный сдвиг гемагглютинянового антигена. Эти антигенные сдвиги, очевидно, являются результатом точечных мутаций, затрагивающих тот сегмент РНК, который кодирует гемагглютинин. Аминокислотный^ анализ «сдвинутых» гемагглютининов свидетельствует о том, что изменение одной аминокислоты оказывает незначительное влияние на антигенные свойства гемагглютинина. У эпидемиологически значимых штаммов, т. е. тех, которые способны вызвать широкомасштабные вспышки, имеется как минимум два измененных из четырех больших антигенных участков в молекуле ГА. Поскольку маловероятно, что двухточечные мутации могут возникнуть одновременно, считается, что антигенный сдвиг является следствием точечных мутаций, возникающих последовательно друг за другом во время распространения от человека к человеку. Антигенные сдвиги вирусов у A/H1N1 возникали практически ежегодно, начиная с 1977 г., а у вирусов A/H3N2 — с 1968 г.
Эпидемии гриппа А начинаются внезапно, достигают своего пика через 2— 3 нед, продолжаются, как правило, 2—3 мес и часто затухают практически так же быстро, как и начинались. Первым признаком появления гриппозной активности в обществе служит увеличение числа детей, попадающих в сферу внимания медицинского персонала по поводу респираторных заболеваний, сопровождающихся фебрильной температурой. Затем следуют повышение числа гриппоподобных заболеваний среди взрослых и возрастание поступления в больницы пациентов с пневмониями, обострением застойной сердечной недостаточности, усугублением хронических заболеваний легких. В этот период растет также число пропущенных рабочих дней на производстве и дней учебы в школах. Увеличение смертности, вызванной пневмонией и гриппом (так называемую избыточную смертность), как правило, наблюдают на поздних этапах вспышки. Численность заболевших значительно варьирует при разных вспышках заболевания, но чаще всего она составляет 10—20% от общей популяции. Во время пандемии 1957 г. было установлено, что клинические признаки гриппа наблюдали более чем у 50% городского населения, а еще у 25% или более имело место субклиническое течение гриппа А. Среди организованного населения и в полузакрытых учреждениях, где находится большое количество восприимчивых лиц, заболеваемость была еще выше.
Как в северном, так и в южном полушарии эпидемии гриппа возникают практически исключительно в зимние месяцы. Обнаружить вирус гриппа во время, нехарактерное для вспышек заболевания, практически невозможно, хотя редкие серологические подъемы в другие сезоны года иногда отмечались. Где и как вирус гриппа А персистирует в периоды между вспышками, неизвестно.
Возможно следующее объяснение: вирусы гриппа А сохраняются в человеческой популяции в масштабах всего мира вследствие передачи от человека к человеку. А в больших популяционных группах вирус может сохраняться в небольшом количестве, необходимом только для распространения между эпидемиями. В качестве альтернативного объяснения высказывается гипотеза о том, что человеческие штаммы могут длительное время находиться в животных резервуарах. Однако доказательств, подтверждавших бы оба этих объяснения, пока нет. В современную эпоху средства быстрого передвижения могут играть определенную роль в передаче вируса между различными географическими областями.
Факторы, лежащие в основе начала и окончания вспышек заболевания, также не совсем ясны. Основным фактором, детерминирующим распространенность и тяжесть вспышки, является уровень иммунитета у населения с риском развития заболевания. Если появляется новый с антигенной точки зрения вирус гриппа, к которому антитела отсутствуют, или напряженность иммунитета в популяции очень мала, то возникает массивная вспышка. Если же антител к данному вирусу нет ни в одной популяции, то эпидемия заболевания распространяется по всему земному шару, приводя к пандемии. Такие волны пандемии могут длиться в течение нескольких лет, до тех пор, пока иммунитет не достигнет высокого уровня. В годы после пандемии гриппа антигенная изменчивость вирусов гриппа приводит к вспышкам различного масштаба у населения, имеющего высокий уровень иммунитета к пандемическому штамму, циркулировавшему ранее. Такая ситуация сохраняется до тех пор, пока не появится другой, новый с точки зрения антигенной структуры пандемический штамм. С другой стороны, вспышки заболевания могут так же неожиданно оканчиваться, несмотря на наличие в популяции большого числа восприимчивых лиц. Иногда появление существенно отличного от предыдущих антигенного варианта вируса приводит лишь к локальным вспышкам. Вспышку «свиного гриппа» в 1976 г. в США можно рассматривать как пример вышесказанного, несмотря на то, что она может служить лишь отражением попадания вируса гриппа свиней в скученную популяцию людей без дальнейшего распространения за ее пределы. Было высказано также предположение о том, что некоторые вирусы, такие как недавно циркулировавший штамм A/H1N1, могут быть по своей природе менее вирулентны и вызывать менее тяжелое заболевание даже у лиц, не имеющих иммунной защиты. Это свидетельствует о том, что в эпидемиологии гриппа большую роль, кроме исходного уровня иммунитета в популяции, играют и другие, не установленные пока факторы.
Вирус гриппа В вызывает менее масштабные и тяжело протекающие вспышки заболевания, чем вызванные вирусом гриппа А. Гемагглютинин и нейраминидаза вируса гриппа В реже и в меньшей степени, чем вируса гриппа А, подвергаются изменениям. Этим частично можно объяснять меньшую распространенность гриппа В. Вспышки гриппа В чаще наблюдаются в школах и военных лагерях. Отмечают также отдельные вспышки и среди лиц пожилого возраста. Наиболее серьезным осложнением инфекции, вызванной вирусом гриппа В, является синдром Рейе (см. ниже). Вирус гриппа С редко вызывает заболевание у человека, несмотря на то, что встречается повсеместно.
Заболеваемость и смертность при вспышках гриппа продолжают оставаться значительными. Смертность выше среди лиц, страдающих каким-либо соматическим нарушением (группа с высокой степенью риска развития осложнений). Во время последних вспышек гриппа сверхнормативная госпитализация лиц из этой группы достигла 800 на 100000. К группе с высокой степенью риска относят прежде всего лиц, страдающих хроническими заболеваниями сердца и легких, а также больных пожилого возраста, в частности старше 65 лет. Высокая смертность была отмечена также среди лиц с хроническими нарушениями обмена веществ, болезнями почек, иммуносупрессией, однако она меньше, чем среди лиц, страдающих хроническими сердечно-легочными заболеваниями.
Грипп вызывает также высокую заболеваемость среди населения в целом. Было установлено, что прямые и непрямые экономические затраты, сопровождающие каждую из трех вспышек гриппа, развившихся в 60-е годы, варьировали от 1,5 до 3,5 млрд долларов. Сегодня эти затраты будут значительно больше.
Патогенез. Сначала вирус гриппа попадает в дыхательные пути инфицированного человека, а затем внедряется в эпителиальные клетки. Распространение вируса происходит воздушно-капельным путем во время кашля и чиханья, хотя возможно заражение и при рукопожатии, других личных контактах, через различные предметы. Экспериментальные данные свидетельствуют о том, что распространение инфекции в мелкокапельном аэрозоле (состоящем из частиц диаметром менее 10 мкм), более эффективно, чем в аэрозоле с более крупными каплями. Первоначально вирус поражает клетки реснитчатого цилиндрического эпителия, но затем внедряется и в другие клетки дыхательных путей, включая альвеолярные клетки, мукоциты и макрофаги. Репликация вируса длится в инфицированных клетках 4—6 ч, затем активный вирус покидает клетку и проникает в близлежащую. В результате за несколько часов патологический процесс из небольших очагов распространяется по значительной клеточной поверхности дыхательных путей. При экспериментально вызванной инфекции инкубационный период варьировал от 18 до 72 ч. С помощью гистопатологических методов в инфицированных клетках выявляли грануляцию, вакуолизацию, набухание и образование пикнотических ядер, а затем некроз и десквамацию клеток. В некоторых участках цилиндрический эпителий замещался плоскими и метапластическими эпителиальными клетками. Тяжесть заболевания коррелировала с количеством вируса, находящегося в слизистом секрете. Это позволяет предположить, что выраженность репликации вируса может быть важным механизмом патогенеза патологического процесса. Несмотря на наличие таких общих признаков заболевания, как лихорадка, головная боль и миалгия, вирус гриппа редко обнаруживается в экстрапульмональных областях, включая кровоток. В связи с этим патогенез системных симптомов гриппа остается неизвестным.
Реакция организма на гриппозную инфекцию представляет собой сложное переплетение защитных механизмов, в том числе образование сывороточных и секреторных антител, клеточный иммунный ответ, активацию интерферона и др. Изменения уровней антител сыворотки могут быть выявлены с помощью разнообразных методов уже на 2-й неделе после первичного внедрения вируса гриппа. Эти антитела можно определить методами подавления гемагглютинации (ПГА), фиксации комплемента (ФК), нейтрализации, твердофазного иммуноферментного анализа (ELISA) и определения антинейраминидазных антител. Антитела против гемагглютининов представляют собой, видимо, наиболее важный фактор иммунитета. Было показано, что при титре антител в реакции ПГА не менее 1:40 инфекция не развивается. Секреторные антитела, вырабатываемые в дыхательных путях, относятся преимущественно к классу IgA и также играют важную роль в защите организма от инфекции. Было показано, что при нейтрализующем титре секреторных антител 1:4 или выше инфекция не развивается. Уже в ранние сроки после начала инфекционного процесса проявляются реакции клеточного иммунитета, как антигеноспецифические, так и антигенонеспецифические. Выраженность их зависит от исходного уровня собственного иммунитета хозяина. Эти реакции включают повышение пролиферативной и цитотоксической активности Т-клеток и активности клеток — естественных киллеров. Сразу после того, как вирус попадает в дыхательные пути, в организме начинается образование интерферонов, а повышение их титров совпадает с уменьшением выделения вирусов во внешнюю среду.
Факторы макроорганизма, ответственные за прекращение выделения вируса во внешнюю среду и за разрешение инфекционного процесса, специально не изучали. Выделение вируса во внешнюю среду обычно прекращается в течение 2—5 дней после появления первых признаков заболевания. В это время изменение уровней сывороточных и секреторных антител часто не поддается обнаружению с помощью обычных методов, хотя даже на ранних этапах подъем уровней антител можно обнаружить высокочувствительными методами, в частности у лиц с имеющимся иммунитетом в результате ранее перенесенной инфекции. Было высказано предположение, что в разрешении инфекционного процесса важную роль играют интерферон, реакции клеточного иммунитета или неспецифические воспалительные реакции.
Клинические проявления. Наиболее общими признаками гриппозной инфекции можно считать головную боль, лихорадочное состояние, озноб, миалгию и недомогание, вслед за которыми развивается респираторное заболевание, сопровождающееся кашлем и болью в горле. Во многих случаях начало заболевания настолько внезапно, что пациенты могут вспомнить точное время, когда они заболели. Типичный случай спонтанно возникшего гриппа приведен на рис. 130 1. Однако спектр клинических проявлений очень широк. Клиническая картина может варьировать от легкого респираторного заболевания, протекающего без подъема температуры, сходного с обычной простудой, до состояния, характеризующегося тяжелой прострацией и относительно скудными симптомами поражения дыхательных путей. В большинстве случаев, с которыми сталкивается врач, наблюдается повышение температуры тела в пределах 38—41°С. Температура поднимается быстро в течение первых суток заболевания, а затем наступает период постепенного снижения ее в течение 2-- 3 дней, хотя иногда лихорадочное состояние может длиться в течение недели. Пациенты жалуются на познабливание, но настоящий озноб развивается редко. Более всего пациента беспокоит головная боль. генерализованная или во фронтальной области. Боли могут также возникать в любой группе мышц тела, но чаще всего в мышцах нижних конечностей и поясничной области. Также появляются боли в суставах.
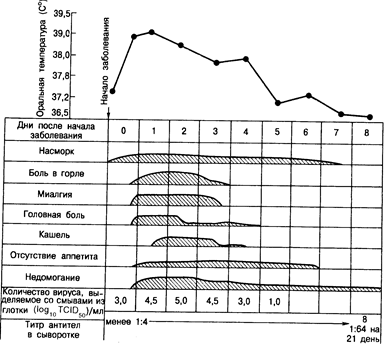
Рис. 130-1. Клиническая характеристика гриппа А у в целом здорового 28-летнего мужчины (из R. Dolin, Amer. Fam. Phys., 1976, 14, 74).
По мере стихания системных симптомов на первый план выходят жалобы со стороны дыхательных путей. Многие пациенты жалуются на боль в горле или упорный кашель, которые могут длиться в течение недели и более и часто сопровождаться дискомфортом в загрудинной области. Появляются также боль при движениях глазных яблок, фотофобия и чувство жжения в глазах.
При неосложненном гриппе физикальные признаки минимальны На ранних этапах заболевания у пациентов наблюдают покраснение лица, кожа горячая и сухая, хотя одновременно могут отмечаться обильное потоотделение и мраморность конечностей, в частности у больных пожилого возраста. Несмотря на боль в горле, обследование глотки может быть на удивление непримечательным— легкая гиперемия слизистых оболочек и выделения из носовых ходов. У больных молодого возраста наблюдается умеренное увеличение шейных лимфатических узлов. При неосложненной инфекции исследование грудной клетки чаще всего не дает каких-либо результатов, хотя иногда появляются свистящее дыхание, явления стридора и рассеянные хрипы. Явная одышка, гиперпноэ, цианоз, диффузные хрипы и признаки слипчивого процесса в легких должны насторожить врача и заставить подумать о развитии легочных осложнений. Но даже у больных с внешне неосложненным течением гриппа встречаются разнообразные слабовыраженные нарушения вентиляции легких и может быть повышен градиент альвеолярно-капиллярной диффузии. Это свидетельствует о том, что субклинически протекающее нарушение функции легких может встречаться чаще, чем принято думать.
При неосложненном течение гриппа острое заболевание обычно разрешается через 2—5 дней и большинство пациентов в основном выздоравливают к концу 1-й недели. Однако у некоторых пациентов, в частности у лиц пожилого возраста, симптомы слабости или вялости (постинфекционная астения) могут сохраняться в течение нескольких недель, причиняя серьезное беспокойство тем, кто хотел бы быстро вернуться к прежней активности. Патогенетическая основа этого неизвестна, хотя нарушения функции легких могут сохраняться в течение нескольких недель после неосложненного гриппа.
Осложнения гриппа. Наиболее распространенное осложнение гриппа — это пневмония. Пневмония может иметь первичную гриппозную вирусную, вторичную бактериальную или смешанную вирусную и бактериальную этиологию. Первичная гриппозная вирусная пневмония встречается относительно редко, но протекает тяжелее других легочных осложнений. Она начинается как острый грипп, симптомы которого не утихают, а, напротив, неумолимо прогрессируют, сопровождаясь стойкой лихорадкой, одышкой и цианозом. Мокроты мало, но она может содержать кровь. На ранних стадиях заболевания физикальные симптомы немногочисленны. В более далеко зашедших случаях появляются диффузные хрипы; на рентгенограмме легких — признаки диффузной интерстициальной инфильтрации и/или острого респираторного дистресс-синдрома. В этих случаях отмечается заметная артериальная гипоксия. При исследовании секрета дыхательных путей или паренхимы легкого, особенно на ранних стадиях заболевания, выявляют высокий титр свободного вируса. Гистопатологическими исследованиями легких погибших от первичной вирусной пневмонии больных установлена выраженная воспалительная реакция в альвеолярных перегородках, их отек и инфильтрация лимфоцитами, макрофагами, случайными плазматическими клетками и нейтрофилами в различном количестве. Также отмечают наличие фибриновых тромбов в альвеолярных капиллярах, участки некроза и кровоизлияний. Кроме того, можно обнаружить эозинофильные гиалиновые мембраны, выстилающие альвеолы и альвеолярные протоки. Наиболее предрасположены к развитию первичной гриппозной вирусной пневмонии лица, страдающие заболеваниями сердца, в частности стенозом левого атриовентрикулярного отверстия. Однако пневмония может развиться и у исходно здоровых молодых людей, а также у больных пожилого возраста с хроническими расстройствами функции легких. При некоторых эпидемиях гриппа (а именно в 1918 и 1957 гг.) риск развития первичной гриппозной пневмонии был повышен у женщин в период беременности.
Вторичная бактериальная пневмония представляет собой осложнение, при котором бактериальная инфекция развивается после кажущегося выздоровления больного. При этом через 2—3 дня после затухания признаков острого гриппа состояние больного улучшается, а затем вновь появляется лихорадка, сопровождаемая клиническими симптомами бактериальной пневмонии — кашлем, образованием гнойной мокроты, физикальными и рентгенологическими признаками слипчивого процесса в легких. Наиболее часто причиной бактериальной пневмонии служат Streptococcus pneumoniae, Staphylococcus aureus или Haemophilus influenzae, т. е. микроорганизмы, способные заселять носоглотку и вызывать инфекционный процесс при ослаблении защитных механизмов системы бронхов и легких. Этиологию заболевания определяют при микробиологическом исследовании и окраске по Граму правильно приготовленного препарата мокроты. Вторичная бактериальная пневмония чаще всего возникает у пациентов высокого риска: с хроническими заболеваниями легких и сердца и у лиц пожилого возраста.
Вторичные бактериальные пневмонии хорошо поддаются воздействию антибиотиков, особенно если лечение начато своевременно.
Однако наиболее часто из всех пневмонических осложнений, возникающих во время вспышки гриппа, встречается смешанная вирусная и бактериальная пневмония, характеризующаяся чертами как первичной, так и вторичной пневмоний, описанных выше. При этом острое заболевание постепенно прогрессирует, но может произойти и временное улучшение состояния больного, вслед за которым вновь происходит его ухудшение, и затем клиническое проявление бактериальной пневмонии. При микробиологическом исследовании мокроты обнаруживаются как вирус гриппа А, так и один из вышеперечисленных бактериальных патогенных микроорганизмов. При физикальном обследовании и рентгенографии грудной клетки выявляются очаги инфильтратов или области слипчивого процесса в легких. В случае смешанной вирусной и бактериальной пневмонии в целом реже, чем при первичной пневмонии, встречаются обширные участки поражения легких. При этом бактериальные пневмонии могут хорошо поддаваться воздействию соответствующих антибиотиков. Смешанные вирусные и бактериальные пневмонии возникают прежде всего у лиц с хроническими сердечно-сосудистыми и легочными заболеваниями.
Кроме легочных осложнений гриппа может развиться целый ряд внелегочных осложнений. Серьезным осложнением гриппа В, и в меньшей степени гриппа А, а также ветряной оспы и опоясывающего герпеса является синдром Рейе. Он возникает, как правило, у детей в возрасте от 2 до 16 лет через несколько дней после обычного, ничем не примечательного течения вирусного заболевания. Синдром Рейе характеризуется появлением тошноты и рвоты в течение 1—2 дней, после чего развиваются изменения со стороны центральной нервной системы — нарушения ментального статуса, варьирующие от сонливости до комы, а иногда делирии и судороги. Отмечается гепатомегалия с одновременным повышением уровней СГОТ, СГПТ и ЛДГ. Уровни билирубина повышаются незначительно, поэтому желтуха не выражена, но практически у всех пациентов в крови увеличено содержание аммиака. Может развиться гипогликемия, особенно после ветряной оспы, опоясывающего герпеса или вирусного желудочно-кишечного заболевания. Температура тела у детей обычно не повышается, и даже несмотря на то, что при люмбальной пункции обнаруживают повышение давления, изменений со стороны спинномозговой жидкости нет. Все это указывает на наличие у больного скорее энцефалопатии, чем менингоэнцефалита. Смертность при этом заболевании связана со степенью нарушения сознания при госпитализации и за последние годы снизилась с более чем 40% при первом описании синдрома до 10%, что свидетельствует о совершенствовании методов ранней диагностики и лечения отека мозга и гипогликемии. При гистопатологическом исследовании обнаруживают незначительные воспалительные изменения в печени или центральной нервной системе. Данные биопсии печени указывают на диффузную жировую инфильтрацию гепатоцитов и отек и плеоморфизм митохондрий. Единственным изменением центральной нервной системы является отек мозга и аноксическое поражение нейронов. Патогенез синдрома Рейе неизвестен, но обнаружить вирус в пораженной печени или мозге практически никогда не удается. В эпидемиологических исследованиях была выявлена связь между приемом ацетилсалициловой кислоты во время вирусного заболевания и последующим развитием синдрома Рейе.
Имеются сообщения об отдельных случаях миозита, рабдомиолиза и миоглобинурии, осложнивших течение гриппозной инфекции. Несмотря на то что миалгии очень распространены при гриппе, настоящий миозит встречается редко. У больных с острым миозитом чрезвычайно высока чувствительность пораженных мышц, чаще всего мышц нижних конечностей. Они испытывают невыносимую боль даже при таком легком прикосновении, как прикосновение постельного белья. В наиболее тяжелых случаях наблюдаются отек и дряблость мышц. Уровни креатинфосфокиназы и альдолазы сыворотки повышены, а в некоторых случаях миоглобинурия приводит к развитию почечной недостаточности. Патогенез гриппозного миозита также неизвестен, хотя сообщалось о наличии в пораженных мышцах вируса гриппа.
Во время пандемии гриппа 1918—1919 гг. встречались случаи развития миокардита и перикардита. Эти данные основываются главным образом на результатах гистопатологических исследований. Однако впоследствии сообщения о подобных осложнениях встречались нерегулярно. У лиц, страдающих заболеваниями сердца, во время остро протекающего гриппа наблюдали изменения ЭКГ, которые чаще относили на счет усугубления основного заболевания, а не на счет гриппозного поражения миокарда.
Возможные поражения центральной нервной системы характеризуются энцефалитом, поперечным миелитом и синдромом Гийена—Барре. Этиологическая связь вируса гриппа с указанными расстройствами не установлена.
Кроме осложнений, затрагивающих специфические системы органов, описанных выше, каждая вспышка гриппа выбирает определенные группы лиц высокого риска (лица пожилого возраста, страдающие хроническими заболеваниями), у которых развитие инфекционного процесса сопровождается прогрессивным ухудшением функции сердечно-сосудистой системы, легких и почек, приводя в ряде случаев к необратимым изменениям и смерти. Эти летальные исходы включаются в общий счет избыточной смертности, сопровождающей вспышки гриппа А.
Лабораторные исследования. В острый период заболевания лабораторная диагностика основана на выделении вируса из материала мазка из глотки, смывов из носоглотки или из мокроты. Вирус обычно обнаруживают в культуре тканей или, реже, в амниотической полости куриных эмбрионов в течение 48—72 ч после инокуляции. Используя методы иммунофлюоресценции, вирусные антигены можно обнаружить несколько ранее в культуре тканей или непосредственно в слущенных клетках носоглотки, полученных при смывах. Тип вируса гриппа (А или В) определяют с помощью методов иммунофлюоресценции или подавления гемагглютинации. Подтип гемагглютининов вируса гриппа A (H1, H2 или Н3) можно установить также, используя методы подавления гемагглютинации с подтипоспецифическими антисыворотками. Серологические методы диагностики требуют сравнения титров антител в сыворотке, полученной в острую фазу заболевания и через 10—14 дней после его начала. Однако чаще значение серологических методов ограничивается ретроспективными исследованиями. Диагностическим критерием острой инфекции является 4-кратное или более повышение титра антител, установленное методом подавления гемагглютинации, фиксации комплемента, или достоверное их повышение при использовании твердофазного иммуноферментного анализа (ELISA). Тесты фиксации комплемента в целом менее чувствительны, чем другие серологические методы. Однако, поскольку они позволяют обнаружить типоспецифические антигены, их можно рассматривать как наиболее информативные при отсутствии подтипоспецифических реагентов.
Остальные лабораторные тесты в целом менее информативны при постановке специфического диагноза гриппозной инфекции. Число лейкоцитов существенно меняется на протяжении заболевания: на ранних стадиях оно обычно ниже нормальных значений, а затем возвращается к норме или слегка повышается. В тяжелых случаях вирусной и бактериальной инфекции развивается выраженная лейкопения, в то время как лейкоцитоз более 15•109/л заставляет заподозрить вторичную бактериальную инфекцию.
Дифференциальная диагностика. Дифференцировать грипп от острых респираторных заболеваний, вызванных различными респираторными вирусами или Mycoplasma pneumoniae, на основании одних лишь клинических данных, полученных у каждого отдельного больного, достаточно трудно. Тяжелый стрептококковый фарингит или начало бактериальной пневмонии могут имитировать острый грипп, хотя для бактериальных пневмоний, как правило, нехарактерен самоограничивающийся цикл. Важным диагностическим признаком бактериаль
Дата добавления: 2016-03-05; просмотров: 1235;
