ГЛАВА 68. МЕТАБОЛИТЫ АРАХИДОНОВОЙ КИСЛОТЫ И ИХ РОЛЬ В МЕДИЦИНЕ
Р. Поль Роберт сон (R. Paul Robertson)
Содержание этой главы сконцентрировано на образовании и механизме действия физиологически активных метаболитов арахидоновой кислоты и на биологическом феномене, в котором могут участвовать эти вещества.
Образование эйкосаноидов. Простагландины — первые из выделенных метаболитов арахидоновой кислоты — названы так потому, что впервые они были выявлены в сперме. Считалось, что они секретируются предстательной железой. По мере того как выявлялись другие активные метаболиты, становилось очевидным наличие двух основных путей их превращения — циклооксигеназного и липооксигеназного. Эти пути синтеза схематически представлены на рис. 68-1, а строение типичных метаболитов — на рис. 68-2. Все продукты как циклооксигеназного, так и липооксигеназного происхождения называют эйкосаноидами. Продукты циклооксигеназного пути — Простагландины и тромбоксан — простаноидами.
Начальный этап синтеза в обоих метаболических путях включает в себя отщепление арахндоновой кислоты от фосфолипида в плазматической мембране клеток. Затем свободная арахидоновая кислота может быть окислена циклооксигеназным или липооксигеназным путем. Первым продуктом циклооксигеназного пути является циклический эндопероксид простагландин G2 (ПГG2), который превращается в простагландин Н2 (ПГН2). ПГG2 и ПГН2 служат ключевыми посредниками в процессе образования физиологически активных простагландинов (ПГD2, ПГЕ2, ПГF2 и и ПГI2) и тромбоксана А2 (ТКА2). Первым продуктом 5-липооксигеназного пути является 5-гидропероксиэйкосатетраеноевая кислота (5-ГПЭТЕ), которая играет роль посредника при образовании 5-гидроксиэйкосатетраеноивой кислоты (5-ГЭТЕ) и лейкотриенов (ЛТА4, ЛТВ4, ЛТС4, ЛТD4 и ЛТE4). Две жирные кислоты, отличающиеся от арахидоновой кислоты, 3,11,14-эйкосатриеноивая кислота (дигомо-g-линоленовая кислота) и 5,8,11,14,17-эйкосапентаеновая кислота, могут превращаться в метаболиты. близкие по строению к этим эйкосаноидам. Простаноидные продукты первого субстрата обозначаются индексом 1; лейкотриеновые продукты этого субстрата—индексом 3. Простаноидные продукты второго субстрата имеют обозначение 3, в то время как лейкотриеновые продукты этого субстрата обозначаются индексом 5.
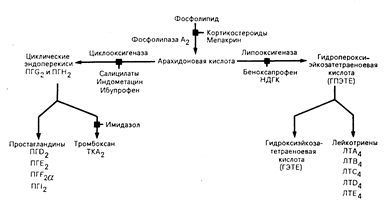
Рис. 68-1. Схема метаболизма арахидоновой кислоты. Различные лекарственные средства действуют на разные ферментные этапы, угнетая реакцию. Основными путями метаболизма являются циклооксигеназный и липооксигеназный. Фосфолипазу А2 угнетают кортикостероиды и мепакрин; циклооксигеназу — определенные салицилаты, индометацин и ибупрофен; липооксигеназу — беноксапрофен и нордигидрогуайаретиковая кислота (НДГК). Имидазол предотвращает синтез ТКА2.
Арахидоновая кислота образует простагландины, обозначаемые индексом 2, и лейкотриены, обозначаемые индексом 4. Индексы означают число двойных связей между атомами углерода в боковых цепях.
Фактически все клетки обладают необходимыми субстратами и ферментами для образования некоторых метаболитов арахидоновой кислоты, но различия ферментного состава тканей обусловливают различия в образуемых ими продуктах. Эйкосаноиды синтезируются по мере их непосредственной необходимости и не хранятся- в значительных количествах для последующего высвобождения.
Циклооксигеназные продукты. Простагландины D2, Е2, F2a и I2 образуются из циклических эндопероксидов ПГG2 и ПГH2. Из числа этих простагландинов ПГЕ2 и ПГI2 обладают наиболее широким спектром физиологического действия. ПГЕ2 оказывает заметное влияние внутри тканей и синтезируется многими из них. ПГI2 (называемый также простациклином) является основным продуктом арахидоновой кислоты в эндотелиальных и гладкомышечных клетках стенок сосудов и в некоторых несосудистых тканях. ПГI2 служит вазодилататором и угнетает агрегацию тромбоцитов. Считают, что ПГD2 также играет роль в агрегации тромбоцитов и функции головного мозга, а пгf2a — в функции матки и яичников.
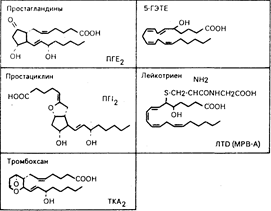
Рис. 68-2. Строение типичных биологически активных эйкосаноидов.
Тромбоксансинтетаза катализирует включение атома кислорода в кольцо эндоперекиси ПГН2 для образования тромбоксанов. TKA2 синтезируется тромбоцитами и усиливает агрегацию тромбоцитов.
Липооксигеназные продукты. Лейкотриены и ГЭТЕ являются конечными продуктами липооксигеназного пути. Лейкотриены обладают гистаминоподобным действием, включая индуцирование повышенной проницаемости сосудов и бронхоспазма, и, по-видимому, оказывают влияние на активность лейкоцитов. ЛТС4, ЛТD4 и ЛТE4 были идентифицированы как медленнореагирующие вещества анафилаксии (МРВ-А). (Патофизиология лейкотриенов детально обсуждается в гл. 202.)
Действие лекарственных средств на синтез эйкосаноидов. Многие лекарственные средства блокируют синтез эйкосаноидов путем угнетения одного или нескольких ферментов на путях их биосинтеза. Глюкокортикоиды и противомалярийные средства, такие как акрихин, препятствуют отщеплению арахидоновой кислоты от фосфолипидов (см. рис. 68-1). Циклооксигеназа непосредственно угнетается нестероидными противовоспалительными средствами, включая салицилаты, индометацин и ибупрофен. Беноксапрофен (Benoxaprofen)—еще одно нестероидное противовоспалительное средство — угнетает опосредуемое липооксигеназой превращение арахидоновой кислоты в ГПЭТЕ. Антидепрессант трансамин угнетает превращение циклических эндоперекисей в ПГI2, а имидазол — синтез тромбоксана. Тот факт, что какое-то лекарственное средство подавляет синтез определенного эйкосаноида, не означает, что действие данного лекарственного средства непосредственно приводит к дефициту этого продукта. Большинство этих лекарственных средств такого рода угнетают ранние этапы путей синтеза и поэтому блокируют образование не одного, а нескольких продуктов. Кроме того, некоторые из этих лекарственных средств оказывают и другие влияния. Например, индометацин не только угнетает образование циклических эндоперекисей, осуществляемое при помощи циклооксигеназы, но может также и нарушать транспорт кальция через мембраны, угнетать зависимые от циклического аденозинмонофосфата (циклического АМФ) протеинкиназу и фосфодиэстеразу, а также угнетать один из ферментов, ответственных за расщепление ПГЕ2. Не существует ни одного истинно специфичного ингибитора синтеза и ни одного специфичного антагониста рецепторов для отдельных метаболитов арахидоновой кислоты, которые можно было бы использовать в терапевтических целях. Отсутствие таких лекарственных средств является важным барьером, мешающим установить роль этих метаболитов в физиологических и патофизиологических процессах.
Метаболизм и количественный анализ эйкосаноидов. Метаболиты арахидоновой кислоты быстро диссеминируют in vivo. Простагландины серий Е и F, несмотря на то что они являются химически стабильными веществами, почти полностью расщепляются во время прохождения через печень или легкие. Таким образом, по существу все количество неметаболизированного ПГЕ2, определяемое в моче, образуется в результате секреции из почек и семенных пузырьков, в то время как содержащиеся в моче метаболиты ПГЕ2 характеризуют его синтез (ПГЕз) во всем организме. Как ПГI2, так и ТКА2 химически нестабильны и также подвергаются быстрой диссимиляции. Поскольку продолжительность жизни ПГЕ2, ПГI2 и ТКА2 in vivo невелика, измерение количества их неактивных метаболитов обычно используют в качестве показателя скорости их образования. ПГЕ2 превращается в 15-кето-13,14-дигидро-ПГЕ2; ПГI2 — в 6-кето-ПГF1a, а ТКА2 — в ТКВ2. Существует пять методов измерения содержания метаболитов арахидоновой кислоты в физиологических жидкостях: количественное определение биологической активности, радиоиммунный метод, хроматографический метод, определение числа рецепторов и масс-спектрометрия. При использовании любого из этих методов необходимо соблюдать определенные предосторожности при обращении с образцами биологических жидкостей, поскольку синтез простагландинов может быть повышенным во время сбора этих образцов. Например, если кровь свернулась или тромбоциты не были тщательно отделены от плазмы, то образование больших количеств ПГЕ2 и ТКА2 во время исследования может привести к получению ошибочных результатов. Добавление ингибитора синтеза простагландина в пробирку для сбора крови сведет эту проблему к минимуму.
Физиология. Простагландины и лейкотриены имеют специфические рецепторы на плазматических мембранах клеток печени, желтого тела, надпочечников, липоцитов, тимоцитов, матки, панкреатических островков, тромбоцитов и эритроцитов. Большинство этих рецепторов обладает специфичностью к эйкосаноидам определенного типа. Например, рецептор ПГЕ на плазматической мембране клеток печени связывает обладающие высоким сродством пге1 и ПГЕ2, но не связывает Простагландины классов A, F и I. Пострецепторные механизмы, с помощью которых связывание простагландинов изменяет функцию клетки, недостаточно ясны. Нормальное физиологическое функционирование эйкосаноидов не опосредуется через плазму крови. Вместо этого они действуют как местные, межклеточные и/или внутриклеточные модуляторы биохимической активности в тканях, в которых они образуются (например, пара.кринная функция). Эйкосаноиды являются аутокоидами, а не гормонами. Большинство из них обладает очень непродолжительным периодом жизни в циркулирующей крови вследствие их химической-нестабильности и/или быстрого расщепления.
Липолиз. ПГЕ2, синтезируемый липоцитами, имеет специфические рецепторы в липоцитах и является сильным эндогенным ингибитором липолиза. Поскольку для стимуляции липолиза гормонами необходимо образование циклического АМФ, было довольно подробно исследовано взаимодействие между ПГЕ и аденилатциклазой. ПГЕ угнетает липолиз путем снижения образования циклического АМФ в ответ на действие адреналина, адренокортикотропного гормона (АКТГ), глюкагона и тиреотропного гормона (ТТГ). Таким образом, ПГЕ может действовать как эндогенное антилиполитическое вещество, препятствуя стимуляции гормонами образования циклического АМФ.
Инсулин и ПГЕ могут действовать независимо друг от друга при их антилиполитическом воздействии на липоциты. Например, инсулин, но не ПГЕ, угнетает стимуляцию липолиза экзогенным циклическим АМФ в изолированных липоцитах, но оба эти вещества подавляют стимулированное гормоном образование циклического АМФ. Это позволяет предположить, что место действия инсулина находится дистальнее места стимуляции аденилатциклазы. В организме некоторых животных ПГЕ угнетает глюкагон-индуцированный липолиз, в то время как инсулин не оказывает влияния на этот процесс.
Баланс натрия и воды. Ренин-ангиотензин-альдостероновая система служит основным регулятором гомеостаза натрия, а контроль за водным балансом осуществляется главным образом вазопрессином. Метаболиты арахидоновой кислоты влияют на обе эти системы. ПГЕ2 и ПГI2 стимулируют секрецию ренина, а ингибиторы синтеза простагландинов оказывают противоположное действие. ПГЕ2 и ПГI2 уменьшают сопротивление почечных сосудов и увеличивают почечный кровоток; это приводит к перераспределению кровотока от наружного слоя коры почек к юкстамедуллярной области почек. Ингибиторы синтеза простагландина, такие как индометацин и меклофенамат (meclofenamate), напротив, уменьшают общий почечный кровоток и шунтируют оставшуюся его часть к наружному слою коры почек, что может привести к острому спазму сосудов почек и острой почечной недостаточности, особенно при уменьшении объема циркулирующей крови и отечных состояниях. ПГЕг является натрийуретиком, тогда как ингибиторы циклооксигеназы вызывают задержку натрия и воды в организме.
Индометацин также увеличивает чувствительность к экзогенному вазопрессину, например, у собак. И наоборот, ПГЕ2 уменьшает стимулированный вазопресеином транспорт воды. Поскольку такое действие ПГЕ2 нарушается введением дибутирилциклического АМФ, то наиболее вероятно, что ПГЕ2 будет препятствовать стимуляции аденилатциклазы вазопрессином.
Агрегация тромбоцитов. Тромбоциты обладают способностью синтезировать ПГЕ2, ПГD2 и ТКА2. Физиологическое значение ПГЕ2 и ПГD2 в функции тромбоцитов не установлено, ТКА2 является сильным стимулятором агрегации тромбоцитов; в противоположность этому ПГI2, образуемый в эндотелиоцитах стенок кровеносных сосудов, напротив, играет роль сильного антагониста агрегации тромбоцитов. ТКА2 и ПГI2 могут оказывать свои разнонаправленные воздействия, соответственно уменьшая и увеличивая образование циклического АМФ в тромбоцитах.
Противодействуют агрегации тромбоцитов ингибиторы синтеза эндогенных простагландинов. Например, единичная доза ацетилсалициловой кислоты может подавить нормальную агрегацию тромбоцитов на 48 ч и более, предположительно путем угнетения опосредуемого циклооксигеназой синтеза ТКА2. Длительность фазы угнетения циклооксигеназы единичной дозой этого препарата в тромбоцитах продолжительнее, чем в других тканях, поскольку тромбоцит в отличие от ядросодержащих клеток, способных синтезировать новые белки, не обладает соответствующими структурами для образования нового фермента. Следовательно, действие ацетилсалициловой кислоты продолжается до тех пор, пока не будут выделены в кровь вновь образованные тромбоциты. С другой стороны, эндотелиоциты быстро восстанавливают активность циклооксигеназы после прекращения лечения и, таким образом, восстанавливается продукция ПГI2. В этом заключается одна из причин того, что организм больных, принимающих ацетилсалициловую кислоту, не предрасположен к чрезмерному тромбообразованию. Кроме того, тромбоцит более чувствителен к препарату, чем эндотелиоцит.
Повреждение эндотелия может привести к агрегации тромбоцитов вдоль стенки кровеносного сосуда, вызывая местное уменьшение синтеза ПГI2 и тем самым открывая возможность избыточной агрегации тромбоцитов в месте повреждения сосудистой стенки.
Действие на сосуды. Вазоактивные свойства метаболитов арахидоновой кислоты относятся к числу самых замечательных эффектов этих веществ. ПГЕ2 и ПГI2 являются вазодилататорами, а ПГF2a, ТКА2 и ЛТС4, ЛТD4, ЛТE4 — вазоконстрикторами в большинстве участков сосудистого русла. Эти свойства, по-видимому, представляют собой результат их прямого действия на гладкую мускулатуру сосудистой стенки. Если системное артериальное давление поддерживается в пределах физиологической нормы, то действие расширяющих сосуды метаболитов арахидоновой кислоты приводит к увеличению кровотока. Однако в случае понижения артериального давления кровоток будет уменьшаться, поскольку при системной гипотензии индуцированное катехоламинами сужение сосудов скомпенсирует сосудорасширяющее действие простагландинов. Таким образом, при оценке влияния метаболитов арахидоновой кислоты на кровоток в сосудистом русле того или иного органа необходимо исключить существенные изменения системного артериального давления.
Влияние на пищеварительный тракт. Простагландины серии Е оказывают влияние также на пищеварение. Введение любого из простагландинов ППг или ПГЕг в желудочную артерию собак вызывет увеличение кровотока и угнетение выделения кислоты, а при пероральном приеме некоторые аналоги ПГЕ одновременно угнетают выделение кислоты и оказывают прямое защитное действие на слизистую оболочку пищеварительного тракта. В экспериментах in vitro Простагландины стимулируют гладкую мускулатуру пищеварительного тракта и тем самым повышают его двигательную активность, но не совсем ясно, имеют ли эти эффекты физиологическое значение.
Нейропередача. ПГЕ угнетает выход норадреналина из симпатических нервных окончаний. Действие ПГЕ на секрецию этого нейромедиатора, по-видимому, осуществляется на пресинаптическом уровне, т. е. в участке нервного окончания, расположенном проксимальнее синаптической щели; оно может быть обратимо при увеличении концентрации кальция в перфузионной среде. Поэтому ПГЕг способен подавлять высвобождение норадреналина путем блокирования поступления кальция внутрь клетки. Ингибиторы синтеза ПГЕг усиливают высвобождение норадреналина в ответ на стимуляцию адренергических нервов.
Катехоламины обладают способностью высвобождать ПГЕг из различных тканей, и происходит это, вероятно, посредством адренергически-опосредованного механизма. Например, в иннервированных тканях, таких как ткани селезенки, нервная стимуляция или инъекция норадреналина вызывает высвобождение ПГЕг. Это высвобождение блокируется после денервации или введения а-адрено-блокирующих средств. Таким образом, активирующий нерв стимул вызывает освобождение норадреналина, который в свою очередь стимулирует синтез и высвобождение ПГЕг; затем ПГЕг посредством обратной связи действует на пресинаптическом уровне на нервное окончание, уменьшая количество высвобождаемого норадреналина.
Эндокринная функция поджелудочной железы. ПГЕг оказывает как стимулирующее, так и угнетающее влияние на секрецию инсулина b-клетками поджелудочной железы in vitro. In vivo ПГЕ2 подавляет реакцию инсулина на внутривенное введение глюкозы. Это подавление, по-видимому, является специфичным по отношению к глюкозе, потому что реакция инсулина на другие средства, усиливающие секрецию, под действием ПГЕ2 не изменяется. Предположение о том, что эндогенный ПГЕ2 in vivo угнетает секрецию инсулина, подтверждается исследованиями ингибиторов синтеза простагландина. Обычно такие лекарственные средства усиливают секрецию инсулина и увеличивают толерантность к углеводам. Исключением является индометацин, который подавляет вызываемую глюкозой секрецию инсулина и может вызвать развитие гипергликемии. Такие противоречивые результаты исследований индометацина, вероятно, обусловлены каким-то иным действием, помимо угнетения циклооксигеназы. Липооксигеназный путь, по-видимому, играет роль в усилении секреции инсулина, участвуя в процессе стимул-секреции. В этом случае вероятным активным продуктом арахидоновой кислоты может быть 12-ГПЭТЕ.
Лютеолиз. Экстирпация матки во время лютеальной фазы яичникового цикла у овец приводит к сохранению желтого тела. Это позволяет предположить, что маткой в норме вырабатывается лютеолитическое вещество. Можно предположить, что этим веществом является ПГЕ2, поскольку он может вызывать регрессию желтого тела.
Патофизиология метаболитов арахидоновой кислоты. В большинстве случаев развитие какого-либо заболевания сопровождается чрезмерно высоким уровнем продуцирования метаболитов арахидоновой кислоты, но некоторые нарушения могут быть связаны и со сниженным их продуцированном. Последнее может произойти в результате: недостатка употребления арахидоновой кислоты (незаменимой жирной кислоты с пищей); повреждения ткани, необходимой для синтеза простагландинов, или вследствие лечения лекарственными средствами, угнетающими ферменты в цепи синтеза.
Резорбция костей: гиперкальциемия, обусловленная злокачественным заболеванием (см. также гл. 303 и 336). Гиперкальциемия развивается при различных злокачественных заболеваниях паращитовидных желез. В ряду случаев причиной может служить избыток гормона паращитовидных желез в результате или автономного продуцирования его тканью паращитовидных желез, или эктопического образования самой опухолью. Однако у большинства больных, страдающих гиперкальциемией, обусловленной злокачественным заболеванием, не отмечается повышенного уровня содержания гормона паращитовидных желез в плазме крови, так что этиология этой гиперкальциемии находится в сфере повышенного интереса.
Простагландин Е2 является мощным пусковым механизмом резорбции костей и высвобождения из них кальция. У животных, страдающих гиперкальциемией, которым были трансплантированы опухоли, отмечается повышенное продуцирование ПГЕ2. Лечение этих животных ингибиторами синтеза ПГЕ2 приводит к снижению концентрации этого простагландина и одновременному снижению уровня гиперкальциемии. Подобно этому, у некоторых больных, страдающих гиперкальциемией и злокачественными опухолями, определяется большое количество метаболитов ПГЕ2 в моче, в то время как у больных с нормальной концентрацией кальция в крови и страдающих аналогичными злокачественными опухолями, такого повышения уровня содержания метаболитов ПГЕ2 в моче не отмечается. Лекарственные средства, подавляющие синтез простагландинов. снижают концентрацию кальция в крови у некоторых больных, страдающих гиперкальциемией, обусловленной злокачественным заболеванием. Таким образом, приблизительно у 5—10% больных с гиперкальциемией и злокачественными опухолями отмечают повышенный уровень продуцирования ПГЕ, и им может быть показана терапия лекарственными средствами, угнетающими синтез простагландинов.
Источник избыточного количества ПГЕ2 в крови у таких больных не выявлен. Следовало бы ожидать компенсации этого избытка путем повышенного уровня расщепления ПГЕ в печени и легких. Однако возможно, что опухолью высвобождаются в циркулирующую кровь настолько большие количества ПГЕ2, что расщепление его в печени и легких оказывается недостаточным, чтобы скомпенсировать такую нагрузку. При наличии метастазов в легких венозный отток от этих опухолей может вливаться в большой круг кровообращения, минуя легочную ткань. Другим возможным механизмом является метастатическое поражение костей. Опухолевые клетки в культуре синтезируют ПГЕ, метастатические опухолевые клетки в кости также могут синтезировать этот простагландин, который будет действовать локально, вызывая резорбцию кости. Гиперкальциемия, обусловленная злокачественным заболеванием, может развиться и при отсутствии видимых костных метастазов, хотя следует отметить, что существующие в настоящее время клинические методы визуализации подобных метастазов, такие как радиоизотопное сканирование, могут оказаться недостаточно чувствительными для выявления многих очагов поражения с небольшими размерами.
Резорбция кости: ревматоидный артрит и зубная киста (см. гл. 263). Было установлено, что избыточное продуцирование ПГЕ2 служит причиной юкстаартикулярного остеопороза и эрозий костей у некоторых больных, страдающих ревматоидным артритом. Пораженные ревматизмом синовиальные оболочки синтезируют ПГЕ2 в культуре тканей, культуральная среда которых способна вызывать резорбцию кости; добавление же индометацина в среду для культивирования таких клеток блокирует эту способность к резорбции. Поскольку индометацин не предотвращает резорбцию костей, обусловленную ранее образовавшимся ПГЕ2, предполагают, что за эту резорбционную активность ответствен ПГЕ2, вырабатываемый в синовиальных оболочках.
Клетки доброкачественных зубных кист также вызывают резорбцию кости и синтезируют ПГЕ2 в культуре тканей. И в этом случае резорбцию, вызванную средой из этих культур, можно уменьшить добавлением в нее индометацина перед инкубацией. Сходной проблемой является резорбция костной ткани зубных альвеол у больных, страдающих пародонтозом, распространенным воспалительным, заболеванием десен. Уровни содержания ПГЕ2 в десне при воспалении выше, чем в здоровых тканях. Таким образом, вероятно, что резорбция костных тканей зубных альвеол может быть обусловлена, по меньшей мере отчасти, локальным избыточным продуцированном этих метаболитов.
Синдром Бартера (см. гл. 228). Синдром Бартера характеризуется повышенными уровнями содержания ренина, альдостерона и брадикинина в плазме крови; резистентностью к прессорному действию ангиотензина; гипокалиемическим алкалозом и опустошением запасов калия в почках при наличии нормального артериального давления. Основанием для постулированной роли простагландинов при этом заболевании является то, что ПГЕ2 и ПГI2 стимулируют высвобождение ренина и прессорная реакция на введенный ангиотензин притупляется сосудорасширяющими эффектами этих простагландинов. Увеличение высвобождения ренина ведет к повышенной секреции альдостероца, которая в свою очередь может увеличить активность калликреина в моче.
В соответствие с этим в моче страдающих синдромом Бартера больных отмечают повышенные уровни содержания ПГЕ2 и б-кето-ПГF1a. У таких больных была выявлена также и гиперплазия интерстициальных клеток мозгового вещества почек (которые синтезируют ПГЕ в культуре). Выявление этих фактов привело к попыткам лечения этого заболевания ингибиторами синтеза простагландинов. Индометацин (и другие ингибиторы) устраняет фактически все нарушения, за исключением гипокалиемии. Таким образом, простагландин (вероятно, ПГЕ2 и/или ПГI2), возможно, опосредует некоторые проявления синдрома Бартера.
Сахарный диабет (см. гл. 327). Внутривенное введение больших количеств глюкозы здоровым людям вызывает резкое (первая фаза) увеличение секреции инсулина в плазму крови, за которым следует более медленная и более длительная реакция (вторая фаза секреции инсулина). У больных, страдающих сахарным диабетом типа II (инсулиннезависимый, развитие которого начинается в зрелом возрасте), отсутствует первая фаза высвобождения инсулина в ответ на введение глюкозы и отмечается непостоянная степень снижения секреции инсулина во второй фазе. Реакция инсулина на другие вещества, стимулирующие секрецию, такие как аргинин, изарин, глюкагон и секретин, сохраняется. Таким образом, у больных диабетом, по-видимому, имеется специфический дефект, препятствующий нормальному восприятию сигналов от глюкозы. Поскольку ПГЕ угнетает индуцированную глюкозой секрецию инсулина у здоровых людей, то больным сахарным диабетом типа II назначали ингибиторы синтеза эндогенного простагландина с целью определить, происходит ли при этом восстановление секреции инсулина. Как натрия салицилат, так и ацетилсалициловая кислота повышают базальные уровни содержания инсулина в плазме крови и частично восстанавливают первую фазу реакции инсулина на глюкозу; увеличивается секреция инсулина и во второй фазе, повышается толерантность к глюкозе.
Незаращение артериального протока (см. гл. 185). В экспериментах на животных установлено, что артериальный проток у овец чувствителен к сосудорасширяющим свойствам ПГЕ2, а в тканях стенки протока присутствуют ПГЕ-подобные вещества. Таким образом, сохранять артериальный проток незаращенным в пренатальном периоде может повышенная концентрация эндогенного ПГЕ2. Поскольку ингибиторы синтеза простагландина вызывают сужение артериального протока у плодов овец, были предприняты попытки введения индометацина недоношенным детям с изолированным незаращенным артериальным протоком. После нескольких суток такого лечения последовало закрытие просвета протока у большинства детей, хотя некоторым из них для этого потребовался второй курс лечения, а у небольшого числа детей сохранилась необходимость выполнить хирургическую перевязку артериального протока. Наиболее вероятно получение благоприятного результата лечения индометацином у детей, срок внутриутробного развития которых не превышает 35 недель.
Больным с врожденными пороками сердца определенных типов для выживания необходимо наличие незаращенного артериального протока. Это является жизненно важным в таких случаях, когда артериальный проток является основным каналом, по которому неоксигенированная кровь из дуги аорты достигает легких, например, при атрезии легочной артерии и атрезии .правого предсердно-желудочкового клапана. Поскольку ПГЕ расслабляет гладкую мускулатуру в артериальном протоке ягнят, были сделаны клинические попытки внутривенного введения ПГЕ с целью поддержания артериального протока у таких больных в незаращенном состоянии в качестве альтернативы немедленному хирургическому вмешательству. Подобное введение ПГЕ вызывает кратковременное увеличение притока крови к легким и повышение насыщения артериальной крови кислородом, до тех пор пока не появится возможность выполнения необходимой корригирующей операции на сердце. Наличие значительного объема праволевого шунтирования при таких пороках сердца позволяет избежать расщепления внутривенно введенного ПГЕ2 в легких, прежде чем он попадет в артериальный проток. В этом случае характер заболевания сам по себе облегчает доставку лекарственного средства к месту его действия.
Язвенная болезнь желудка (см. гл. 235). Повышенная секреция кислоты в желудке у людей, страдающих язвенной болезнью, вносит свой вклад в повреждение слизистой оболочки органа. Существуют различные аналоги ПГЕ2, которые угнетают секрецию соляной кислоты в желудке и являются по своей природе также и цитопротекторами. Эти вещества более эффективны, чем плацебо, для устранения болей и снижения секреции кислоты в желудке у страдающих язвенной болезнью людей. Кроме того, сообщалось об ускорении заживления язв, оцениваемом эндоскопически, у больных, получавших аналоги ПГЕ, по сравнению с больцыми, получавшими плацебо.
Дисменорея (см. гл. 331). Как правило, дисменорея связана с усилением сократимости матки. Тот факт, что некоторые анальгетики, используемые для лечения этого заболевания, также угнетают синтез простагландина, позволяет предположить, что в патогенезе дисменореи определенную роль могут играть метаболиты арахидоновой кислоты. Простагландины серий Е и F присутствуют в эндометрии у женщин. Внутривенное введение любого из них вызывает сокращение матки, а уровни содержания ПГF и ПГЕ в менструальной крови снижаются после введения ингибиторов синтеза простагландина. Результаты контролируемых исследований по сравнению эффективности ингибиторов синтеза простагландина и плацебо у страдающих дисменореей женщин показывают более выраженное симптоматическое улучшение после лекарственной терапии.
Астма (см. гл. 202).
Воспалительная реакция и иммунный ответ (см. гл. 62 и 260). Такие лекарственные средства, как, например, ацетилсалициловая кислота, обладают жаропонижающим, противовоспалительным и аналгезирующим действием. Существует несколько доводов в пользу наличия связи между воспалением и метаболитами арахидоновой кислоты: 1 — воспалительные стимулы, такие как гистамин и брадикинин, одновременно с индуцированном воспаления вызывают и высвобождение эндогенных простагландинов; 2 — лейкотриены C4-D4-E4 обладают более сильным, чем гистамин, бронхоспастическим действием; 3 — некоторые метаболиты арахидоновой кислоты вызывают расширение сосудов и гипералгезию; 4 — в очагах воспаления выявляют присутствие ПГЕ2 и ЛТВ4; полиморфно-ядерные клетки высвобождают эти вещества во время фагоцитоза, а они в свою очередь вызывают хемотаксис лейкоцитов; 5 — некоторые простагландины вызывают увеличение сосудистой проницаемости, являющейся характерной чертой воспалительной реакции, приводящей к местному отеку; 6 — индуцированное ПГЕ расширение сосудов не устраняется атропином, анаприлином, метисергидом (Methysergide) или антигистаминными средствами, являющимися известными антагонистами других возможных медиаторов воспалительной реакции; таким образом, ПГЕ может оказывать прямое воспалительное действие, а некоторые медиаторы воспаления могут функционировать, оказывая влияние на высвобождение ПГЕ; 7 — некоторые метаболиты арахидоновой кислоты могут вызвать боль у экспериментальных животных и гипералгезию, или повышенную болевую чувствительность у человека; 8—ПГЕ может привести к развитию лихорадки после его введения в желудочки головного мозга или в гипоталамус экспериментальных животных; 9 — пирогенные вещества вызывают повышение концентрации простагландинов в цереброспинальной жидкости, в то время как ингибиторы синтеза простагландина уменьшают интенсивность лихорадки и снижают высвобождение простагландинов в цереброспинальную жидкость.
Метаболиты арахидоновой кислоты также играют определенную роль в иммунном ответе. Небольшие количества ПГЕ2 могут подавлять стимуляцию лимфоцитов у человека, вызываемую такими митогенными веществами, как фитогемагглютинин, а воспалительная реакция бывает связана с локальным высвобождением метаболитов арахидоновой кислоты; таким образом, эти вещества могут действовать как негативные модуляторы функции лимфоцитов. Высвобождение ПГЕ митогенстимулированными лимфоцитами может представлять собой часть контрольного механизма обратной связи, посредством которого реализуется активность лимфоцитов. Чувствительность лимфоцитов к угнетающему действию ПГЕ2 у человека повышается с возрастом, а индометацин увеличивает чувствительность лимфоцитов к действию митогенов в большей степени у пожилых людей. Культура лимфоцитов, взятых у страдающих лимфогранулематозом больных, высвобождает больше ПГЕ2 после добавления фитогемагглютинина, а чувствительность лимфоцитов увеличивается под действием индометацина. Если удалить супрессорные Т-лимфоциты из соответствующих культур, то количество синтезируемого ПГЕ2 уменьшается, а чувствительность лимфоцитов, взятых у больных , лимфогранулематозом и у здоровых людей, становится одинаковой. Подавление клеточного иммунитета у страдающих лимфогранулематозом больных может быть результатом угнетения простагландином Е функции лимфоцитов.
Дата добавления: 2016-03-05; просмотров: 1245;
