Цикл и теоремы Карно.
Циклом Карно называется круговой цикл, состоящий из 2-х изотермических и из 2-х адиабатных процессов. Обратимый цикл Карно в p,υ- и T,s- диаграммах показан на рис.3.1.
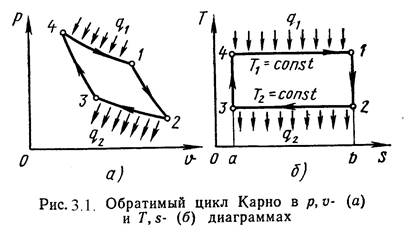
1-2 – обратимое адиабатное расширение при s1=Const. Температура уменьшается от Т1 до Т2.
2-3 – изотермическое сжатие, отвод теплоты q2 к холодному источнику от рабочего тела.
3-4 – обратимое адиабатное сжатие при s2=Const. Температура повышается от Т3 до Т4.
4-1 – изотермическое расширение, подвод теплоты q1 к горячего источника к рабочему телу.
Основной характеристикой любого цикла является термический коэффициент полезного действия (т.к.п.д.).
ht = Lц / Qц , (3.8)
или
ht = (Q1 – Q2) / Q1 .
Для обратимого цикла Карно т.к.п.д. определяется по формуле:
htк = (Т1 – Т2) / Т1 . (3.9)
Отсюда следует 1-я теорема Карно:
|| "Термический к.п.д. обратимого цикла Карно не зависит от
|| свойств рабочего тела и определяется только температурами
|| источников".
Bиз сравнения произвольного обратимого цикла и цикла Карно вытекает 2-я теорема Карно:
|| "Обратимый цикл Карно является наивогоднейшим циклом в || заданном интервале температур"
Т.е. т.к.п.д. цикла Карно всегда больше т.к.п.д. произвольного цикла:
htк > ht . (3.10)
Тема 4. Термодинамические процессы.
4.1. Метод исследования т/д процессов.
Как сказано выше первый закон т/д устанавливает взаимосвязь между количеством теплоты, внутренней энергией и работой. При этом, количество теплоты подводимое к телу или отводимое от тела зависит от характера процесса.
К основным т/д процессам относятся: изохорный, изотермический, изобарный и адиабатный.
Для всех этих процессов устанавливается общий метод исследования, который заключается в следующем:
- выводится уравнение процесса кривой Pυ и TS – диаграммах;
- устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
- определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа:
Du = сvм|0t2·t2 - сvм|0t1·t1. (4.1)
или при постоянной теплоемкости DU = m·сv·(t2 - t1); (4.2)
вычисляется работа: L = P·(V2 – V1); (4.3)
определяется количество теплоты, участвующее в процессе:
q = cx·(t2- t1); (4.4)
определяется изменение энтальпии по формуле, справедливой для всех процессов идеального газа:
Di = (i2 – i1) = сpм|0t2·t2 – сpм|0t1·t1, (4.5)
или при постоянной теплоемкости: Di = сp·(t2 – t1); (4.6)
определяется изменение энтропии:
Ds = cv·ln(T2/T1) + R·ln(υ 2/υ 1) ; (4.7)
Ds = cp·ln(T2/T1) - R·ln(P2/P1) ; (4.8)
Ds = cv·ln(T2/T1) + cp·ln(υ 2/υ 1) . (4.9)
Все процессы рассматриваются как обратимые.
Дата добавления: 2016-02-20; просмотров: 600;
