ОРГАНИЧЕСКИЕ КИСЛОТЫ И ОСНОВАНИЯ
План
1. Классификация органических реакций:
а) по характеру изменения связей в реагирующих веществах;
б) по конечному результату (или по направлению) реакции.
2. Кислотно-основные взаимодействия.
Органических реакций очень много, однако, используя различные критерии, их можно классифицировать. В результате всё многообразие реакций можно свести к небольшому числу типов реакций.
Взаимодействующие в органической реакции вещества подразделяют на реагент и субстрат. При этом считается, что реагент атакует субстрат. Субстратом, как правило, считают молекулу, которая предоставляет атом углерода для новой связи.
Классификация органических реакций:
1. по характеру изменения связей в реагирующих веществах реакции подразделяют на радикальные и ионные.
а) Радикальные реакции протекают с участием радикалов (R.) - частиц с неспаренным электроном и образуемых в результате гомолитического разрыва ковалентной связи, например CI:CI → ·CI + ·CI. Для радикалов характерна высокая реакционная активность, реакции с их участием протекают с очень большой скоростью. Примеры радикальных реагентов: ·CI,·Br, ·J, ·NO2, ·OH, ·R(алкил) и др.
б) Ионные реакции протекают с участием ионов, образуемых в результате гетеролитического разрыва ковалентной связи: Е :N → Е+ + :N-.
Электрофилы (электро+фил - любящий электрон) (Е): Br+, Cl+, H+, R+, NO2 + и нейтральные молекулы с электронодефицитным центром - SO3, BF3, соли алюминия, цинка, железа (III) и др. Электрофил представляет незаполненные, вакантные орбитали для образования ковалентной связи.
Нуклеофилы (нуклеос+фил - любящий протон) (N): Hal-, OH-, RO-, RS-, RCOO-, R-, CN- и нейтральные молекулы с неподеленной электронной парой, например H2O:, ROH, :NH3, RNH2 и др.За счет пары электронов нуклеофил способен образовывать новую ковалентную связь.
2. по конечному результату (или по направлению) реакции подразделяют:
а) реакции присоединения - символ А (анг.-addition).Присоединение реагента к субстрату происходит по π-связям или по σ-связям циклических структур (размыкание цикла), в результате реакций образуются новые ковалентные σ-связи. Реакции присоединения могут быть электрофильными (АЕ):
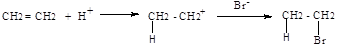
нуклеофильными (АN):
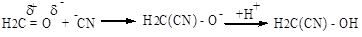
 радикальными АR:
радикальными АR:
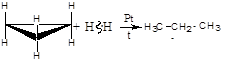
.
Реакции присоединения водорода называют гидрированием, воды - гидратацией, галогенов - галогенированием (хлорирование, бромирование и т.д.), галогеноводородов - гидрогалогенированием и др.
б) реакции замещения - символ S (анг.-substitution).Замещение происходит по σ-связям субстрата, в результате реакций образуются новые ковалентные σ-связи. Реакции замещения могут быть электрофильными (SЕ):
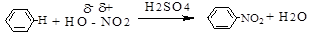
нуклеофильными (SN):
Н3Сδ+-Оδ- H + Нδ+-Clδ- → Н3С-Cl + HОН,
радикальными (SR):
Н3С-H + Cl-Cl → Н3С-Cl + HCl.
в) реакции отщепления или элиминирования - символ Е (анг.- elimiation). Отщепление происходит по σ-связям субстрата. В результате α, ß-отщепления образуются новые π-связи, в результате α,γ- или α,δ-отщепления образуются новые ковалентные σ-связи циклических соединений.
Например:
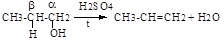

СI-СН2-СН2-СН2-СI + Zn→ + Zn СI2
Реакции отщепления водорода называют дегидрированием, воды - дегидратацией, галогенов - дегалогенированием (дехлорирование, дебромирование и т.д.), галогеноводородов - дегидрогалогенированием и др.
г) перегруппировки. В процессе перегруппировок внутри молекулы происходит миграция атома или групп атомов от одного атома к другому. Например:
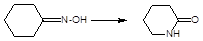
д) окислительно-восстановительные. Окислительно-восстановительный характер органических реакций определяют иначе по сравнению с неорганическими реакциями. Так, окисление - образование новых связей углерода с атомами более электроотрицательных элементов (галогены, кислород, азот, сера и т.д.), иногда в реакциях этого типа число атомов водорода в продукте реакции может уменьшаться. Например:
СН3-СН2-ОН + [О] → СН3-СН=О
Восстановление - образование новых связей С-Н, при этом часто число атомов водорода в продукте реакции увеличивается. Например:
СН3-СН=СН-СН3 + Н2 → СН3-СН2-СН2-СН3
е) по числу реагирующих частиц. Большинство органических реакций состоят из нескольких последовательных или параллельных элементарных стадий. В зависимости от числа частиц, участвующих в скорость-определяющей стадии (самой медленной или лимитирующей), различают мономолекулярные и бимолекулярные реакции. Например, реакции мономолекулярного и бимолекулярного нуклеофильного замещения (символы SN1 и SN2), мономолекулярного и бимолекулярного отщепления (символы Е1 и Е2) и др.
Дата добавления: 2016-02-20; просмотров: 1100;
