Правила преобразования проекционных формул.
1. Формулы можно вращать в плоскости чертежа на 180о, не меняя их стереохимического смысла:
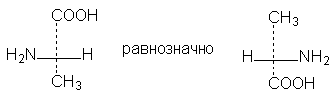
2. Две (или любое четное число) перестановки заместителей у одного асимметрического атома не меняют стереохимического смысла формулы:
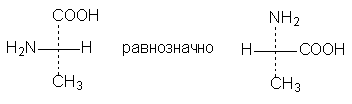
3. Одна (или любое нечетное число) перестановка заместителей у асимметрического центра приводит к формуле оптического антипода:

4. Поворот в плоскости чертежа на 90о превращает формулу в антипод.
5. Вращение любых трех заместителей по часовой стрелке или против не меняет стереохимического смысла формулы:
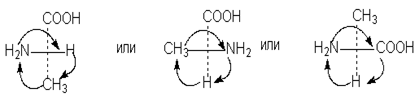
6. Проекционные формулы нельзя выводить из плоскости чертежа.
Оптической активностью обладают органические соединения, в молекулах которых хиральными центрами являются и другие атомы, например кремния, фосфора, азота, серы.
Соединения с несколькими асимметрическими атомами углерода существуют в виде диастереомеров, т.е. пространственных изомеров, не составляющих друг с другом оптических антиподов.
Диастереомеры отличаются друг от друга не только оптическим вращением, но и всеми другими физическими константами: у них разные температуры плавления и кипения, разные растворимости и др.
Число пространственных изомеров определяют по формуле Фишера N=2n, где n - число асимметрических атомов углерода. Число стереоизомеров может уменьшаться из-за частичной симметрии, появляющейся в некоторых структурах. Оптически неактивные диастереомеры называют мезо-формами.
Номенклатура оптических изомеров:
а) D- , L- номенклатура
Для определения D- или L-ряда изомера конфигурацию (положение ОН–группы у асимметричного атома углерода) сравнивают с конфигурациями энантиомеров глицеринового альдегида (глицериновый ключ):

L-глицериновый альдегид D-глицериновый альдегид
Применение D-, L-номенклатуры в настоящее время ограничено тремя классами оптически активных веществ: углеводами, аминокислотами и оксикислотами.
б) R -, S-номенклатура (номенклатура Кана, Ингольда и Прелога)
Для определения R(правый)- или S(левый)-конфигурации оптического изомера необходимо расположить заместители в тетраэдре (стереохимической формуле) вокруг асимметрического углеродного атома таким образом, чтобы самый младший заместитель (обычно это водород) имел направление «от наблюдателя». Если переход трех остальных заместителей от старшего к среднему и младшему по старшинству происходит по часовой стрелке- это R-изомер (падение старшинства совпадает с движением руки при написании верхней части буквы R). Если переход происходит против часовой стрелки - это S-изомер (падение старшинства совпадает с движением руки при написании верхней части буквы S).
Для определения R- или S-конфигурации оптического изомера по проекционной формуле необходимо путем четного числа перестановок расположить заместители так, чтобы самый младший из них оказался внизу проекции. Падение старшинства остальных трех заместителей по часовой стрелке соответствует R-конфигурации, против часовой стрелки - S-конфигурации.
Получают оптические изомеры следующими методами:
а) выделение из природных материалов, содержащих оптически активные соединения, например белки и аминокислоты, углеводы, многие оксикислоты (винная, яблочная, миндальная), терпеновые углеводороды, терпеновые спирты и кетоны, стероиды, алкалоиды и др.
б) расщепление рацематов;
в) асимметрический синтез;
г) биохимическое получение оптически активных веществ.
ЗНАЕТЕ ЛИ ВЫ, ЧТО
-Явление изомерии (от греч.- isos — разный и meros - доля, часть) открыто в 1823г. Ю. Либихом и Ф. Вёлером на примере солей двух неорганических кислот: циановой Н-О-С≡N и гремучей Н-О-N= С.
-В 1830 г. Ж.Дюма распространил представление об изомерии на органические соединения.
-В 1831г. термин «изомер» для органических соединений предложил Й. Берцелиус.
-Стереоизомеры природных соединений характеризуются разной биологической активностью (аминокислоты, углеводы, алкалоиды, гормоны, феромоны, лекарственные вещества природного происхождения и т.д.).
ЛЕКЦИЯ № 5.
Дата добавления: 2016-02-20; просмотров: 2133;
