Кислотно-основные взаимодействия
В настоящее время существуют две основных теории кислот и оснований: теория Брёнстеда-Лоури (1923 г.) и теория Льюиса (1926 г.).
Кислоты Брёнстеда – это соединения, способные отдавать протон (доноры протона).
Основания Брёнстеда – это соединения, способные присоединять протон (акцепторы протона). Для взаимодействия с протоном основание должно иметь свободную пару электронов или электроны π-связи.
Кислоты и основания образуют сопряженные кислотно-основные пары:
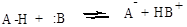
В зависимости от природы элемента, с которым связан протон, различают четыре основных типа органических кислот Брёнстеда:
O-H-кислоты - карбоновые кислоты, спирты, фенолы;
S-H-кислоты - тиолы;
N-H-кислоты - амины, амиды, имиды;
C-H-кислоты - углеводороды и их производные.
Мерой силы кислоты является константа кислотности (ионизации) Ка или рКа. Чем больше Ка (или меньше рКа), тем сильнее кислота.
В зависимости от природы атома, к неподеленной паре электронов которого присоединяется протон, основания Брёнстеда делят на три основных типа:
N (аммониевые) основания - амины, нитрилы, азотсодержащие гетероциклические соединения;
О (оксониевые) основания - спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты и их функциональные производные;
S (сульфониевые) основания - тиолы, сульфиды.
Особый тип оснований Бренстеда представляют π-основания, в которых центром основности являются электроны π-связи (алкены, арены).
При прочих равных условиях для элементов одного периода с ростом электроотрицательности атома кислотность соединений увеличивается, так как высокая электроотрицательность атома при кислотном центре стабилизирует образующийся при отщеплении протона анион. Так, кислотность уменьшается в ряду:
OH-кислоты> NH-кислоты> CH-кислоты
Для элементов одной подгруппы с возрастанием заряда ядра и поляризуемости атома кислотность соединений увеличивается:
OH-кислоты < SH-кислоты
Введение заместителя в углеводородный радикал влияет на силу кислоты. Электроноакцепторные (ЭА) заместители увеличивают, а электронодонорные (ЭД) - уменьшают кислотность, поскольку электроноакцепторные заместители стабилизируют сопряженное основание (анион), а электронодонорные заместители - дестабилизируют.
Основность уменьшается в ряду:
N-основания > О-основания > S-основания (NOS)
Введение электронодонорных заместителей увеличивает, а введение электроакцепторных - понижает основность.
Дж. Льюисом была предложена более общая теория кислот и оснований.
Основания Льюиса – это доноры пары электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.)
Кислоты Льюиса – это акцепторы пары электронов, т.е. соединения, имеющие вакантную орбиталь (ион водорода и катионы металлов: H+, Ag+, Na+, Fe2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3). Кислотно-основное взаимодействие по Льюису - это доноро-акцепторное взаимодействие и любую гетеролитическую реакцию можно представить как взаимодействие кислоты и основания Льюиса.
ЛЕКЦИЯ 6.
Дата добавления: 2016-02-20; просмотров: 1472;
