Адсорбция на поверхности раздела твердое вещество — жидкость.
Как показали исследования, процесс адсорбции растворенных веществ на твердой поверхности гораздо сложнее процесса адсорбции на поверхности жидкостей. Общая теория адсорбции на твердой поверхности в достаточной мере еще не разработана. Ее создание осложняется не только особым характером поверхности твердых адсорбентов, но и тем, что при адсорбции из раствора происходит одновременная адсорбция растворителя и растворенного вещества. Кроме того, необходимо учитывать взаимодействие между молекулами растворенного вещества и растворителя. Вопрос становится еще более сложным, когда растворенным веществом является сильный электролит, и процесс адсорбции принимает ионный характер.
На границе твердое тело — раствор различают два вида адсорбции — молекулярную, или адсорбцию неэлектролитов, когда твердое тело адсорбцирует молекулы адсорбтива, и адсорбцию ионную, когда адсорбент избирательно поглощает из раствора один из видов ионов растворенного электролита. Рассмотрим кратко оба вида адсорбции.
Молекулярная адсорбция из растворов. При адсорбции из раствора вместе с молекулами растворенного вещества адсорбируются и молекулы растворителя. Количество тех и других молекул, адсорбируемы/, твердым адсорбентом, зависит от их собственной адсорбционной способности, а также от концентрации растворенного вещества. Опыт показывает, что при малых концентрациях преобладает адсорбция молекул растворенного вещества, при больших — адсорбция растворителя.
На рис. 5.6 приведена зависимость удельной адсорбции (С0 – C)/ m от концентрации адсорбтива в растворе (С0— концентрация растворенного вещества до адсорбции;
С — концентрация вещества после адсорбции; m— масса адсорбента). Как видно из рис. 5.6, вначале количество адсорбированного вещества увеличивается с ростом концентрации его в растворе, затем начинает преобладать адсорбция молекул растворителя, в результате концентрация вещества в растворе повышается и потому дробь (С0 – C)/ m становится отрицательной, так как С0—С<0. Кривая опускается ниже оси абсцисс. Таким образом, более полно адсорбция происходит из растворов низкой концентрации и мерой адсорбции может служить изменение концентрации на единицу массы твердого адсорбента..
Для экспериментального определения величины адсорбции
( Г ) пользуются уравнением Ловица :
Г = 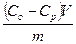 5.8
5.8
где: Со — начальная концентрация адсорбтива, кмоль/кг;
Ср— равновесная концентрация адсорбтива, кмоль/кг;
V— объем раствора, из которого происходит адсорбция, м3;
m— масса адсорбтива, кг.
П. А. Ребиндер предложил правило уравновешивания полярностей, согласно которому адсорбция будет идти, если полярность вещества С, характеризуемая диэлектрической проницаемостью εс, будет находиться между полярностью веществ А и В, т. е. при условии εА>εC>εВ или εА<εC<εВ. Так, на границе вода (в = 80) — толуол (ε = 2,4) анилин (ε = 7,3) является поверхностно-активным веществом, т. е. он хорошо адсорбируется. На границе толуол—воздух (ε =1) анилин несколько повышает поверхностное натяжение, следовательно, поверхностно-активным веществом в данном случае будет являться уже толуол, растворимый в анилине.
На основании правила уравнения полярностей П. А. Ребиндера можно сделать вывод о том, что чем больше разность полярностей между растворимым веществом и раствором, т. е. чем меньше растворимость растворенного вещества, тем лучше оно будет адсорбироваться. Правило распределения полярностей разъясняет порядок ориентации молекул поверхностно-активных веществ на границе раздела твердое тело — жидкость. При этом полярная часть молекулы поверхностно-активных веществ будет обращена к полярной фазе, а неполярная часть — к неполярной. Так, при адсорбции из растворов поверхностно-активных веществ углем или силикагелем имеет место различная ориентация молекул адсорбтива. При адсорбции углем к гидрофобной его поверхности обращена неполярная гидрофобная цепь углеродных атомов, а гидрофильная часть молекулы погружена в воду (рис. 5.7, а). При адсорбции поверхностно-активных веществ из неполярных растворителей силикагелем адсорбируемые молекулы своей гидрофильной частью ориентированы к поверхности адсорбента, а своей гидрофобной углеводородной частью направлены внутрь растворителя (рис. 5.6 .б):
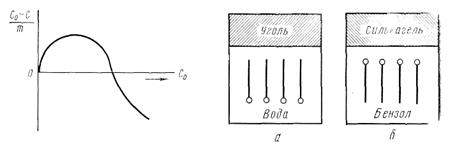
Рис. 5.6 Рис.5.7
Таким образом, все гидрофильные вещества (силикагель, глины) хорошо адсорбируют поверхностно-активные вещества из неполярных или слабо полярных жидкостей. Все неполярные гидрофобные вещества (уголь, графит, тальк, парафин), наоборот, хорошо адсорбируют, поверхностно-активные вещества из полярных жидкостей, например из водных растворов.
На твердом адсорбенте возможны три случая адсорбции:
1) положительная, если растворенное вещество адсорбируется на поверхности адсорбента в большем количестве, чем растворитель;
2) отрицательная, когда в большем количестве адсорбируется растворитель
3) отсутствие адсорбции, когда концентрация растворенного вещества остается одинаковой и на поверхности адсорбента и в объеме раствора. Наибольший практический интерес представляет случай положительной адсорбции.
Сама по себе скорость адсорбции вообще велика, однако в случае адсорбции на твердых адсорбентах эта скорость в какой-то мере лимитируется скоростью диффузии молекул растворенного вещества. Установление адсорбционного равновесия еще более затягивается в случае мелкопористых адсорбентов, например, углей. На практике для ускорения установления адсорбционного равновесия прибегают к энергичному перемешиванию и встряхиванию.
Большое влияние на адсорбируемость того или иного растворенного вещества оказывает не только его природа, но и природа адсорбента и растворителя. Этот вопрос подробно был изучен многими учеными, в частности А. А. Титовым, Л. В. Гуревичем, П. А. Ребиндером и др. Рассмотрим более подробно зависимость адсорбции от свойств твердой поверхности и природы растворителя. В этом случае следует особо отметить свойство смачивания (рис.5.8,а,б). Если на твердую поверхность нанести каплю воды, возможны три случая: 1) капля растекается по поверхности; 2) капля остается на поверхности в виде шарика; 3) капля растекается лишь частично, образуя с поверхностью некоторый так называемый краевой угол (рис. 5.8. а,б):
Рис.5.8
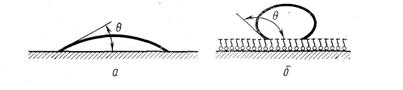
Если капля жидкости растекается по поверхности или образует с ней острый краевой угол 0, это значит, что жидкость смачивает данную поверхность. Степень смачиваемости гладких поверхностей определяется величиной угла или величиной В = cosθ. Чем больше положительное значение cos θ, тем больше смачиваемость (тем больше силы адгезии между молекулами жидкости и молекулами адсорбента по сравнению с силами когезии внутри жидкости). Если угол θ тупой, т. е. если cosθ является величиной отрицательной, смачиваемость отсутствует (силы адгезии в данном случае меньше сил когезии).
По предложению П. А. Ребиндера, твердые поверхности, хорошо смачиваемые водой, называются гидрофильными, а несмачиваемые — гидрофобными. Так как гидрофобные поверхности хорошо смачиваются неполярными органическими жидкостями (например, углеводородами), их называют также олеофильными поверхностями.
Таким образом, адсорбция растворенных веществ твердыми адсорбентами подчиняется одному общему правилу: чем лучше растворитель смачивает поверхность адсорбента, тем меньше адсорбция молекул растворенного вещества из данного растворителя на этой поверхности, и наоборот, если растворитель плохо смачивает твердую поверхность, адсорбция молекул растворенного вещества на ней будет велика.
Так, если растворитель хорошо смачивает поверхность адсорбента, он сильно понижает его поверхностное натяжение, следовательно, на поверхности адсорбента появляется слой адсорбируемых молекул растворителя. Для молекул растворенного вещества не остается (или остается очень мало) места на поверхности адсорбента. В том случае, когда растворитель не смачивает поверхности адсорбента, она остается свободной, и молекулы растворенного вещества адсорбируются на поверхности.
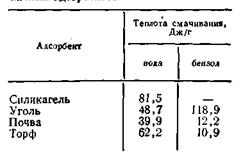
При адсорбции жидкого вещества на твердом адсорбенте выделяется теплота. Количество теплоты, выделенное при адсорбции одним граммом порошкообразного адсорбента данной жидкости, называется теплотой смачивания. Она связана с интенсивностью адсорбции данной жидкости адсорбентом, поэтому по теплоте смачивания можно судить об адсорбционной активности поглотителя. В табл. 5.1 приведены значения теплот смачивания некоторых адcорбентов водой и бензолом.
Из данных таблицы 5.1 видно, что наибольшей активностью к воде обладает силикагель, к бензолу — уголь. Табл.5.1
 Как показали исследования, природу твердой поверхности адсорбента можно изменить: гидрофильную поверхность сделать гидрофобной, а гидрофобную — гидрофильной. Для этого на твердой поверхности адсорбента создают адсорбционный слой из поверхностно-активных веществ, например мыла, жирных кислот. Если гидрофильную поверхность обработать раствором жирной кислоты, поверхность станет гидрофобной. Молекулы кислоты, ориентируясь таким образом, что их полярные группы обращены к поверхности адсорбента, а углеводородные радикалы — в воздух, адсорбируются на поверхности и сообщают ей гидрофобные свойства. Капли воды, как видно из рис. 5.8 б, образуют на поверхности тупые краевые углы и уже не смачивают ее. Аналогичное явление имеет место при гидрофобизации тканей; они становятся водонепроницаемыми в результате пропитки их соответствующими гидрофобными веществами. В качестве последних в настоящее время нашли широкое применение кремнийорганические жидкости.
Как показали исследования, природу твердой поверхности адсорбента можно изменить: гидрофильную поверхность сделать гидрофобной, а гидрофобную — гидрофильной. Для этого на твердой поверхности адсорбента создают адсорбционный слой из поверхностно-активных веществ, например мыла, жирных кислот. Если гидрофильную поверхность обработать раствором жирной кислоты, поверхность станет гидрофобной. Молекулы кислоты, ориентируясь таким образом, что их полярные группы обращены к поверхности адсорбента, а углеводородные радикалы — в воздух, адсорбируются на поверхности и сообщают ей гидрофобные свойства. Капли воды, как видно из рис. 5.8 б, образуют на поверхности тупые краевые углы и уже не смачивают ее. Аналогичное явление имеет место при гидрофобизации тканей; они становятся водонепроницаемыми в результате пропитки их соответствующими гидрофобными веществами. В качестве последних в настоящее время нашли широкое применение кремнийорганические жидкости.
На избирательном смачивании основан процесс флотации, широко применяемый при обогащении руд. Сущность этого процесса заключается в разделении смеси гидрофильного и гидрофобного порошковидных веществ на
основании их избирательного смачивания различными жидкостями. Горную породу или руду перед обогащением тщательно размалывают, затем
энергично размешивают в воде, к которой прибавляют небольшое количество гидрофобного вещества (масла). Примеси обычно гидрофильны, а ценная часть породы — гидрофобна. В результате этого пустая порода остается в водной фазе и оседает на дно, а наиболее ценная часть, обильно смачиваемая маслом, переходит в масляную пленку, затем собирается в специальном отстойнике.
Процесс флотации возможен и без применения масла. На поверхности воды путем энергичного пропускания воздуха создают обильную пену. Гидрофобные частицы горной породы прилипают к пузырькам воздуха, затем вместе с пеной их удаляют в специальный отстойник.
Ионообменная адсорбция. Поскольку сильные электролиты в растворах полностью или почти полностью диссоциированы на ионы, адсорбция электролитов на поверхности твердых адсорбентов в результате действия обычных адсорбционных и электрических сил имеет свои специфические особенности. Иными словами, адсорбция ионов сильных электролитов протекает под воздействием двух родов сил: молекулярно-поверхностных адсорбента и электрических, проявляющихся только при адсорбции ионов.
Обычно различают три основных типа адсорбции электролита: 1) эквивалентная адсорбция; 2) обменная адсорбция; 3) специфическая (избирательная) адсорбция.
При эквивалентной адсорбции происходит эквивалентное поглощение катионов и анионов электролитов, т. е. молекулы электролитов поглощаются целиком. Сам механизм поглощения можно представить следующим образом. Лучше адсорбируемый ион данного электролита притягивает свой парный, менее адсорбируемый ион на поверхность адсорбента. При этом адсорбируемость второго иона возрастает, а первого — уменьшается, так как часть
его удерживается в растворе другим, хуже адсорбируемым ионом. В результате оба иона поглощаются (адсорбируются) эквивалентно, почему эквивалентную адсорбцию часто и называют молекулярной. Она характерна для слабых электролитов. При эквивалентной адсорбции электронейтральность на границе фаз не нарушается.
При обменной адсорбции избирательное поглощение одного из ионов электролита, находящегося в растворе, сопровождается одновременным вытеснением другого иона того же знака из поверхности адсорбента. Обмен ионами протекает в строго эквивалентных количествах, поэтому электронейтральность на границе раздела фаз не нарушается. Опыт показывает, что обменная адсорбция протекает более медленно, чем обычная, и ее можно рассматривать как хемосорбционный процесс.
Мерой степени взаимного обмена ионов служит свободная энергия образования ионнообменника ( Δ F), выраженная уравнением изотермы обмена :
- Δ F =RTlgK 5.9
где К — константа ионного равновесия, определяющая соотношение ионов в поглощенном соотношении при заданной концентрации.
Если при обменной адсорбции взамен поглощаемого иона нейтральной соли адсорбент отдает в раствор эквивалентное количество ионов водорода или гидроксида, такая адсорбция носит название гидролитической. Например, адсорбция на угле неорганических нейтральных солей (NaCl, KC1, KNO3) сопровождается подщелачиванием, т. е. в данном случае по преимуществу адсорбируются анионы, а в раствор поступают ионы ОН-. К гидролитической адсорбции относятся все случаи обменного выделения адсорбентом ионов Н+ или ОН- независимо от того, образовались ли эти ионы в результате тех или иных поверхностных процессов на адсорбенте или же содержались в нем заранее как составная часть молекул. Так, глинистые минералы (каолинит, монтмориллонит) могут участвовать в обменной адсорбции своими Н+- ионами.
Гидролитическая адсорбция имеет большое значение в почвенных условиях, а также в корневом питании растений. На основе представлений об обменной адсорбции К. К. Гедройц создал свое учение о почвенном поглощающем комплексе, которое имеет важное значение для разрешения проблемы повышения плодородия почв. На основании полученного им большого экспериментального материала Гедройц установил, что поглощение иона почвой из раствора сопровождается выходом из нее другого иона в строго эквивалентных количествах. По Гедройцу, носителем обменной адсорбции в почве является почвенный поглощающий комплекс, который представляет собой высокодисперсную смесь нерастворимых в воде алюмосиликатных, органических и органоминеральных соединений. Многочисленными экспериментами Гедройц доказал, что в таком обмене участвуют только катионы, причем обменная способность их тем выше, чем больше валентность (в пределах ионов одной валентности тем выше, чем больше атомная масса).
Обобщая данные изучения ионного обмена в почве можно сказать, что:
а) обменная способность иона тем выше, чем больше его степень окисления,
б) у ионов одной валентности обменная способность возрастает с увеличением массы иона,
в) обмен ионами идет в строго эквивалентных количествах.
По интенсивности поглощения кислыми почвами, еще К.К. Гедройц экспериментально установил ряд катионов:
< Na+ < NH4+ < K+ < Mg2+ < Rb+
< Ca2+ < Cd2+ < Co2+ < Al3+ < H+
Представления Гедройца о катионном обмене в почвах легли в основу современного учения о поглотительной способности почвы, подвижности питательных веществ в почве, механизме поглощения почвами катионов и анионов и закономерностях структурообразования почвы как одного из факторов ее плодородия. По Гедройцу, анионы Cl—, NO3—, SO42— почти не поглощаются почвой. Поэтому считается, что азотное удобрение лучше вносить в виде аммиачной воды, так как нитратный азот селитры легко вымывается. От природы поглощенных ионов зависят агротехнические свойства почвы.
Для снижения жесткости технических вод, которая в основном обусловливается присутствием солей кальция и магния, в технике применяются либо естественные силикаты — цеолиты и глаукониты, либо искусственные алюмосиликаты щелочных металлов, называемые пермутитами. Схематически обменное действие пермутита можно представить следующим образом:
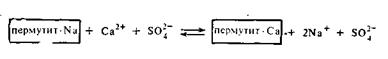
Применение пермутитов позволяет устранить жесткость воды, но не освобождает воду от всех катионов и анионов. Практически полное очищение воды от посторонних катионов было достигнуто лишь в недавнее время путем применения ионообменных смол. Эти смолы или иониты получают введением ионогенных групп (SO3H, COOH, NH2) в скелет углеводородных цепей высокополимерных соединений. Одни смолы имеют кислотный характер (поверхность их заряжена отрицательно) и потому обменно адсорбируют только катионы с заменой любого из них на ион водорода. Такие адсорбенты получили название катионитов. Другие смолы, имеющие основной характер, получили название анионитов. Эти адсорбенты адсорбируют из растворов только анионы в обмен на ионы ОН-.Пропуская воду через особые фильтры, заполненные тонко измельченными катионитом и анионитом, ее полностью очищают от всех катионов и анионов. Очищенная таким образом вода нисколько не уступает по чистоте дистиллированной воде, т. е. очищенной путем перегонки. Очистка воды с применением ионитов может быть представлена следующей схемой:
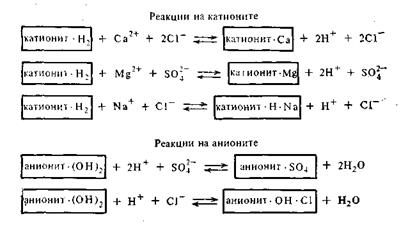
При очистке воды катионит и анионит следует брать в эквивалентных соотношениях.
Для регенерации, т. е. восстановления уже отработанных катионитов, обычно применяют 3—5%-ные растворы серной или соляной кислоты. В результате этого катиониты «заряжаются» ионами водорода:
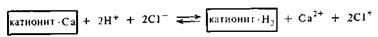
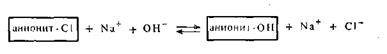
Для восстановления анионитов применяют чаще всего 5%-ный раствор NaOH или КОН:
Возможность получать при помощи ионообменных смол очищенную воду имеет большое значение для питания котлов высокого давления, а также в ряде производств (сахарной промышленности, пивоварения, химии чистых реактивов, производстве фототоваров, лекарственных препаратов). Особенно большое значение ионообменные смолы приобрели за последнее время в винодельческой промышленности. С их помощью производят удаление излишков Fe3+, Cu2+, Ca2+, вызывающих помутнение вина, а также обеспечивают сусло вина. В молочной промышленности иониты широко используются для изменения солевого состава молока. Известно, что коровье молоко богаче женского содержанием соответствующих солей и отличается характером створаживания, что зависит от соотношения кальция и казеина. Удаляя из коровьего молока с помощью ионообменных смол избыток кальция, его делают вполне пригодным для питания грудных детей.
В свое время было предложено несколько уравнений, описывающих обменную адсорбцию. Наиболее точным оказалось теоретически выведенное Б. П. Никольским уравнение, которое имеет следующий вид:
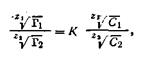
| 5.10 |
где Г1 ,и Г2 — количества поглощенных ионов, выраженные в моль на 1 кг адсорбента, С1 и С2 — концентрации или активности соответствующих ионов в растворе; Z1 и Z2 — валентности ионов; К — константа обмена.
Константа ионного обмена К определяет соотношение ионов в поглощенном состоянии при заданной концентрации в растворе и должна заметно отличаться от единицы.
Вид адсорбции, когда на твердом адсорбенте адсорбируются преимущественно только ионы одного типа, получил название специфической адсорбцииили адсорбции потенциал-определяющих ионов.
В этом случае катионы (или анионы) поглощаются из раствора и необменно фиксируются на поверхности адсорбента, сообщая поверхности свой заряд. Специфическая адсорбция имеет особенно большое значение в коллоидных системах при образовании так называемого двойного электрического слоя.
Процессы специфической адсорбции широко представлены в биологических объектах и в почвах. Согласно С. Н. Алешину, ион водорода (протон) в отличие от других катионов может адсорбироваться многими минералами необменно, что играет большую роль в выветривании различных горных пород и образовании обменной почвенной кислотности.
На адсорбционных явлениях основан важнейший метод анализа сложных смесей — хроматография.
В зависимости от механизма адсорбции растворенного вещества адсорбционная хроматография может быть разделена на два подвида: молекулярная хроматография и ионообменная хроматография. С помощью молекулярной - разделяют неэлектролиты в неводных растворах. Ионообменная хроматография используется для разделения ионов. Наши знания об антибиотиках, витаминах, алкалоидах, а также о динамике обмена веществ в растениях почти целиком получены методами хроматографии. Для хроматографического анализа требуются очень незначительные количества исследуемого вещества –десятые доли миллиграмма или микрограмма.
Дата добавления: 2016-02-20; просмотров: 5049;
