Адсорбция на поверхности раздела жидкость — газ.
Ранее мы выяснили, что мерой свободной поверхностной энергии единицы поверхности является поверхностное натяжение , под которым следует понимать силу, действующую на единицу длины линии, ограничивающей поверхность жидкости. При обсуждении поверхностных явлений обычно говорят не о свободной поверхностной энергии, а о поверхностном натяжении, так как оно для поверхностей раздела жидкость—газ или жидкость—жидкость доступно непосредственному измерению.
В чистой жидкости состав поверхностного слоя одинаков с составом ее в объеме. Поэтому при растворении какого-либо вещества в растворителе возможны три случая:
а) растворение данного вещества в растворителе не изменяет его поверхностного натяжения;
б) растворение повышает поверхностное натяжение растворителя;
в) растворение понижает поверхностное натяжение растворителя.
Поскольку поверхностная энергия в силу второго начала термодинамики стремится к минимуму, то в случае, когда растворение вещества понижает поверхностное натяжение растворителя, концентрация растворенного вещества в поверхностном слое должна быть больше, чем в объеме раствора. И наоборот, когда растворение повышает поверхностное натяжение, поверхностный слой раствора должен быть беднее растворенным веществом по сравнению с общим его объемом. Таким образом, на границе раздела жидкость — газ наблюдается явление уменьшения или увеличения концентрации растворенного вещества, т. е. явление адсорбции.
Величина адсорбирующей поверхности S жидкости может быть точно измерена, чего почти нельзя сделать в отношении, например, твердых адсорбентов. Характерным отличием адсорбции на границе раздела жидкость — газ является и то, что изменение поверхностной энергии в процессе адсорбции может быть определено непосредственно.
Все растворимые вещества по их способности адсорбироваться на границе раздела жидкость—воздух делятся на две группы: поверхностно-активные и поверхностно-неактивные вещества. Первые должны обладать меньшим поверхностным натяжением, чем растворитель, сравнительно малой растворимостью, а также способностью резко изменять свойства поверхности адсорбента в результате образования тонких мономолекулярных адсорбционных слоев.
Поверхностно-активные вещества по своим физико-химическим свойствам делятся на три группы: молекулярные, ионогенные — анионо-активные и ионогенные — катионо-активные.
К молекулярным, или неионогенным, поверхностно-активным веществам относятся электрически нейтральные молекулы спиртов, карбоновых кислот, белковых веществ. Ионогенные анионо-активные поверхностные вещества в 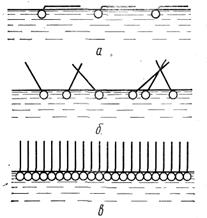 водной среде диссоциируют на ионы, причем поверхностно-активным будет только анион. К ним относятся мыла, сульфокислоты, их соли и другие соединения.
водной среде диссоциируют на ионы, причем поверхностно-активным будет только анион. К ним относятся мыла, сульфокислоты, их соли и другие соединения.
Молекулы катионо-активных поверхностно-активных веществ в водных растворах также диссоциируют на ионы, однако поверхностно- Рис. 5.5 активным будет только катион. К ним относятся органические азотсодержащие основания и их соли ( Рис.5.5(а,б,в))
Характерной особенностью всех поверхностно-активных веществ является то, что молекулы их содержат две части: полярную гидрофильную группу, например ОН, СООН, NH2, и неполярный углеводородный или ароматический радикал (рис.5.5). Полярная группа обладает значительным электрическим моментом диполя и хорошо гидратируется. Эта группа и определяет сродство поверхностно-активных веществ к воде. В отличие от полярной группы углеводородный радикал гидрофобен, т. е. понижает растворимость поверхностно-активных веществ в воде. При взаимодействии поверхностно-активных веществ с водой молекулы их погружаются в воду своими гидрофильными группами, гидрофобная же углеводородная цепь (радикал), располагается выше уровня воды, т. е. как бы «торчит» из воды. Выталкивающее действие воды на гидрофобную часть молекул поверхностно-активных веществ способствует накоплению их в поверхностном слое жидкости. Опыт показывает: чем длиннее углеводородный радикал, тем хуже вещество растворяется в воде, тем большая доля его находится в поверхностном слое и, стало быть, выше его адсорбируемость. За счет накопления поверхностно-активных веществ в поверхностном слое жидкости и происходит уменьшение поверхностного натяжения раствора.
Таким образом, поверхностная активность, следовательно, и адсорбируемость вещества зависят от природы полярной группы, строения молекулы и длины углеводородной цепи. Исследованиями установлено, что с удлинением цепи углеводородного соединения (например, кислоты) растворимость его в воде падает, что хорошо видно из приводимых ниже данных для кислот:

При изучении поверхностного натяжения водных растворов жирных кислот было установлено, что удлинение цепи в жирных кислотах на радикал — СН2 — увеличивает их способность к адсорбции в 3,2 раза. Эта закономерность получила название правила Траубе—Дюкло. Согласно ему длина цепи жирной кислоты возрастает в арифметической прогрессии, а поверхностная активность увеличивается в геометрической прогрессии.
Правило Траубе—Дюкло применимо только для разбавленных растворов. Дело в том, что когда концентрация поверхностно-активных веществ мала, их гидрофобные части лежат на поверхности жидкости (рис. 5.5, а и б). При дальнейшем повышении концентрации адсорбированные молекулы заполняют все места на поверхности, образуя насыщенный слой. Как видно из рис. 5.5, в, такой слой представляет собой мономолекулярную пленку толщиной в одну молекулу адсорбированного вещества. Правило Траубе — Дюкло справедливо также для температур, близких к комнатной. Опыт показывает, что с повышением температуры способность к адсорбции уменьшается, так как увеличивается десорбция, и поверхностная активность падает.
Поверхностно-неактивные вещества обладают следующими характерными особенностями: а) обладают большим по сравнению с растворителем поверхностным натяжением; б) имеют более высокую растворимость.
К поверхностно-неактивным веществам относятся все неорганические электролиты: кислоты, щелочи, соли, а также некоторые органические соединения, например муравьиная НСООН и аминоуксусная H2NCH2COOH кислоты. Поверхностно-неактивные вещества повышают поверхностное натяжение воды, так как их молекулы стремятся уйти с поверхности жидкости вглубь.
Следует также упомянуть и о таких веществах, которые, будучи растворены в воде, не изменяют ее поверхностного натяжения. К числу таких веществ относится, например, сахар. Как показали исследования, молекулы этих веществ равномерно распределяются между поверхностным слоем и объемом раствора.
Математическая зависимость между поверхностным натяжением σ Н/м, концентрацией растворенного вещества С кмоль/м3 и избытком его в поверхностном слое Г кмоль/м2 была установлена Гиббсом еще в 1876 г. и выражается следующей формулой:
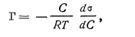
| 5.6 |
где Г – величина адсорбции, количество молей адсорбированного вещества, приходящееся на 1 м2 поверхности, моль/м2;
R – газовая постоянная ( 8,321*10 3 Дж/кмоль*К );
Т – абсолютная температура, К;
СР – равновесная концентрация, кмоль/м3;
s – поверхностное натяжение, Н/м.
Дата добавления: 2016-02-20; просмотров: 2690;
