Общая характеристика сорбционных явлений.
Опыт показывает, что чем выше степень дисперсности данного тела, тем большее количество частиц другого тела оно может поглотить своей поверхностью. Процесс самопроизвольного сгущения растворенного или парообразного вещества (газа) на поверхности твердого тела или жидкости носит название сорбции. Поглощающее вещество носит название сорбента, а поглощаемое — сорбтива. Процесс, обратный сорбции, называется десорбцией. В зависимости от того, насколько глубоко проникают частицы сорбтива в сорбент, все сорбционные процессы подразделяются на адсорбцию, когда вещество поглощается на поверхности тела, и абсорбцию, когда вещество поглощается всем объемом тела. В зависимости от характера взаимодействия частиц сорбента и сорбтива сорбция бывает физическая (взаимодействие проявляется силами когезии и адгезии, т. е. силами Ван-дер-Ваальса) и химическая, или, как ее еще называют, хемосорбция (когда происходит химическое взаимодействие). В свою очередь химическая сорбция подразделяется на абсорбционную и адсорбционную.
Между физической сорбцией, хемосорбцией и типичной химической реакцией очень трудно провести четкие границы, поэтому такое деление имеет лишь условный характер.
Особое положение занимает сорбционный процесс, называемый капиллярной конденсацией. Сущность этого процесса заключается не только в поглощении, но и в конденсации твердым пористым сорбентом, например активированным углем, газов и паров. Капиллярная конденсация в первую очередь наблюдается у легко сжижаемых газов.
Из всех перечисленных выше сорбционных явлений наибольшее значение для практики имеет адсорбция.
Абсорбция—это сорбция газа за счет его проникновения (диффузии) в массу сорбента. По существу, она представляет собой процесс растворения одного вещества (абсорбтива) в другом (абсорбента). Распределение вещества между фазами подчиняется закону Генри, известному из физической химии. Абсорбционные процессы в настоящее время широко применяются в промышленности. Так, получение соляной кислоты в заводских условиях целиком основано на абсорбции хлористого водорода водой. На явлениях абсорбции основаны также разделение газовых смесей, очистка их от различных вредных примесей, улавливание ценной составной части газовой смеси и т. п.
Хемосорбция представляет собой наиболее глубокое взаимодействие поглощаемого вещества и поглотителя с образованием нового химического вещества. В качестве примера хемосорбции можно указать на поглощение оксида углерода (IV) или оксида серы (IV) натронной известью [смесь NaOH и Са(ОН)2], которая, поглощая их, химически взаимодействует с ними.
Хемосорбцию легко можно отличить от физической абсорбции и адсорбции по значительно большему количеству выделяющейся при хемосорбции теплоты,
вполне соизмеримой с теплотами образования химических соединений.
Капиллярная конденсация — процесс конденсации парообразных сорбтивов в порах твердого сорбента. Конденсация зависит от температуры, упругости пара, диаметра капилляров, а также смачиваемости поверхности твердого сорбента сорбтивом в жидком состоянии. Чем уже капилляры и чем лучше жидкость смачивает их стенки, тем при прочих равных условиях скорее происходит насыщение паров и их конденсация.
Явление адсорбции-как известно, всякая поверхность, независимо от агрегатного состояния разделяемых ею веществ, обладает некоторым запасом свободной энергии. В силу второго начала термодинамики поверхность раздела веществ (как и любая система, обладающая запасом свободной энергии) стремится к самопроизвольному уменьшению этой энергии. Это стремление и является прямой или косвенной причиной разнообразных физических явлений, в том числе и адсорбции.
Адсорбция — это в широком смысле процесс самопроизвольного изменения концентрации вещества у поверхности раздела двух фаз, а в более узком и употребительном смысле — это повышение концентрации одного вещества у поверхности раздела двух фаз, из которых одна обычно является твердым телом. В соответствии с общей терминологией по сорбции вещество, на поверхности которого происходит накопление другого вещества, носит название адсорбента, а поглощаемое вещество — адсорбтива или адсорбата.
Количество поглощенного вещества на 1 м2 поверхности адсорбента называется удельной адсорбцией. Так как поверхность любого адсорбента практически измерить трудно, адсорбцию выражают в молях на 1 кг адсорбента и обозначают буквой А:
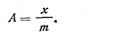
| 5.1 |
Связь между обоими выражениями удельной адсорбции имеет следующий вид:
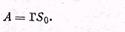
| 5.2 |
Величина удельной адсорбции Г для данного адсорбента и данного адсорбтива зависит от двух термодинамических параметров: температуры Т и давления р при газообразном адсорбтиве и от температуры и концентрации С при адсорбции из раствора.
Как показали исследования, процессы адсорбции (так же как и другие виды сорбционных процессов) обратимы. Частицы, находящиеся в адсорбционных слоях, не закреплены жестко. Некоторые из них могут выходить за пределы действия сил притяжения адсорбента, т. е. отрываться от поверхности адсорбента и уходить в окружающее пространство (десорбция). Со временем оба процесса приводят систему в состояние адсорбционного равновесия:
адсорбция ↔ десорбция,
при котором среднее число частиц, покидающих поверхностный слой, становится равным числу адсорбируемых частиц за тот же отрезок времени.
Процесс адсорбции экзотермичен, следовательно, в соответствии с принципом Ле Шателье его выгодно осуществлять при сравнительно низких температурах. Опыт показывает, что с повышением температуры в силу увеличения колебания частиц, адсорбированных поверхностью, равновесие сдвигается в сторону процесса десорбции.
Помимо обратимости и экзотермичности, адсорбция характеризуется и третьим общим признаком — чрезвычайно малой энергией активации, т.е. низким энергетическим барьером, а следовательно, большой скоростью ее протекания. Благодаря этому адсорбция с энергетической стороны имеет много сходного с обратимыми экзотермическими химическими реакциями, однако отличается от них и от хемосорбции гораздо меньшим значением теплового эффекта.
Чаще всего адсорбция носит избирательный характер. Так, рассмотренный нами активированный уголь хорошо поглощает не только аммиак, но и хлор, однако не адсорбирует окись углерода. Поэтому нельзя пользоваться обычным противогазом при тушении пожаров, так как в зоне пожара всегда много окиси углерода.
Дата добавления: 2016-02-20; просмотров: 2525;
