Адсорбция на поверхности раздела твердое вещество — газ.
Адсорбция газа на твердом теле является простейшим случаем адсорбционного процесса, так как система состоит всего из двух компонентов. Конкретный пример такой адсорбции мы рассмотрели в предыдущем параграфе. Опыт показывает, что при прочих равных условиях для твердого адсорбента и данного адсорбируемого газа количество адсорбируемого вещества будет возрастать по мере увеличения адсорбирующей поверхности. Следовательно, чтобы достигнуть большого адсорбционного эффекта, необходимо иметь как можно большую поверхность поглотителя. Способность адсорбента к поглощению газов определяется не только его пористостью, но и физическим состоянием; так, адсорбенты в аморфном состоянии лучше адсорбируют газы, чем в кристаллическом. В качестве адсорбентов на практике применяют древесный и костяной угли, силикагель, высокодисперсные металлы, полученные восстановлением их из оксидов.
Активированный уголь как адсорбент применяется в противогазах, а также для очистки воздуха на промышленных предприятиях, для осветления различных растворов и т. п. Высокая адсорбционная способность активированного угля объясняется, сильно развитой поверхностью. Так,, суммарная поверхность всех пор, заключающихся в 1 г такого угля, составляет от 300 до 1000 м2. Такая огромная площадь обусловливает возникновение большого молекулярного силового поля и, стало быть, избыток поверхностной энергии на границе уголь — газ. За счет свободной поверхностной энергии и происходит адсорбция газа, т. е. повышение его концентрации в поверхностном слое угля при одновременном понижении концентрации газа в окружающем пространстве.
Как показали исследования, время пребывания молекул газа на поверхности твердого адсорбента очень мало: они удерживаются на адсорбенте всего сотые и тысячные доли секунды и, десорбируясь, замещаются на новые частицы. В конечном итоге устанавливается динамическое равновесие между свободными и адсорбированными молекулами. Скорость достижения адсорбционного равновесия для разных газов неодинакова: при адсорбции СО2 на угле равновесие наступает через 20 с, при адсорбции О2— через 2,5 ч, при адсорбции N2— через 20 ч и т. п. Скорость адсорбции имеет большое значение для практического использования различных адсорбентов. Например, в широко используемом при химической защите противогазе проходящий через коробку воздух должен очень быстро очищаться от примесей отравляющих веществ. Это возможно лишь при высоких скоростях адсорбционных процессов.
Активированный уголь в противогазе играет роль не только адсорбента целого ряда отравляющих веществ, но и катализатора реакции разложения многих из них. В качестве примера можно указать на каталитический гидролиз фосгена
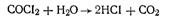
или хлорпикрина
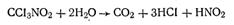
Опыт показывает, что адсорбция зависит не только от природы поглотителя, но и от природы поглощаемого газа, при прочих равных условиях сильнее адсорбируются те газы, которые легче конденсируются в жидкость. Следовательно, они обладают более высокой температурой кипения в сжиженном состоянии.
Для объяснения явлений адсорбции существуют различные теории. Одна из них — физическая теория, согласно которой природа адсорбционных сил чисто физическая и связана с проявлением межмолекулярных сил. Согласно химической теории ненасыщенные силы адсорбционных поверхностных слоев являются химическими (валентными) силами.
Известно несколько теорий физической адсорбции, из которых интерес представляет теория мономолекулярной адсорбции Ленгмюра (1915). В построении ее ученый опирался на представление об адсорбционных силах, которые впервые были высказаны русским ученым Л. Г. Гуревичем. Основные положения теории Ленгмюра:
1. Адсорбция вызывается валентными силами или силами остаточной химической валентности.
2. Адсорбция происходит не на всей поверхности адсорбента, а лишь на активных центрах этой поверхности. Такими центрами являются углубления и выступы, имеющиеся на любой, даже самой гладкой поверхности. Действие таких центров сводится к высокой ненасыщенности их силового поля, благодаря чему центры удерживают газовые молекулы. Причем активность центра тем выше, чем меньше насыщена молекула или атом адсорбента.
3. Адсорбционные силы обладают малым радиусом действия, вследствие чего каждый активный центр адсорбирует лишь одну молекулу адсорбтива, и на адсорбенте образуется мономолекулярный слой адсорбтива.
4. Адсорбированные молекулы газа не сидят прочно на поверхности адсорбента; они непрерывно обмениваются с молекулами в газовой сфере, при этом устанавливается динамическое адсорбционное равновесие. Каждая молекула задерживается в течение короткого времени на поверхности, затем в результате флуктуации энергии молекулы отрываются от активного центра, уступая место новой молекуле.
В отличие от физической адсорбции химическая адсорбция, или хемосорбция, осуществляется при помощи химических сил. Эти виды адсорбции имеют следующие отличительные признаки: физическая адсорбция — явление обратимое, и теплота ее составляет всего 8,4—33,5 кДж/моль, в то время как теплота химической адсорбции достигает десятков и сотен кДж/моль.
С повышением температуры физическая адсорбция уменьшается, а химическая увеличивается.
Объясняется это тем, что химическая адсорбция требует более значительной энергии активации (40—120 кДж/моль).
Химическая адсорбция необратима, поэтому процесс десорбции состоит не в простом отрыве адсорбированной молекулы, а в разложении поверхностного химического соединения. В качестве типичного примера химической адсорбции можно назвать адсорбцию кислорода на поверхности угля.
Весьма характерным является то, что при нагревании с поверхности адсорбента удаляется не кислород, а окись углерода.
Согласно современным представлениям при адсорбции проявляются все виды физических и химических сил, т. е. адсорбция, по существу, является физико-химическим процессом. И действительно, советские ученые Н. А. Шилов, М. М. Дубинин, Л. К. Лепинь установили, что при различных случаях адсорбции играют роль физические и химические взаимодействия между адсорбентом и адсорбируемым веществом. Это особенно четко проявляется при адсорбции газов. Исследования показали, что при поглощении первых порций газа на чистой поверхности адсорбента чаще проявляется действие химических сил, а при последующей адсорбции газа, при повышении давления процесс переходит постепенно в чисто физический.
Дата добавления: 2016-02-20; просмотров: 2091;
