Ацетооцтова кислота та ацетооцтовий естер
Особливої уваги заслуговує 3-оксобутанова або ацетооцтова кислота, у зв'язку з широким застосуванням її естерів в органічному синтезі. Її отримують із кетену за реакцією:
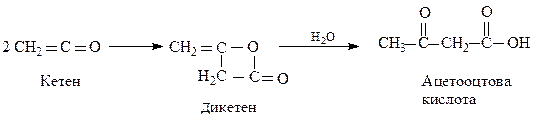
Ацетооцтова кислота легко декарбоксилюється; тому в синтезах використовують не саму кислоту, а її етиловий естер – ацетооцтовий естер. Ацетооцтовий етер (АОЕ) також отримують з дикетену
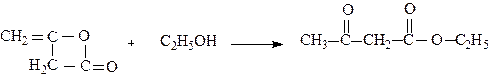
Ацетооцтовий естер
Іншою реакцією одержання АОЕ може служити конденсація Кляйзена етилацетату. Ця реакція протікає за аналогією з альдольною конденсацією (див.стор.) у присутності алкоголятів лужних металів:
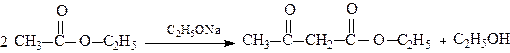
Механізм конденсації Кляйзена. Під впливом оксогрупи в молекулі етилацетату атом водню біля α-вуглецевого атома набуває підвищеної рухливості і в присутності етилату натрію відщеплюється у вигляді протону з утворенням карбаніону.
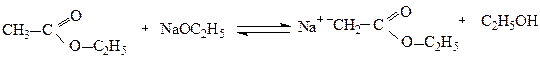
Карбаніон
Карбаніон є сильним нуклеофілом і реагує з іншою молекулою етилацетату за карбонільною групою з утворенням комплексу (І), який відщеплює молекулу етилату натрію і перетворюється на АОЕ.
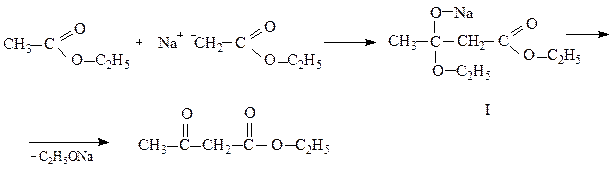 Ацетооцтовий естер завдяки особливостям своєї будови виявляє кетоенольну таутомерію (див.стор.).
Ацетооцтовий естер завдяки особливостям своєї будови виявляє кетоенольну таутомерію (див.стор.).
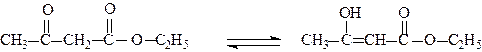
Кетонна форма Енольна форма
90% 10%
Як правило, енольна форма енергетично менше вигідна, але в даному випадку за рахунок виникнення спряженої системи кратних зв'язків і внутрішньомолекулярного водневого зв'язку вона дещо стабілізується.
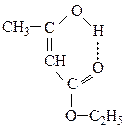
Кетоенольна таутомерія називається також прототропною ізомерією, тому що супроводжується перенесенням протона. Завдяки таутомерним перетворенням АОЕ здатний вступати в реакції, як в кетонній, так і в енольній формах.
Реакції кетонної форми:
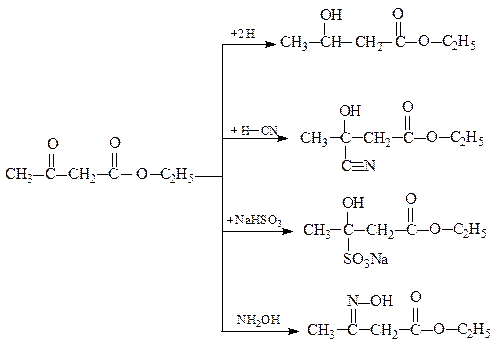
Реакції енольної форми
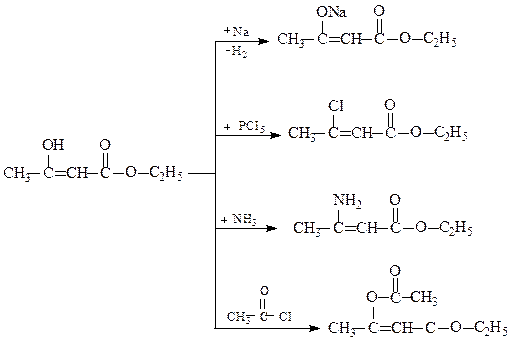
Важливою властивістю АОЕ є його здатність розкладатися при нагріванні з водними розчинами лугів. Причому, напрям розкладання залежить від концентрації лугу. Концентрованийлуг виступає як сильний нуклеофіл і атакує карбонільний атом вуглецю в молекулі АОЕ. Утворений у результаті приєднання аніон розщеплюється на ацетат-аніон і етилацетат.
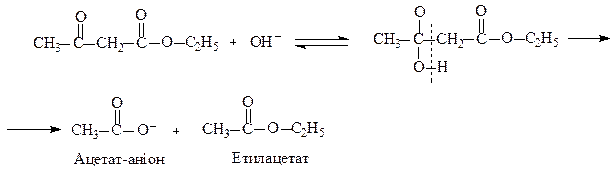 Останній в лужному середовищі гідролізується до ацетату натрію і етанолу:
Останній в лужному середовищі гідролізується до ацетату натрію і етанолу:
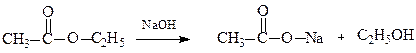
Це т.з. кислотне розчеплення АОЕ, продуктом якого є натрійацетат і спирт.
У присутності розведеного лугу спочатку відбувається гідроліз АОЕ і утворена сіль ацетооцтової кислоти декарбоксилює з утворенням ацетону:
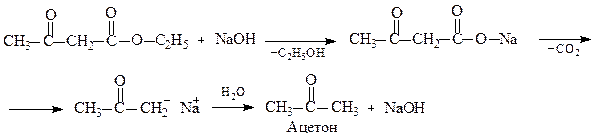
Це кетонне розщеплення АОЕ.
Отже схема лужного розщеплення АОЕ виглядає так:

Ще однією особливістю АОЕ є те, що атоми водню метиленової групи протонізовані за рахунок прояву -І-еф. двох сусідніх карбонільних груп і при дії на АОЕ алкоголятів лужних металів (наприклад етилату натрію) можуть обмінюватися на натрій з утворенням натрійацетооцтового естеру
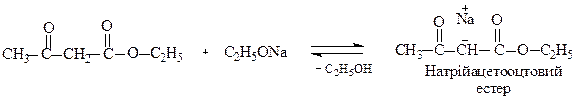
Негативний заряд аніону натрійацетооцтового естеру за рахунок спряження делокалізується між атомом вуглецю і двома атомами кисню, що можна подати граничними структурами:
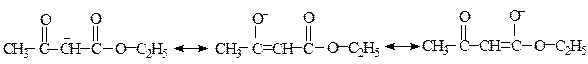 Тому натрійацетооцтовий естер інколи записують так:
Тому натрійацетооцтовий естер інколи записують так:
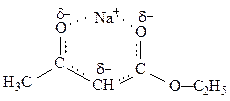
Надалі для спрощення зупинимося на формі:
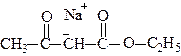
Аніон АОЕ містить спряжену систему з вирівняними зв'язками і делокалізованим негативним зарядом. Отже, у реакціях він реагує як за киснем з утворенням О-похідних, так і за вуглецевим атомом з утворенням С-похідних. Тому для нього характерна подвійна реакційна здатність. Так, наприклад, алкілювання і ацилювання протікає, головним чином, у вуглецевого атома. Утворення О- або С-похідних можна показати на прикладі реакції алкілювання.
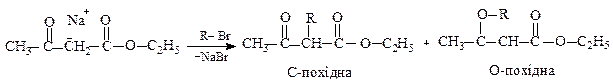 Але слід зауважити, що алкілування і ацилювання протікає, головним чином, у вуглецевого атома. Здатність натрійацетооцтового естеру утворювати С-похідні, а також розщеплюватися під дією лугів використовують для синтезу на його основі карбонових кислот та метилкетонів.
Але слід зауважити, що алкілування і ацилювання протікає, головним чином, у вуглецевого атома. Здатність натрійацетооцтового естеру утворювати С-похідні, а також розщеплюватися під дією лугів використовують для синтезу на його основі карбонових кислот та метилкетонів.
1. Синтези на основі натрійацетооцтового естеру
1.1.Синтез монокарбонових кислот і метилкетонів
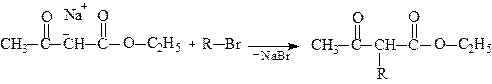
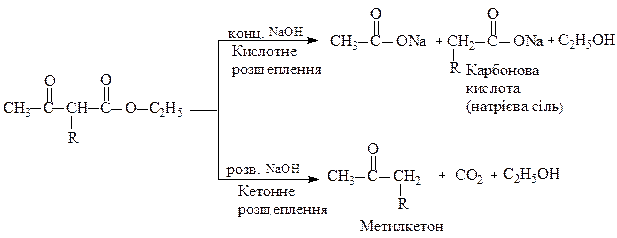 1.2. Одержання дикарбонових кислот і дикетонів
1.2. Одержання дикарбонових кислот і дикетонів
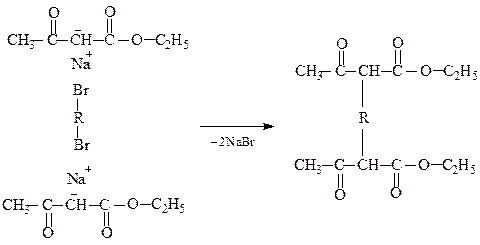
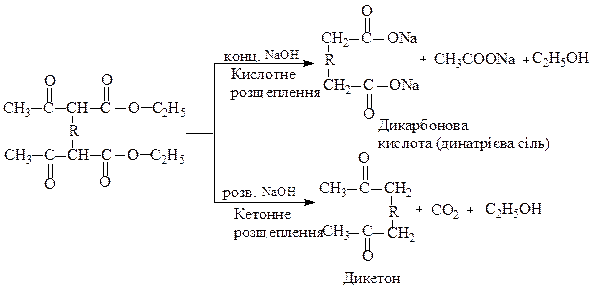
Можливі й інші варіанти синтезів на основі ацетооцтового естеру.
Дата добавления: 2016-02-11; просмотров: 8375;
