СТЕРЕОIЗОМЕРIЯ ГIДРОКСИКИСЛОТ
Більшість гiдроксикислот здатнi обертати площину поляризації плоскополяризованого свiтла влiво або вправо, тобто проявляти оптичну активнiсть (див.стор ).
Так, молочна кислота може бути правообертаюча (+) та лівообертаюча (-). Правообертаюча була виділена Ю.Лібіхом у 1847 р. із м’яса і відноситься до L–ряду. Лівообертаюча D–молочна кислота утворюється при скисанні молока. D– та L–Молочні кислоти є енантіомарами (див.стор. ).
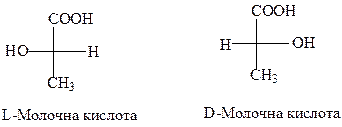
Суміш, яка складається з еквiмолярних кiлькостей двох енантіомерів, називається рацемічною сумішшю або рацематом і позначається (r). Рацемат оптично неактивний, тому що його енантiомери взаємно компенсують обертання поляризованого свiтла.
Як зазначалося раніше, D- i L-позначення збереженi тiльки для гiдроксикислот, амiнокислот i вуглеводiв. Якщо в молекулi сполуки мiститься декiлька асиметричних атомiв вуглецю, то для гiдрокси- та амiнокислот їх вiдносять до D- або L- ряду за верхнiм асиметричним (хiральним) атомом вуглецю, а для вуглеводiв - за нижнiм.
Мiж числом асиметричних атомiв вуглецю (n) у молекулi i числом оптичних ізомерів (N) iснує залежнiсть N=2n. Так, у винних кислот повинно бути N=22=4 оптичних ізомери, які можна подати чотирма проекційними формулами Фішера:
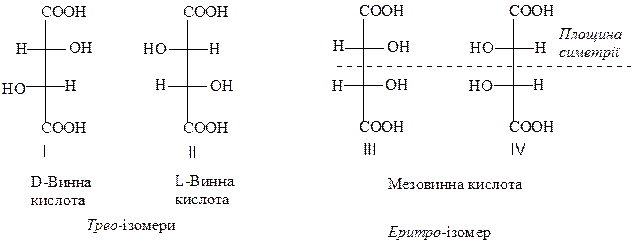
D- та L-винні кислоти є енантіомерами. D-Винна кислота – правообертаюча і утворюється при бродінні виноградного сусла. Лівообертаюча L-винна кислота також зустрічається у природі, її можна одержати окисненням малеїнової або сорбінової кислот. Еквівалентна суміш D- та L-винних кислот (рацемічна суміш) називається виноградною кислотою.
Виноградна кислота, як і будь-яка рацемічна суміш, оптично недіяльна тому, що обидва енантіомери взаємокомпенсують обертання плоскополяризованого променя світла. Виноградна кислота може бути роздiлена на енантiомери за допомогою спеціальних методів.
Проекційні формули ІІІ і IV мезовинної кислоти, насправді, ідентичні. В цьому легко переконатися, якщо повернути проекцію IV в площині малюнка на кут 180о. Після повороту вона співпаде з проекцією ІІІ. Отже слід говорити не про дві речовини, а про одну, яку називають мезовинною кислотою.
Молекула мезовинної кислоти симетрична відносно площини, яка проходить через її середину (на проекціях показана пунктиром), а значить мезовинна кислота не проявляє оптичної активності.
Сполуки, у яких є асиметричний атом вуглецю, але вони оптично недiяльнi внаслiдок симетрiї молекули, називаються мезоформами.
По відношенню до D- та L-винних кислот, мезовинна кислота є не енантіомером, а діастереоізомером.
Якщо однакові замісники біля двох хіральних атомів вуглецю розташовані по різні боки від головного ланцюга, то такий ізомер називається трео-ізомером, а якщо по один бік – еритро-ізомером. Отже D- та L-винні кислоти - трео-ізомери, а мезовинна – еритро-ізомер.
СТЕРЕОХIМIЯ реакцій ПРИЄДНАННЯ
Стеричний або просторовий хiд більшості реакцій приєднання до подвiйного C=C-зв'язку має яскраво виражений стереоселективний характер, у процесіі якого утворюються трео- або еритро-iзомери. Утворення таких форм залежить вiд будови вихідної сполуки та механiзму реакцiї приєднання. Так, при цис-приєднаннi до цис-ізомеру або транс-приєднаннi до транс-ізомеру, утворюються еритро-iзомери.
Наприклад, бромування ненасичених двоосновних кислот iлюструється такими схемами:
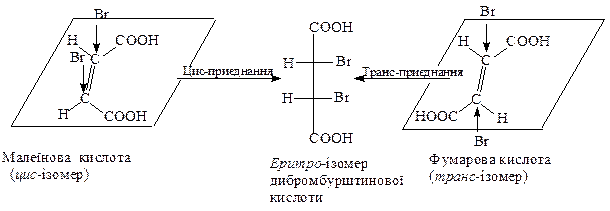
При цис-приєднаннi до транс-ізомеру i транс-приєднаннi до цис-ізомеру утворюються трео-iзомери.
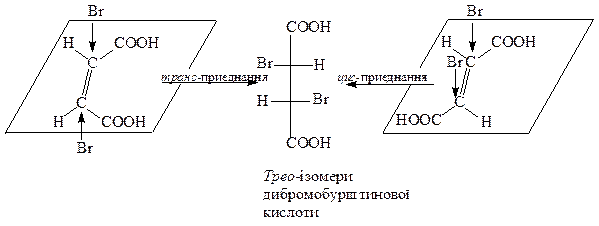
Електрофільне приєднання до кратних С=С-зв’язків найчастіше протікає, як транс-приєднання (бромування, гiдробромування, гiдрохлорування, кислотна гiдратацiя тощо).
Стереохімія Реакцiй замiщення при асиметричному атомi вуглецю
 Реакцiї замiщення при асиметричному атомi вуглецю можуть протiкати з частковою або повною змiною конфiгурацiї молекул. За iм’ям вченого, який вiдкрив таку змiну конфiгурацiї (П.I.Вальден, 1895), вона називається Вальденiвським обертанням i на схемi реакцiї позначається у виглядi петлi
Реакцiї замiщення при асиметричному атомi вуглецю можуть протiкати з частковою або повною змiною конфiгурацiї молекул. За iм’ям вченого, який вiдкрив таку змiну конфiгурацiї (П.I.Вальден, 1895), вона називається Вальденiвським обертанням i на схемi реакцiї позначається у виглядi петлi
Детально вивченi реакцiї SN, (див.стор. ), для яких К.Iнгольд сформулював такi правила:
1. Замiщення за механiзмом SN2 завжди супроводжується повною змiною конфiгурацї (див.стор.).
2. Замiщення за механiзмом SN1 супроводжується частковою зміною конфiгурацiї з утворенням рацемiчної сумiшi (рацемiзацiєю) (див.стор. ).
В окремих випадках реакція заміщення може протікати без зміни конфігурації. Так, при нагріванні галогенопохідних з вологим твердим аргентум оксидом відбувається заміна галогену гідроксильною групою

Дана реакція протікає за специфічним механізмом, який забезпечує збереження конфігурації вихідного галогенопохідного.
Вищенаведені факти можна проілюструвати схемою взаємного перетворення хлоробурштинової та гідроксибурштинової кислот:
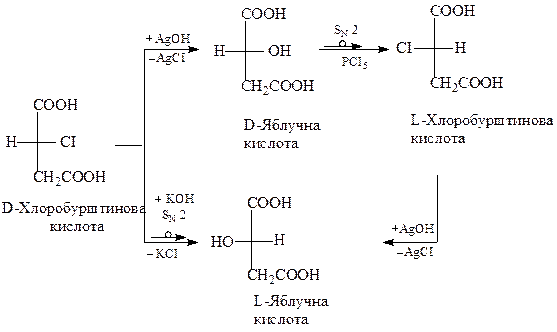
Ці стеричні закономірності протікання реакцій слід враховувати при синтезі сполук з певною просторовою конфігурацією.
Карбонатна кислота та її похідні
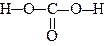 На відміну від інших гідроксикислот, гідроксигрупа яких віддалена від карбоксильної і носить спиртовий характер, у карбонатної кислоти обидві гідроксильні групи зв’язані безпосередньо з карбонілом і не відрізняються між собою. Тому карбонатна кислота, хоч формально і відноситься до гідроксикислот, однак вона більше нагадує двоосновну кислоту.
На відміну від інших гідроксикислот, гідроксигрупа яких віддалена від карбоксильної і носить спиртовий характер, у карбонатної кислоти обидві гідроксильні групи зв’язані безпосередньо з карбонілом і не відрізняються між собою. Тому карбонатна кислота, хоч формально і відноситься до гідроксикислот, однак вона більше нагадує двоосновну кислоту.
Сама карбонатна кислота та її солі розглядаються у предметі «Неорганічна хімія». Однак, такі похідні, як галогеноангідриди, естери, аміди тощо – є органічними сполуками.
Карбонатна кислота утворюється при розчиненні вуглекислого газу у воді.
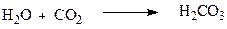
Похідні карбонатної кислоти
1. Хлороангідриди
Монохлороангідрид карбонатної кислоти – нестійка сполука, що розкладається під час утворення.
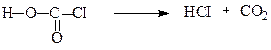
Дихлороангідрид (фосген) одержують за реакцією:
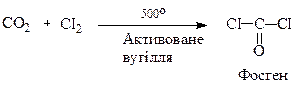
Фосген – отруйний газ (темп.кип. 8,3оС) зі специфічним запахом прілого сіна. Водою повністю гідролізується:
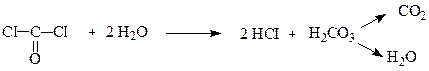
При взаємодії зі спиртами він утворює естери хлорокарбонатної та карбонатної кислот:
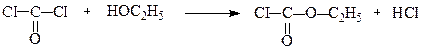
Етилхлорокарбонат
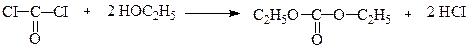
Диетилкарбонат
З гліколями утворює циклічні естери:

Етиленгліколькарбонат
2. Аміди
Неповний амід карбонатної кислоти – карбамінова кислота нестійка і у вільному стані не існує.
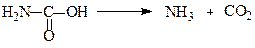
Карбамінова кислота
Її естери називаються уретанами. Вони утворюються при взаємодії естерів хлорокарбонатної кислоти з аміаком.
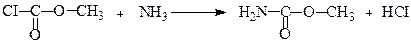
Метилуретан
Деякі уретани застосовуються в медицині, як ефективні транквілізатори:
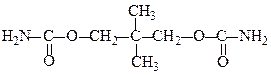
«Мепробамат»
В останні роки особливого значення набули поліуретани, які широко використовують для виробництва різноманітних пластмас. З поліуретану виготовляють конструкційні матеріали, синтетичну шкіру, герметики, клеї тощо. Вспінений поліуретан відомий під назвою «поролон». Одержують поліуретани взаємодією діізоціанатів з гліколями:
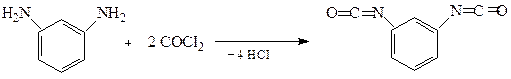
м-Фенілендіамін Фосген м-Фенілендіізоціанат
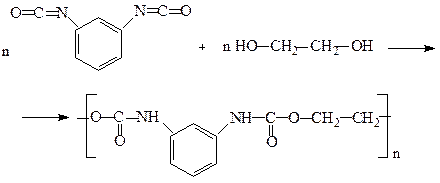
Поліуретан
Повний амід карбонатної кислотиназивається карбамідом або сечовиною .
У промисловості карбамід одержують за схемою:
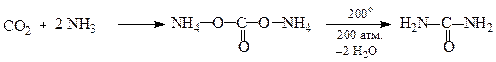
Амоній карбонат Карбамід
Раніше карбамід одержували ціанамідним методом:
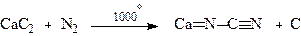
Кальцій Кальцій ціанамід
карбід
Ціанамід легко гідролізується з утворенням карбаміду:
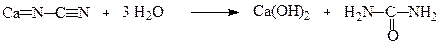
Карбамід також можна одержати з фосгену, йому притаманні всі властивості амідів.
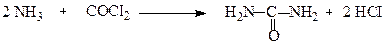
У лужному або кислому середовищі карбамід гідролізується:
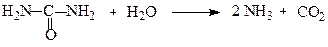
Карбамід алкілується за атомами азоту, але важче, ніж аліфатичні аміни:
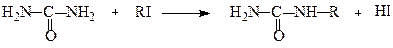
Алкілкарбамід
Ацильні похідні карбаміду називають уреїдами.
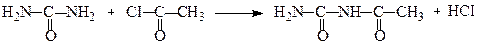
Ацетилкарбамід
(уреїд)
Уреїд α-бромізовалеріанової кислоти використовують як снодійний препарат – «бромурал».
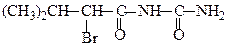
Двоосновні кислоти утворюють циклічні уреїди:
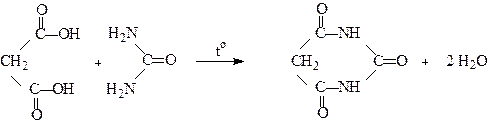
Малонова Барбітурова кислота
кислота
Похідні барбітурової кислоти також використовують, як ефективні снодійні препарати:

Діетилбарбітурова кислота Етилфенілбарбітурова кислота
«Веронал» «Фенобарбітал» або «Люмінал»
Карбамід використовується для одержання карбамідо-формальдегідних смол:
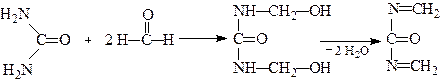
N,N-Дигідроксиметилкарбамід
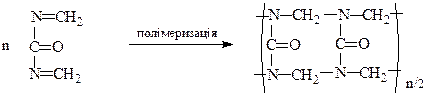
Карбамідоформальдегідний
полімер
Крім лінійних макромолекул, утворюються просторовозшиті полімери. З карбамідоформальдегідної смоли виготовляють посуд, товари широкого вжитку, оздоблювальні матеріали.
Велику кількість карбаміду використовують як цінне азотне добриво, що чудово засвоюється рослинами.
ОКСоКИСЛОТИ
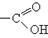
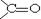 Оксокислотами називають гетерофункціональні сполуки, що містять у молекулі одночасно карбоксильну і карбонільну групи. Інша назва карбонільної групи – оксогрупа, звідки стає зрозумілою назва цього класу сполук – оксокислоти.
Оксокислотами називають гетерофункціональні сполуки, що містять у молекулі одночасно карбоксильну і карбонільну групи. Інша назва карбонільної групи – оксогрупа, звідки стає зрозумілою назва цього класу сполук – оксокислоти.
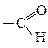 Оксогрупа може бути кетонною, якщо вона сполучена з двома радикалами, або входити до складу альдегідної групи . Тому оксокислоти поділяють на кетокислоти та альдегідокислоти.
Оксогрупа може бути кетонною, якщо вона сполучена з двома радикалами, або входити до складу альдегідної групи . Тому оксокислоти поділяють на кетокислоти та альдегідокислоти.
За взаємним розташуванням карбоксильної та карбонільної груп вони поділяються на α, β, γ і так далі, за аналогією до гідроксикислот.
НОМЕНКЛАТУРА
За замісниковою номенклатурою IUPAC назви оксокислот утворюються з назв відповідних карбонових кислот додаванням префікса оксо- (табл.1). За радикало-функціональною номенклатурою до назви карбонової кислоти додається назва ацила, що містить оксогрупу. Збережені також деякі тривіальні назви.
Таблиця 1
Назви деяких оксокислот
| Формула | Назва за номенклатурою IUPAC | |
| Замісниковою | Радикало-функціональною (тривіальна назва) | |
Альдегідокислоти
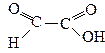
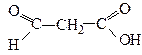 Кетокислоти
Кетокислоти
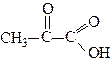
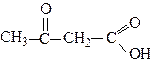
| Оксоетанова 3-Оксопропанова 2-Оксопропанова 3-Оксобутанова | Формілформіатна (гліоксилова) Формілацетатна Ацетилформіатна (Піровиноградна) Ацетилацетатна (Ацетооцтова) |
СПОСОБИ ОДЕРЖАННЯ
1. Гідроліз гемінальних дигалогензаміщених карбонових кислот
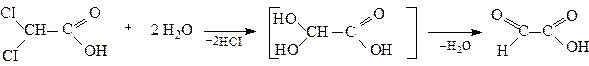 Дихлороцтова Гліоксилова
Дихлороцтова Гліоксилова
2. Окиснення спиртів, гліколів, гідроксикислот
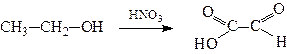
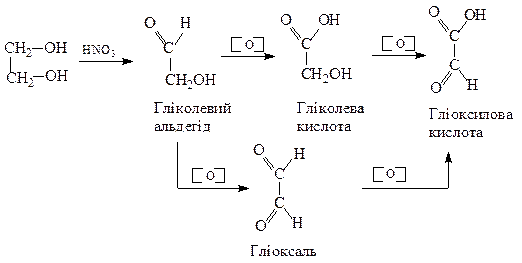
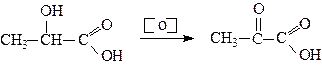
Молочна кислота Піровиноградна кислота
3. Взаємодія ацилгалогенідів з ціанідами з наступним гідролізом оксонітрилів
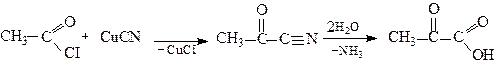
Ацетилхлорид Оксонітрил 2-Оксопропанова
кислота
ХІМІЧНІ ВЛАСТИВОСТІ
Оксокислоти сильніші кислоти, ніж відповідні їм незаміщені і, навіть, гідроксикислоти. Так, константа дисоціації піровиноградної кислоти 320 · 10-5 ; молочної 13,7·10-5 а пропіонової 1,35·10-5 .
Для них характерні властивості, як карбонільних сполук, так і карбонових кислот. Причому, взаємний вплив цих груп за рахунок як індукційного, так і мезомерного ефектів збільшує їх реакційну здатність.
1. Реакції за участю карбонільної групи:
1.1. Реакція Канніццаро (в цю реакцію вступають тільки альдегідокислоти).
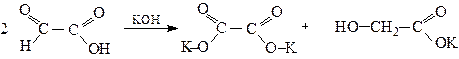
Калій оксалат Калієва сіль гліколевої кислоти
1.2. Відновлення карбонільної групи
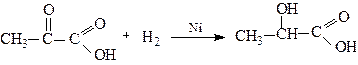
1.3. Окиснення за альдегідною групою

1.4. Реакції нуклеофільного приєднання:
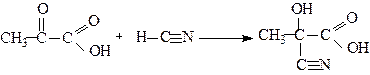
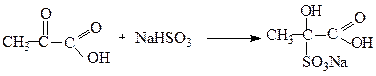
2. Реакції за участю карбоксильної групи: оксокислоти утворюють солі, аміди, естери (див.стор. ). α- і β-Оксокислоти при нагріванні, особливо в присутності сильних кислот, легко декарбоксилюють.
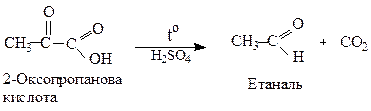
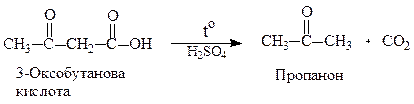
Дата добавления: 2016-02-11; просмотров: 2708;
