Реакції приєднання галогенів або галогеноводнів до алкінів (А).
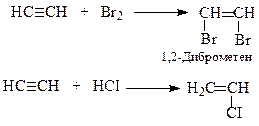
Вінілхлорид
ХІМІЧНІ ВЛАСТИВОСТІ
Взаємне розміщення атома галогену і подвійного зв’язку визначає рухливість галогену і, в цілому, реакційну здатність молекули. Ненасичені галогенопохідні за реакційною здатністю умовно можна розділити на 3 групи.
Атом галогену знаходиться безпосередньо при подвійному зв’язку.
Для таких галогенопохідних характерна мала реакційна здатність як атома галогену, так і подвійного зв'язку. Це пояснюється тим, що p-орбіталі неподілених електронних пар атома галогену вступають у спряження з π-зв’язком, проявляючи при цьому (+М)-ефект. Одночасно діє сильний -І-ефект галогену, напрямлений у протилежний бік.
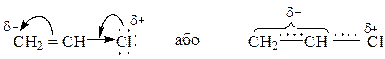
В результаті зв’язок ССІ набуває рис подвійного зв’язку, його довжина зменшується з 0,178 до 0,172 нм, а енергія підвищується. Крім того, знижується і полярність зв’язку ССІ і, як наслідок, реакційна здатність як галогену, так і подвійного зв’язку. Електрофільне приєднання до подвійного зв’язку хоча і підпорядковується правилу Марковнікова, але протікає важче.
СН2=СН-СІ + НСІ  СН3-СНСІ2
СН3-СНСІ2
1,1-Дихлоретан
Дата добавления: 2016-02-11; просмотров: 1320;
