Сравнительный качественный анализ аминокислот
И белков
Известно, что все 20 разновидностей канонических α-аминокислот имеют однотипную структуру, с тремя вариантами функциональных групп (рис. 3.3). К сожалению, реакции на амино- и карбоксигруппы малоспецифичны, т.к. соответственно, свойственны всем аминам, ряду амидов и карбоновых кислот. То же относится и к большинству их радикалов = R, 10 из которых неполярны, то есть представлены алифатическими = углеводородными группами, большинство которых химически инертно. Относительно низка и специфичность большинства R полярных аминокислот, в которых встречаются спиртовые (Сер, Тре, Тир) амидные (Асн, Глн) и карбоксигруппы (Асп, Глу). Более активны аминогруппа (Лиз), имидазол Гис и гуанидиногруппа Арг, а максимальна активность тиогруппы Цис. Поэтому наибольшее практическое значение в качественном и количественном анализе α-аминокислот, в том числе и в аминокислотных анализаторах, получила универсальная нингидриновая реакция, специфичная для одновременного присутствия у α-С атома, как амино-, так и карбоксигруппы.
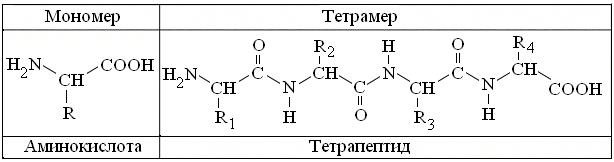
Рис. 3.3. Общие формулы структуры α-аминокислот и продукта их полимеризации. Пояснения в тексте.
Полимеризация α-аминокислот в структуру пептидов и белков (рис. 3.3) сохраняет все типы их R, но:
1. Нингидриновая реакция становится отрицательной, т.к. за исключением N- и C-концевых, α-амино- и α-карбоксигруппы расходуются на образование пептидных связей. Положительная нингидриновая реакция с белком, скорей свидетельствует о присутствии примесей аминокислот в препарате или посуде.
2. Для всех пептидов и белков специфична биуретовая реакция на пептидную группу, отсутствующую в мономерных аминокислотах.
3. Из более специфических реакций на R аминокислот, бывают полезны: ксантопротеиновая реакция с концентрированной азотной кислотой, на ароматические R Фен, Тир, Три; реакция с изатином на пятичленный цикл Про, а также реакции на имидазольный R Гис, тиогруппу Цис и гуанидиногруппу Арг. Важно учитывать, что часть этих R скрыта внутри белковых глобул и потому, качественные реакции на них ослаблены. Поэтому, перед их проведением, белки обычно денатурируют тем или иным способом.
4. В отличие от истинных растворов аминокислот, коллоидным растворам белков свойственны осадочные реакции, связанные с разрушением их гидратных оболочек и, вследствие этого, снижением их растворимости под действием водоотнимающих средств: нейтральных солей = высаливание, метанола = МеОН, этанола = EtОН, ацетона, мочевины и др. агентов.
Выполняя качественные реакции, следует:
1. Тщательно соблюдать правила пожарной безопасности и работ с концентрированными кислотами и щелочами = ЕЖ.
2. Промаркировать стеклографом или фломастером 2 ряда пробирок и поместить в один из них не более 0,5 мл (2-5 капель) 1 % раствора аминокислоты, а в другой – примерно тот же объем 1 % раствора белка.
3. В пару пробирок с растворами аминокислоты и белка, параллельно добавить по 3-5 капель соответствующих реактивов и, провести остальные процедуры, указанные для соответствующей реакции.
4. При необходимости нагрева пробирок – снять крышку тигля и поджечь спичкой сухое горючее. Затем, зажать пробирку в держатель, примитивная конструкция которого, очень ненадежна. Поэтому лучше обернуть пару пробирок сложенным в полоску листком бумаги и, придерживая их большим пальцем, равномерно пропускать нижние половины пробирок через пламя, избегая направления горлышек на соседей и бурного вскипания раствора. Выполнив операцию, своевременно погасить пламя крышкой тигля.
5. Результаты опытов, в соответствии с шаблоном, оформлять на развороте лабораторной тетради в виде таблицы:
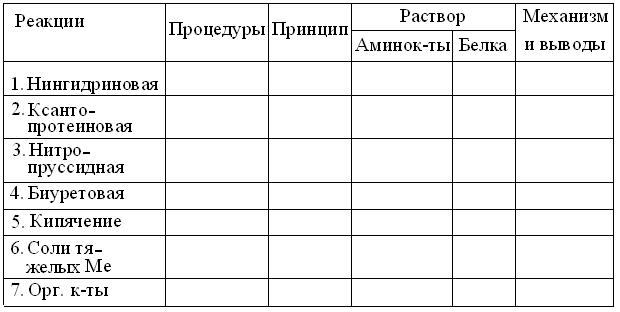
6. Обдумав полученные результаты и, завершив оформление протокола, вместе со штативом пробирок, предъявить их преподавателю для защиты.
1. Нингидриновая реакция.Основана на дезаминировании и декарбоксилировании α-аминокислот спиртовым раствором нинги-дрина:
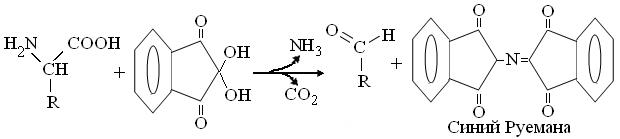
Возникший аммиак, реагируя с двумя молекулами нингидрина, образует окрашенное производное, с максимумом поглощения при 540 нм (для Про – 440 нм).
Ход работы: К исследуемым образцам добавить по 3-5 капель 0,5 % спиртового раствора нингидрина. Пробирки со смесями аккуратно прогреть на пламени и через 2-3 мин зарегистрировать появление окраски.
2. Ксантопротеиновая реакция. Как уже сказано выше, основана на образовании нитропроизводных аминокислот с ароматическим R: Фен, Тир, Три.
Ход работы: Включив тягу вытяжного шкафа, в пару пробирок с исследуемыми растворами осторожно добавить по нескольку капель концентрированной азотной кислоты (HNO3). Пробирки аккуратно прогреть на пламени, избегая направления горлышек на соседей, и зарегистрировать развитие окраски.
3. Нитропруссидная реакция.Основана на щелочном гидролизе серусодержащей аминокислоты цистеина, с выделением сульфида натрия (Na2S), дающего со свежеприготовленным раствором нитропруссида натрия, комплекс красного цвета.
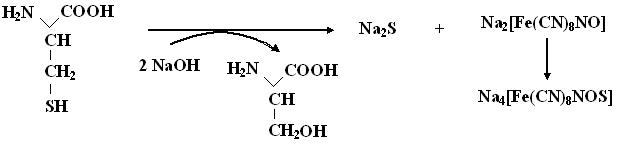
Ход работы: В обе пробирки с 5-10 каплям исследуемых растворов добавить равный объём 20 % едкого натра и прокипятить не менее 3-5 мин. Добавить в пробирки по 3-5 капель раствора нитропруссида натрия и зафиксировать развитие окраски.
4. Биуретовая реакция. Основана на образовании в щелочной среде цветного комплекса пептидной связи с ионом Cu2+. Служит универсальным тестом для выявления пептидов и белков в растворах. Так как с ростом количества пептидных связей, интенсивность окраски раствора линейно нарастает, широко применяется для фотометрического определения концентраций белка.
Ход работы. В пробирки с 5-10 каплями исследуемых растворов добавить столько же 10 % раствора едкого натра. Хорошо перемешать и добавить по 2 капли 1 % раствора сульфата меди (CuSO4). Пробы перемешать и через несколько минут зарегистрировать развитие окраски.
5. Проба с кипячением.Основана на тепловой денатурации белков.
Ход работы. Обе пробирки с исследуемыми растворами подкислить, не более, чем одной каплей 1 % раствора уксусной кислоты (AcOH) и нагреть до кипения. Прокипятив растворы 2-3 мин, зарегистрировать результаты и объяснить механизм явления.
6. Осаждение солями тяжелых металлов(Ме).Их денатурирующие свойства основаны на способности катионов тяжелых Ме реагировать с функциональными группами R молекулы белка: тио-, амино-, карбокси-, ароматическими. Также, их сильные анионы вызывают перезарядку ионогенных групп в молекулах белков, разрушая в них тем самым, ионные связи.
Ход работы. В обе пробирки с исследуемыми растворами добавить по нескольку капель 5 % раствора сульфата меди (CuSO4). Зарегистрировать и объяснить полученные результаты.
7. Осаждение органическими кислотами.Основано на кислотной денатурации белков и образовании ковалентных производных тио-, амино- и ароматических групп R аминокислот с хлорорганикой.
Ход работы. В пробирки с исследуемыми растворами добавить по нескольку капель 10 % раствора трихлоруксусной кислоты (ТХУ) и, через несколько минут зарегистрировать результаты
Дата добавления: 2016-02-16; просмотров: 2009;
