БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 28 страница
7 Г-'горова
Изолированные протопласты можно культивировать. Обычно для этого используют те же среды, на которых растут изолированные клетки и ткани. Сразу же после удаления ферментов у протопластов в культуре начинается образование клеточной стенки. Протопласт, регенерировавший стенку, ведет себя как изолированная клетка, способен делиться и формировать клон клеток. Регенерация целых растений из изолированных протопластов сопряжена с рядом трудностей. Получить регенерацию через эмбриогенез удалось пока только у растений моркови. Стимуляцией последовательного образования корней и побегов (органогенез) добились регенерации растений табака, петунии и некоторых других растений. Следует отметить, что протопласты, изолированные из генетически стабильной клеточной культуры, чаще регенерируют растения и с большим успехом используются при исследованиях генетической модификации протопластов.
6.8. ИСПОЛЬЗОВАНИЕ МЕТОДА КУЛЬТУРЫ
ИЗОЛИРОВАННЫХ КЛЕТОК И ТКАНЕЙ В СОЗДАНИИ СОВРЕМЕННЫХ ТЕХНОЛОГИЙ
Помимо фундаментальных исследований метод культуры изолированных тканей широко используется в сельском хозяйстве и промышленном производстве (рис. 6.5). Примером может служить массовое клональное микроразмножение плодовоовощных и декоративных растений, а также их оздоровление от вирусных и других инфекций. С помощью культуры in vitro можно расширить возможности селекционной работы: получать клоны клеток, а затем и растения с запрограммированными свойствами. Благодаря способности клеток синтезировать в культуре вторичные метаболиты возникла отрасль промышленности, осуществляющая биологический синтез веществ, необходимых человеку.
6.8.1. Синтез вторичных метаболитов
В настоящее время известно примерно 2-104 синтезируемых растениями веществ, которые используются человеком, и их количество постоянно увеличивается. Растения всегда служили источником пищи, эфирных масел, красителей и, конечно же, лекарственных соединений. Так, мак снотворный (Papaver somniferum)j является источником болеутоляющего вещества — кодеина; из на^ перстянки (Digitalis lanata) получают дигоксин, тонизирующий сер| дечную деятельность; из хинного дерева (Cinchona ledgeriana) -4 антималярийное средство «хинидин». Особое место занимают нар| котики и стимулирующие вещества. В небольших, строго контро! лируемых количествах их используют в медицине. Однако при сй|
Биотехнологическое применение
| Соматические эмбриоидьГ" |
| Клетки |
| 1 1 1 1г- | |
| II | |
| 1 1 | LlJi К |
| 11 | |
| И | |
| LU- |
| || L м н II__ |
. фундаментальные : исследования Вегетативное : размножение ■ Оздоровление
Искусственные семена
Вторичные продукты и биотрансформация
Гибридизация: половая,
соматическая
Гаплоидизация:
андро генная,
гиногенная
Селекция, мутации,
вариации
Замена органелл
| Меристемы, яйцеклетки, эмбрионы, микроспоры пыльники ===== н Каллус |

| Протопласты |
Молекулярно- генетическая инженерия растений
Рис. 6.5. Использование культуры клеток и тканей растений в биотехнологии (по Х.Борнман, 1991)
стематическом употреблении низких концентраций наркотиков возникают наркозависимость и стремление к увеличению употребляемой дозы. Применение высоких концентраций наркотика убивает человека. Наиболее известны опиум и героин из Papaver somniferum, кокаин из Erythroxylon, никотин из различных сортов табака. Наиболее известный стимулятор — кофеин, содержащийся в растениях чая и кофе. Стимуляторы не токсичны в концентрациях, рекомендуемых к применению. Однако высокие их концентрации негативно влияют на сердечно-сосудистую и нервную систему человека.
Большой интерес вызвало открытие пиретринов, выделенных из цветков Chrysanthemum cinerariaefolium. Эти вещества — мощные инсектициды. Особая их ценность заключается в том, что пиретрины не вызывают привыкания у насекомых, а также не проявляют кумулятивного токсического эффекта.
Способность интактных растений синтезировать различные соединения привела к предположению, что тем же свойством будут обладать клетки и ткани этих растений, выращиваемые в стерильных условиях. Для некоторых культур это оказалось справедливым. Но в отдельных случаях клетки либо не проявляли способности к синтезу необходимых веществ, либо синтезировали их в минимальных количествах. Понадобились долгие эксперименты по подбору питательных сред, условий культивирования, исследованию новых штаммов, полученных благодаря генетической гетероген
ности каллусных клеток или применению мутагенных фактороь чтобы добиться серьезных успехов в этой области.
В настоящее время промышленный синтез вторичных метабо литов — очень перспективное направление. Синтез вторичны: метаболитов происходит главным образом в суспензионной культуре клеток, в регулируемых условиях, поэтому он не зависит о~ климатических факторов, от повреждения насекомыми. Культурь выращивают на малых площадях в отличие от больших массивог плантаций с необходимыми растениями. Культуры клеток растений могут синтезировать практически все классы соединений вторичного обмена, причем довольно часто в количествах, в нескольк< раз превышающих их синтез в целых растениях. Например, выхол аймалицина и серпентина в культуре клеток Catharanthus roseur составляет 1,3 % сухой массы, а в целом растении — 0,26 %. В культура- клеток Dioscorea dettoidea диосгенин синтезируется в количеств^ 26 мг на 1 г сухой массы, а в клубнях растений его содержание составляет 20 мг на 1 г сухой массы. Кроме того, в культурах ют- ток может начаться синтез веществ, не характерных для исходного растения, либо расширяется набор синтезируемых соединений В ряде случаев в клеточной культуре образуются вещества, которые синтезировались интактным растением на ювенильной фаз:- развития, либо вещества, содержавшиеся в клетках филогенетически более ранних групп растений. Так, в культуре клеток Papave bracteatum содержится сангвирин, характерный для ювенильны:. растений, и отсутствует тебаин, синтезируемый взрослыми растениями. А в культуре клеток живокости (Delphinium) синтезируются Д7-стерины, присутствующие у архаичных групп растений.
Синтез вторичных соединений может коррелировать с процессом дифференцировки в культуре клеток. Например, в суспензионной культуре Papaver somniferum максимальный синтез алкалоидов начинается после того, как в ней дифференцируется достаточна большое количество специализированных клеток млечников, предназначенных для депонирования метаболитов. С другой стороны, культуры клеток табака и моркови синтезируют большое количество никотина и антоцианина соответственно, хотя их клетки слабо дифференцированы. Не существует также однозначного ответа на вопрос, как связан синтез вторичных метаболитов с ростовым» процессами. У большого числа культур вторичные метаболиты син; тезируются и накапливаются в значительных количествах либо в? время экспоненциальной фазы, когда ростовые процессы особен* но активны, либо в период стационарной фазы роста культура клеток, когда прирост клеточной массы прекращается. Однако ecti культуры, например культура клеток Catharanthus roseus, у которь: синтез вторичных метаболитов сопровождает весь период роста. |
Важная особенность культивируемой популяции клеток — е стабильность в отношении синтеза и накопления продуктов вто| ричного синтеза. Так, в отделе биологии клетки и биотехнологии ИФР РАН под руководством Р. Г. Бутенко были получены разные штаммы клеток Dioscorea deltoidea, в том числе штамм-сверхпродуцент ИФР ДМ-0,5. Все эти штаммы сохраняли стабильность в отношении синтеза фуростаноловых гликозидов около 26 лет. Интересная особенность большинства клеток в культуре состоит в том, что обычно эти клетки не транспортируют синтезируемые метаболиты в питательную среду или другие клетки, хотя некоторые культуры составляют исключение, в частности культура клеток мака, которые депонируют алкалоиды в млечники. Синтез вторичных метаболитов в культивируемых клетках связан с внутриклеточными органеллами, в основном с пластидами и эндоплаз- матическим ретикулумом. В клетках, не способных к транспорту метаболитов, продукты вторичного синтеза обычно накапливаются в вакуолях и свободном пространстве (СП) клеток (табл. 6.3).
На синтез вторичных метаболитов влияет целый ряд факторов. Прежде всего выход продукта зависит от генотипа растения-до- нора. Показано, что культуры клеток, полученных от высокопродуктивных растений, продуцировали большее число метаболитов. Другой важный фактор — состав питательной среды и концентрация ее компонентов, которые должны обеспечивать, с одной стороны, увеличение количества клеток-продуцентов, с другой —
Таблица 6.3
Внутриклеточная локализация синтеза и накопления вторичных метаболитов (по Р.Г.Бутенко, 1999)
|
усиливать сам процесс синтеза. На рост, т.е. на увеличение биомассы, существенно влияет природа и количество углеводов, соединений азота и фосфора, на синтез метаболитов — природа и концентрация фитогормонов. Так, при замене одного ауксина на другой, например нафтилуксусной кислоты на 2,4-D, трехкратно увеличился синтез антрахинона суспензионной культурой Morinda citrifolia.
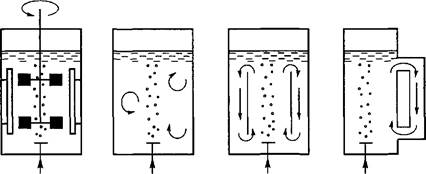
Очень большое влияние на рост суспензионной среды оказывает ее непрерывное перемешивание, которое обеспечивает хорошую аэрацию и предотвращает осаждение клеток. В лабораторных условиях перемешивание достигается благодаря использованию качалок или роллерных установок. При промышленном выращивании суспензионных культур применяют специальные системы, в которых идут увеличение биомассы и синтез вторичных соединений, — биореакторы. Эти системы обладают важными преимуществами: возможностью управлять процессом культивирования на основе показаний датчиков; кроме того, большой объем культивируемого материала позволяет забирать значительные пробы, при этом стрессовые реакции у культуры клеток не возникают. В зависимости от способа перемешивания культуральной жидкости биореакторы делят на две группы.
Первая группа включает биореакторы, в которых суспензионная культура перемешивается только за счет подачи воздуха; во второй группе биореакторов культура перемешивается механическим способом (рис. 6.6).
Выращивание культур растительных клеток в биореакторах проводят в двух режимах. Первый режим — периодическое культивиро-
 Воздух Воздух Воздух Воздух
1 2 3 4 \
}
Рис. 6.6. Схема работы основных типов биореакторов: f
Воздух Воздух Воздух Воздух
1 2 3 4 \
}
Рис. 6.6. Схема работы основных типов биореакторов: f
|
1 — биореактор с механическим перемешивающим устройством; 2 — барботаж-1 ный биореактор; 3 — аэролифтный биореактор; 4 — биореактор с вынесенной
циркуляционной петлей \
182 j вание — заключается в том, что по окончании процесса откачивают и используют всю суспензию клеток. При втором режиме — проточное культивирование — в биореактор постоянно добавляют свежую питательную среду и одновременно отбирают тот же объём либо суспензии (открытое проточное культивирование), либо одной отработанной питательной среды, оставляя клетки в реакторе (закрытое проточное культивирование).
Существуют две разновидности открытого культивирования. Первая — турбидостат — подразумевает измерение и автоматическое поддержание концентрации клеточной биомассы в реакторе на одном уровне путем изменения скорости протока. Вторая разновидность — хемостат — заключается в подаче в биореактор с постоянной скоростью питательного раствора при одновременном откачивании с той же скоростью клеточной суспензии.
Существует еще одна современная технология получения вторичных метаболитов с помощью иммобилизованных клеток культуры, т. е. помещение их в определенный носитель или адсорбция в нем. Носитель с клетками помещают в питательную среду. Клетки остаются живыми. Они прекращают рост, но продолжают синтез метаболитов, выделяя их в среду.
Довольно часто синтез вторичных метаболитов в суспензионной культуре останавливается на промежуточных этапах, не доходя до необходимого продукта. Получение продукта возможно благодаря процессу биотрансформации. Сущность его состоит в изменении промежуточных метаболитов с помощью культур других растений или клеток бактерий. Биотрансформация очень эффективна в бактериальных клетках, поэтому растительные клетки используют, когда процесс не осуществляется в клетках микроорганизмов. Вводимые в эти культуры вещества могут подвергаться гидроксилированию, эпоксидированию, глюкозилированию, этерификации, а также присоединяться к аминокислотам. Например, культура клеток женьшеня корневого происхождения способна трансформировать (гликозилировать) фенольные соединения — продукты деятельности суспензионной культуры клеток корня Panax ginseng. Культуры клеток лебеды и картофеля могут биотрансформировать индолил-3-уксусную кислоту в индолил-3- ацетил-Ь-аспарагиновую кислоту (Н. И. Рекославская и др., 1991).
Еще один пример — биотрансформация карденолидов, гликози- ды которых используют в медицине для лечения болезней сердца. Растения наперстянки (Digitalis lanata) в большом количестве синтезируют дигитоксин вместо необходимого дигоксина. Для соответствующей биотрансформации с успехом используют недифференцированную суспензионную культуру наперстянки. Иммобилизованные клетки этой культуры способны долгое время с постоянной скоростью трансформировать р-метилдигитоксин в р-метил- дигоксин (А. В.Альферманн и др., 1987).
Таким образом, использование суспензионных культур для синтеза вторичных метаболитов в промышленных масштабах имеет большие перспективы, и не только с точки зрения экономической выгоды получения более дешевой продукции в запланированных количествах. Важно, что использование культуры клеток спасет от уничтожения тысячи дикорастущих растений, ставших уже редкими, которые синтезируют необходимые человеку вещества. Увеличение выхода продукта может быть достигнуто благодаря дальнейшей исследовательской работе по селекции специализированных популяций клеток и оптимизации условий культивирования. Большой интерес представляет также дальнейшее развитие методов биотрансформации метаболитов и иммобилизации культивируемых клеток.
6.8.2. Биотехнологии в сельском хозяйстве
Ускорение и облегчение селекционного процесса, а также создание растений с новыми качествами — это направления, которые достаточно успешно развиваются с помощью технологий клеточной инженерии, культуры клеток и тканей.
Две группы методов, благодаря которым развиваются данные направления, представлены в табл. 6.4.
Некоторые из указанных технологий стали традиционными, другие находятся на начальных этапах разработки. Наконец, есть такие методы, которые явно вышли из ранга вспомогательных, ускоряющих селекцию технологий. К ним можно отнести крио- сохранение генофонда — технологию, в настоящий момент приобретшую экологическую направленность; или клональное микроразмножение растений, тесно связанное с проблемой их оздоровления от вирусных и других инфекций. Поэтому обзор этих технологий вынесен за рамки данного раздела.
Технологии, облегчающие селекционный процесс. Одна из наиболее важных технологий этой группы — оплодотворение in vitro, помогающее предотвратить прогамную несовместимость, которая может быть вызвана следующими причинами:
1) генетически детерминированное (определенное) несоответствие секрета рыльца материнского растения и пыльцы отцовского, которое тормозит рост пыльцевых трубок на рыльце пестика;
2) несоответствие длины столбика пестика и пыльцевой трубки, в результате чего пыльцевая трубка не достигает семяпочки (гетеростилия):
3) тканевая несовместимость партнеров, приводящая к остановке роста пыльцевой трубки в любой момент ее прорастания от рыльца пестика до микропиле семяпочки (гаметофитный тип несовместимости).
Клеточные технологии в селекции растений (по Р. Г. Бутенко, 1999)
|
Преодоление прогамной несовместимости возможно благодаря выращиванию в стерильных условиях изолированной завязи с нанесенной на нее пыльцой или изолированных кусочков плаценты с семяпочками, рядом с которыми или непосредственно на ткани которых культивируется пыльца.
Значительным препятствием для селекции служит также пост- гамная несовместимость, вызванная разновременным развитием зародыша и эндосперма при отдаленной гибридизации. В результате образуются невсхожие щуплые семена. Получить растение из таких семян можно только при использовании метода эмбриокуль- туры, т.е. выращивания изолированного зародыша на искусственной питательной среде in vitro. Метод эмбриокультуры широко применяют при межвидовой гибридизации овощных растений, для микроразмножения ценных гибридов, для клеточной селекции.
Большое значение имеет создание гаплоидов, позволяющее ускорить процесс селекции в 2 — 3 раза. Использование гаплоидных клеток и гаплоидных растений способствует обнаружению экспрессии введенного в клетку генома, редких рекомбинаций, рецессивных мутаций, которые в диплоидных растениях, как правило, маскируются доминантными генами. Из гаплоидных клеток можно выделить протопласты; сливаясь, они образуют гибридные клетки и растения с диплоидным числом хромосом. Обрабатывая гаплоидные клетки колхицином, можно добиться удвоения числа хромосом и получить диплоидные гомозиготные растения. Все это значительно облегчает выявление и стабилизацию необходимых признаков. Кроме селекции гаплоиды применяются также в генно-инженерных исследованиях. Впервые возможность получения спонтанных гаплоидов при аномальном развитии пыльников, пыльцы и других объектов была показана в 1964 г. С. Гуха и С. Магешвари. В настоящее время в культуре гаплоидные растения получают из изолированных пыльников (андрогенез), изолированных семяпочек (гиногенез); из гибридного зародыша, у которого в результате несовместимости потеряны отцовские хромосомы (партеногенез). Новые сорта ячменя — Исток и Одесский-15 — были выведены благодаря комбинации партеногенетического метода с культурой изолированных зародышей за 4 года вместо 10—12 лет, необходимых для обычной селекции.
Создание генетического разнообразия исходных форм растений и скрининга генотипов. Сомаклональная изменчивость — прекрасный источник генетического разнообразия (сомаклональных вариаций), которое может быть реализовано в создании генетически измененных растений-регенерантов с новыми свойствами (со- маклональные варианты, или сомаклоны). Помимо повышения генетического разнообразия, использование сомаклональных вариантов в 2 раза может ускорить процесс выведения нового сорта даже для размножаемых семенами растений. Первые сомакло- нальные варианты табака были получены в Институте физиологии растений им. К.А.Тимирязева (Н.А.Загорина, З.П.Шамина, 1970).
Сомаклональные вариации нельзя рассматривать как случайные спонтанно возникающие мутации. Генетические изменения, характерные для сомаклональных вариаций, сложны и носят комплексный характер. Частота таких генетических изменений на три порядка превышает частоту спонтанных мутаций. Кроме того, сомаклональные варианты отличаются от исходного растения не только качественными моногенными признаками, но и количественными — полигенными (интенсивность роста, продуктивность, устойчивость к неблагоприятным факторам внешней среды).
Отмечены случаи появления сомаклональных вариантов, сочетающих признаки, которые невозможно или трудно соединить в одном генотипе традиционным селекционным путем. Так, Л.А.Кучеренко (1986) выделила из сомаклональных вариантов, возникших в каллусной культуре риса, растения, сочетавшие скороспелость и длиннозерность. На их основе за короткий срок был. создан новый сорт риса.
По-разному сказываются на генетических изменениях и, следовательно, на появлении сомаклональных вариаций различные типы морфогенеза. Экспериментально установлено, что при соматическом эмбриогенезе цикл «клетка — растение» совершается значительно быстрее, чем при органогенезе. Поэтому степень различия между полученным и исходным родительским генотипом в случае органогенеза может быть значительно выше, чем при эмбриогенезе.
Источником генетического разнообразия растительного материала могут быть не только сомаклональные вариации, но и мутагенез, в несколько раз повышающий образование стабильно устойчивых по искомым признакам клонов клеток.
После получения различных сомаклональных вариаций от исходного растения наступает следующий этап — отбор необходимых сочетаний признаков. Данный вопрос решается с помощью клеточной селекции, которую проводят практически на любом объекте, введенном в культуру in vitro. Однако удобнее использовать суспензионную культуру или изолированные протопласты. Преимущество этих объектов состоит в быстром росте культуры и равномерном действии селективного фактора на все клетки. Для отбора сомаклональных вариаций соответствующие селективные факторы (соли в высоких концентрациях, гербициды и др.) добавляют в питательную среду для выращивания культуры клеток либо растущие культуры помещают в селективные условия (низкая или высокая температура, освещенность и т.д.). Существует несколько методов клеточной селекции:
1. Прямая (позитивная) селекция, при которой выживает только заданный тип мутантных клеток.
2. Непрямая (негативная) селекция, которая ведет к гибели делящихся клеток дикого типа и выживанию метаболически неактивных клеток. Этот прием требует дополнительной идентификации мутационных изменений у выживших клеток.
3. Тотальная селекция, при которой индивидуально тестируются все клеточные клоны.
4. Визуальная селекция и неселективный отбор, когда необходимая вариантная линия выбирается среди прочих визуально или с помощью биохимических методов.
Для отбора клеток, устойчивых к неблагоприятным или стрессовым факторам, наиболее часто применяют прямую селекцию. После выбора нужной популяции необходимо проверить стабильность устойчивости к неблагоприятному фактору. Это длительный процесс, включающий многочисленные циклы выращивания и пересадки клеток на среды, содержащие селективный фактор или без него. Из стабильных клонов необходимо попытаться регенерировать растения. Получение растений-регенерантов, а также гибридологический анализ подтверждают генетическую природу при-
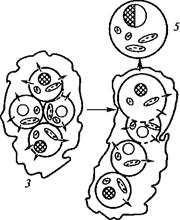
заряд, который вызывает их взаимное отталкивание. Для слияния это отталкивание необходимо преодолеть специальными приемами, способствующими снятию или перераспределению поверхностного заряда мембран. Впервые искусственное слияние протопластов с помощью индуктора слияния (фьюзогена) было осуществлено в 1970 г. Коккингом и его сотрудниками. В настоящее время в качестве эффективных фьюзогенов используют полиэти- ленгликоль (ПЭГ) и растворы с рН 9—11 и высокой концентрацией ионов кальция. Согласно одной из гипотез, объясняющих слияние протопластов при использовании ПЭГ, высокая концентрация этого вещества (20—30 %) способствует поглощению всей свободной воды между протопластами, вызывая их слипание в результате дегидратации. Кроме того, поглощение свободной воды индуцирует образование пор в мембране, через которые перетекает внутриклеточное содержимое. Если повреждения мембран обратимы, слипшиеся протопласты регенерируют клеточную стенку (рис. 6.7).
|

|
|
| Рис. 6.7. Схема слияния протопластов под действием полиэтиленгликоля (по X. Борнман, 1991): 1 — изолированные протопласты; 2— слипание протопластов в результате дегидратации; 3 — образование пор в мембране протопласта; 4 — перетекание через поры внутриклеточного материала; 5 — гибридный протопласт |
Кроме того, существует физический фактор — импульсы электрического тока, который также заставляет протопласты сливаться. Обработка электрическими импульсами, как и обработка ПЭГ, приводит к обратимому повреждению мембран. Применение переменного тока вызывает диэлектрофорез, и протопласты, находящиеся между электродами, выстраиваются в ряд, примыкая друг к другу своими полярными поверхностями. Импульс постоянного
тока приводит к образованию пор, через которые происходит слияние (рис. 6.8).
При соматической гибридизации развиваются клетки двух типов: гибриды и цибриды. При образовании гибридов объединяется ядерный геном обеих клеток. Цибридная клетка содержит цитоплазму обоих партнеров, а ядро — одного. Такой результат достигается при деградации одного из ядер после слияния или в том случае, если один из протопластов был лишен ядра.
Первый неполовой гибрид высших растений был получен в 1972 г. при слиянии изолированных протопластов двух видов табака: Nicotiana glauca и Nicotiana langsdorfti. В настоящее время получено много межвидовых, межсемейственных и межтрибных гибридов, значительную часть которых нельзя считать нормальными растениями, а некоторые гибриды (гибрид арабидопсиса и турнепса) представляют собой растения-монстры. Возникающие аномалии — результат хромосомной несбалансированности. Описаны случаи возникновения гибридов между протопластами эритроцитов крысы и дрожжевых клеток, моркови и человека и др. Любые исследования, любые манипуляции в области создания новых генотипов должны быть тщательно и всесторонне продуманы, а ученые должны помнить об ответственности и научной этике. Профессор Колумбийского университета Э. Чаргафф предупреждал о том, что «в тысяче опытов, вероятно, ничего не случится,
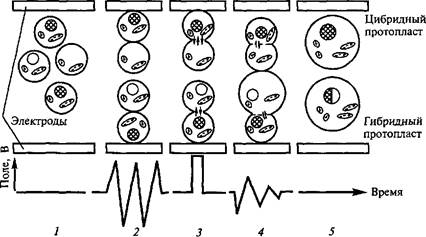 Рис. 6.8. Схема слипания протопластов под действием электрического поля (по Х.Борнман, 1991):
/ — изолированные протопласты; 2 — слипание протопластов полярными поверхностями; 3 — образование пор в мембранах под действием сильного импульса постоянного тока; 4 —смешивание цитоплазмы; 5 — образование цибридных (гибридных) протопластов
Рис. 6.8. Схема слипания протопластов под действием электрического поля (по Х.Борнман, 1991):
/ — изолированные протопласты; 2 — слипание протопластов полярными поверхностями; 3 — образование пор в мембранах под действием сильного импульса постоянного тока; 4 —смешивание цитоплазмы; 5 — образование цибридных (гибридных) протопластов
|
hq затем в одном каком-то случае произойдет нечто очень неприятное». Он был «убежден, что именно попытка преобразовать или перехитрить природу почти привела к ее гибели».
Введение в протопласты макромолекул, клеточных органелл и бактериальных клеток. Чужеродный генетический материал можно переносить в клетку не только при соматической гибридизации, но и при непосредственном введении ДНК или органелл, содержащих ДНК, в изолированные протопласты. Работы в этом направлении начаты не так давно, но уже получены интересные результаты. Так, поглощение экзогенных макромолекул ДНК показано у протопластов петунии, сои, моркови. Проведена трансплантация органелл (ядер, митохондрий, хлоропластов) в протопласты растений. Наибольшую важность представляют опыты по трансплантации хлоропластов одних растений в клетки других. П.Карлсон провел опыты по введению хлоропластов нормального зеленого растения Nicotiana suaveolens в протопласты пестролистного мутанта N. tabacum. В результате культивирования протопластов были получены зеленые каллусы, из которых регенерировали растение, оказавшееся пестролистным. Для того чтобы понять, содержит растение-регенерант элементы геномов двух видов Табаков или только одного, проанализировали белковую фракцию I, в которую входит ключевой фермент цикла Кальвина — рибулозодифосфаткарбоксилаза (РДФ-карбоксилаза). Этот фермент состоит из двух больших субъединиц и двух малых. Большие субъединицы кодируются геномом хлоропластов, малые — ядерными генами. Анализ состава белковой фракции I растения- регенеранта показал присутствие полипептидов, характерных и для пластид N. tabacum, и для пластид N. suaveolens. Перспективность работ по трансплантации хлоропластов заключается в том, что введение высокоэффективных хлоропластов может способствовать активации фотосинтеза и повышению продуктивности других растений.
Дата добавления: 2016-02-09; просмотров: 1183;
