БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 25 страница
ГРЧ в клетках Е. coli и в культуре клеток животных был получен в 1982 г. одновременно в Институте Пастера (Париж) и в Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГРЧ, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и синтез полипептида, обладающего полной биологической активностью гипо- таламического рилизинг-фактора соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, обусловленных недостатком этого гормона, и ряда патологических заболеваний, таких, как некоторые формы диабета, регенерация тканей после ожогов и др. Предполагаем, что СТГ-РФ можно использовать и для увеличения массы и роста домашних животных, так как он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у ряда животных.
Р-Эндорфин — опиат мозга, состоящий из 31 аминокислотного остатка, был синтезирован в генетически сконструированных клетках в 1980 г. группой ученых из Австралии и США. Р-Эндорфин получен в клетках Е. coli в виде гибридного белка с Р-галактози- дазой. Процедура синтеза Р-эндорфина включала: получение путем обратной транскрипции мРНК — кДНК, кодирующей белок- предшественник, содержащий помимо последовательности Р-эн- дорфина последовательность АКТГ и p-липотропина (Р-ЛТГ), в дальнейшем удаляемые. p-Эндорфин, полученный из гибридного белка и тщательно очищенный, обладал значительной биологической активностью. Он специфически взаимодействовал с антисывороткой против Р-эндорфина. От p-эндорфина человека генно-инженерный p-эндорфин отличался по двум аминокислотам, и эти отличия можно было легко устранить на нуклеотидном уровне путем замены двух кодонов в ДНК бактериальной плазмиды.
5.9. ПОЛУЧЕНИЕ ИНТЕРФЕРОНОВ
Интерфероны были открыты в 1957 г. в Национальном институте медицинских исследований в Лондоне как факторы устойчивости к вирусной инфекции. Было установлено, что клетки животных, подвергнутые воздействию вируса, выделяют в среду фактор, способный придавать свежим клеткам устойчивость к вирусной инфекции: он как бы препятствовал (интерферировал) размножению вирусов в клетке и в силу этой способности был назван интерфероном.
Известны три группы интерферонов: а-интерфероны (а-И), образующиеся при воздействии вирусов на лейкоциты; Р-интер- фероны (Р-И), появляющиеся при воздействии вирусов на фибро- бласты; у-интерфероны, продуцируемые Т-лимфоцитами в ответ на воздействие бактериальными и вирусными антигенами или антисыворотками против поверхностных детерминант лимфоцитов.
Все интерфероны (кроме а-И) гликопротеины; они представляют собой типичные глобулярные белки, причем на долю а-спи- ральных структур приходится от 40 до 75 %. В а-И обнаружены две дисульфидные связи. Интерфероны — низкомолекулярные белки из 146—166 аминокислотных остатков; видоспецифичны.
К числу наиболее хорошо исследованных интерферонов человека следует отнести а-интерфероны; число генов, их кодирующих, примерно 20. у-Интерферон в отличие от гетерогенного класса а- интерферонов представлен всего одним индивидуальным белком, который кодируется одним геном. Менее ясна ситуация в отношении Р-интерферонов. Выделен только один белок, соответствующий Р-интерферону человека, — интерферон р,; ему соответствует практически вся противовирусная активность, обнаруживаемая после индукции фибробластов. Не исключено, что в геноме существует ряд генов, кодирующих различные Р-интерфероны. Интерфероны — это как бы первая линия обороны против инфекции.
Интерфероны широко используются для лечения различных тяжелых заболеваний — острого вирусного гепатита, рассеянного склероза, остеосаркомы, миеломы и некоторых видов лимфом. Их применяют и для лечения меланом, ряда опухолей гортани, легких и мозга.
С учетом видоспецифичности интерферонов, предназначенных для лечения, необходимы такие препараты, которые получены из клеток человека. Традиционно их извлекают из крови человека (из 1 л крови можно выделить всего 1 мкг интерферона, т. е. примерно одну дозу для инъекции). Долгое время большая часть мирового производства интерферонов осуществлялась в Финляндии (Хельсинки), а позже — во Франции. С 1980 г. одна из японских компаний наладила производство лимфобластоидного интерферона из лимфобластоидных клеток. С этой целью культура данных клеток индуцировалась вирусом сендай, после чего интерферон выделяли с помощью хроматографических колонок, заполненных моно- клональными антителами против получаемого интерферона. В Швеции лимфобласты выращивали в ферментерах объемом 2000 л; полученные интерфероны очищали с помощью моноклональных антител.
Из всех видов интерферонов для мирового производства наиболее пригоден (3-И. Фибробласты, получаемые из тканей плода, можно поддерживать в культуре клеток, что дает возможность массового производства. Метод получения 3-интерферона был разработан в Англии.
В целом вышеперечисленные методы получения интерферонов характеризуются низким выходом, высокой стоимостью и недостаточной чистотой препарата. На современном этапе наиболее перспективный метод — биосинтез интерферонов с помощью генетически сконструированных микроорганизмов. Однако использование генно-инженерных технологий для получения интерферонов человека сопряжено с рядом трудностей. Во-первых, в смеси мРНК, кодирующих различные белки, содержание кодирующих интерферон чрезвычайно мало — всего около 0,1%. Тем не менее кДНК, полученные обратным транскрибированием, были клонированы в Е. coli, что явилось революционным событием в теоретических и прикладных исследованиях интерферонов. Ген интерферона был встроен в векторную ДНК, и к нему были присоединены бактериальные регуляторные элементы, программирующие его транскрипцию и трансляцию в бактериальной клетке (рис. 5.15).
Установлено, что интерфероны синтезируются в клетке сначала в виде предшественников, содержащих на N-конце полипептидной цепи сигнальный пептид, который затем отщепляется, и в результате образуется зрелый интерферон, обладающий полной биологической активностью. Бактерии не содержат ферментов,
Точка инициации
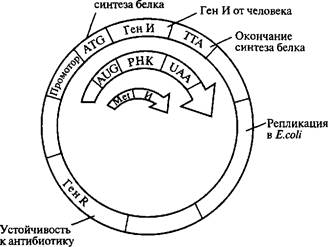 Рис. 5.15. Схема рекомбинантной плазмиды, обусловливающей синтез интерферона человека в Е. coli
Рис. 5.15. Схема рекомбинантной плазмиды, обусловливающей синтез интерферона человека в Е. coli
|
способных отщепить сигнальный пептид с образованием зрелого белка. Поэтому для того чтобы бактерии синтезировали зрелый интерферон, следует ввести в плазмиду только ту часть гена, которая его кодирует, и удалить часть гена, кодирующую сигнальный пептид. Данная процедура осуществлялась следующим образом. Геь интерферона содержит три участка расщепления рестриктазой Sau ЗА1, из которых один находится рядом с сигнальной частью. Неполное расщепление гена этим ферментом позволяет выделить фрагмент гена, содержащий нуклеотидную последовательность, кодирующую зрелый интерферон, но без первого цистеина. Триплет ATG, кодирующий цистеин, отщепляется ферментом вместе с сигнальной частью. Для восстановления полинуклеотидной последовательности полного гена химически был синтезирован небольшой фрагмент ДНК, содержащий данный триплет, а также примыкающий к нему триплет ATG — точка инициации синтеза белка. Этот фрагмент присоединили к изолированной части зрелого гена, и в результате был восстановлен полный ген зрелого интерферона. Реконструированный ген ввели в плазмиду таким образом, что с ним оказался рядом участок ДНК-промотор, обеспечивающий начало синтеза мРНК. Экстракты из Е. coli, содержащие такую плазмиду, обладали противовирусной активностью.
Синтезированный генно-инженерным способом интерферон был выделен, очищен, и его физико-химические свойства оказались близкими свойствам интерферона, полученного из крови, доноров. Удалось получить бактерии, способные синтезировать до 5 мг интерферона на 1 л бактериальной суспензии, содержащей примерно 10й бактериальных клеток, что в 5000 раз превосходит то количество интерферона, которое можно извлечь из 1 л крови доноров. При использовании генно-инженерных технологий в разных лабораториях были получены штаммы бактерий, продуцирующих различные интерфероны: а-, (3- и у-типов. Недостаток использования Е. coli для получения [3- и у-интерферонов — отсутствие В бактерии аппарата гликозилирования эукариотических белков, что приводит к синтезу негликозилированных молекул. И хотя роль' гликозилирования неясна и негликозилированные р- и у-интер- фероны практически полностью сохраняют противовирусную активность, эта особенность диктует осторожный подход к использованию генно-инженерных препаратов в медицинской практике.
В настоящее время гены интерферонов клонированы в дрожжИ| и клетки высших эукариот, способных осуществлять гликозили- рование.
В 1981 г. в США впервые для синтеза лейкоцитарного интерфе-" рона человека были употреблены генетически сконструированные клетки дрожжей Saccharomyces cerevisiae. Полученная эффек; тивная экспрессия гена LeIF и замена бактерий клетками дрож жей позволили увеличить производство интерферона в 10 раз. >
Большое количество исследований было посвящено химическому синтезу гена, кодирующего ЛИЧ из 166 аминокислот. Соответственно, данный ген из 514 н.п. оказался самым крупным геном, синтезированным в 1982 г. группой английских ученых. В России в 1984 г. был осуществлен полный синтез гена а-И размером
Интерферон ♦
Мембранный рецептор
| Мессенджер
эоооооос

| 5'-Олигоаденилат- синтетаза |
 Протеинкиназа 1
Протеинкиназа 1
|
Клеточный геном
Индукция ^ синтеза ферментов
к», .»•.'» •«., i / Л <V Л- A- At н ч Л' *
Двухцепочечная РНК
| Ингибирование синтеза белка |
Активация РНКазы I, деградация иРНК и рРНК
Рис. 5.16. Механизм действия интерферона
примерно 600 н.п. (Институт биоорганической химии под руксй| водством М. Н. Колосова).
Несмотря на успехи, достигнутые в области получения интерн феронов с помощью генно-инженерных технологий и их приме-*, нения для лечения различных вирусных заболеваний, в том числе? онкологических, предстоит еще решить многие вопросы. На co-f временном этапе не все гены интерферонов идентифицированы:! обнаружены новые гены aL; мало известно о генах фибробластно-; го интерферона (кроме гена Pi); до конца не расшифрованы механизмы их биосинтеза и взаимодействия с другими веществами. Выяснение многих явлений, связанных с интерферонами, приведет; к созданию новых средств для лечения ряда тяжелых заболеваний.
Схема биологического действия интерферона представлена на рис. 5.16. ;>
Механизм действия интерферона можно свести к следующим? основным этапам. Связываясь с клеточными рецепторами, интер-, фероны инициируют синтез двух ферментов: 2',5'-олигоаденилат- синтетазы и протеинкиназы за счет инициации транскрипции соответствующих генов. Оба фермента проявляют свою активность в присутствии двухцепочечных ДНК, являющихся продуктами репликации многих вирусов или содержащихся в их вирионах. Фер-, мент 2',5'-олигоаденилатсинтетаза катализирует синтез 2',5'-олиго-; аденилатов (из АТР), которые активируют клеточную рибонуклеа- зу I; протеинкиназа фосфорилирует (и тем самым активирует) фактор инициации трансляции IF2. В результате этих событий ингиби- > руются биосинтез белка и размножение вируса (деградация иРНК. и рРНК) в инфицированной клетке, что вызывает ее лизис. Вероятны и другие механизмы действия интерферонов, например, инактивация тРНК, нарушение процессов метилирования и др. .
5.10. ГЕННАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ
I
Генно-инженерные методы, в частности технология рекомби-* нантных ДНК, позволяют создавать новые генотипы и, следова-, тельно, новые формы растений гораздо быстрее, чем классические методы селекции. Кроме того, появляется возможность целе-' направленного изменения генотипа — трансформации — благси даря введению определенных генов. '
Проблемы выращивания сельскохозяйственных растений связаны с перспективой ввода в них генов устойчивости к стрессовым факторам, фитопатогенам, гербицидам и пестицидам, генов скороспелости, а также с расширением круга культурных расте ний, способных к симбиотической фиксации азота и т.д.
Генетическая трансформация заключается главным образом ^ переносе чужеродных или модифицированных генов в эукариоти-
ческие клетки. Можно вводить гены в клетки прокариот, но этот перенос осуществляется не для трансформации, а в целях увеличения экспрессии чужеродных генов, их клонирования. В клетках растений также возможна экспрессия генов, перенесенных не только от других растений, но и от микроорганизмов и даже от животных.
Получение растений с новыми свойствами из трансформированных клеток (регенерация) возможно благодаря их свойству тотипотентности, т.е. способности развиваться в целое растение.
Однако возможности генной инженерии растений ограничиваются рядом причин. Во-первых, геном растений изучен хуже, чем геном млекопитающих. Это значит, что определение и выделение искомых генов — задача очень трудная. Во-вторых, не для всех растений удается подобрать условия регенерации. Стабильно получают растения-регенеранты из протопластов картофеля, люцерны, томатов, моркови, табака, капусты и др. Регенерацию злаков из их клеток пока не всегда удается воспроизвести. Наконец, одна из главных лимитирующих причин — размер гетерологичной ДНК (не более 35 кб для агробактериальной и немного больше лля баллистической трансформации), которую можно было бы эффективно вводить в геном растения. Не так давно была сделана удачная попытка использовать при трансформации пыльцу в качестве супервектора, что позволяет исключить появление химерных растений (В. А. Аветисов, Ю. В.Давыдова и др., 1999). Имеются сообщения об использовании искусственной бактериальной хромосомы в качестве вектора для трансформации, которая позволяет переносить значительные фрагменты ДНК, вводить кассеты генов, кодирующие множественные ступени биохимических процессов. Это открывает такие огромные перспективы, что первостепенными становятся вопросы экологической безопасности.
Биотехнология и, в частности, генная инженерия подошли к той ступени развития, когда прежде всего приходится думать о возможных последствиях эксперимента, об использовании полученных знаний.
5.10.1. Получение трансгенных растений
Перенос генов в растительные клетки, так же как в клетки животных, и их встраивание в геном растений (трансформация) осуществляются главным образом благодаря специфическим структурам — векторам.
Векторы на основе Ti-плазмид. Некоторые виды агробактерий (Agrobacteria) могут заражать двудольные растения, вызывая образование опухолей — корончатых галлов. Одним из самых сильных индукторов опухолей служит почвенная бактерия A. tumefaciens. Способность этой бактерии к образованию опухоли связана с большой внехромосомной плазмидой, получившей название Ti-плаз-
•> п..
мида (от англ. tumor inducing— индуцирующие опухоль). "П-пла;.- миды — это естественные векторы для генов, обладающие всем* функциями, необходимыми для переноса, стабильного включи ния и экспрессии генетической информации в растениях. Ош_ имеют широкий круг хозяев. В бактериальных клетках Ti-плазми- ды реплицируются автономно. Эти плазмиды различаются по тигг кодируемых опинов — белков, которые используются бактериями в качестве источников азота и углерода. Обычно встречаются плазмиды, кодирующие два типа опинов: либо октопин (октопи новая плазмида), либо нопалин (нопалиновая плазмида).
После заражения часть Ti-плазмиды встречается в хромосома: клеток растения-хозяина. Следовательно, A. tumefaciens встраивает часть своего генома в ДНК растительной клетки и заставляет et- таким способом изменять метаболизм, синтезируя вещества, не обходимые для бактерий. Именно это свойство A. tumefaciens i послужило поводом для создания на основе Ti-плазмиды вектора, доставляющего необходимые гены в клетку.
Участок Ti-плазмиды, встречающийся в хромосомах растительных клеток, называется Т-областью в бактерии и Т-ДНК в клетках растений. Т-область включает примерно 10 % Ti-плазмиды и содержит гены, отвечающие за индукцию опухоли, синтез опинов и подавление дифференцировки (гормоннезависимый рост клеток). Важно отметить, что все гены, ответственные за перенос и интеграцию генов Т-области, находятся не в ней самой, а рядом — в области вирулентности — vir-области (рис. 5.17).
Т-области ограничены прямыми повторяющимися последовательностями, и любая ДНК, вставленная между этими повторами, будет принята за Т-область и перенесена в растительную клетку Недостаток этих плазмид состоит в том, что некоторые гены находящиеся в Т-ДНК, заставляют расти клетки растений незави симо от гормонов, вносимых в питательную среду, на которой куль
тивируются данные клетки. В свя зи с этим очень трудно регене рировать нормальное растение и клеток, содержащих полнук, последовательность Т-ДНК. Дру гой недостаток — большие par меры Ti-плазмиды, из-за коте рых затруднены какие-либо м. нипуляции с ней, поэтому вст вить ген в плазмиду традицио! ными методами невозможно.

| Т-область |
| vir- область! |
| Рис. 5.17. Взаимное расположение Т- и vir-областей в Ti-плазмиде |
В настоящее время констр ируются производные Ti-пла миды, в которых оставляют р гуляторный участок Т-обласг
а вместо ее структурных генов вшивают структурную часть гена, который надо ввести в растение. Такие гены с позиции их регенерации безвредны для растений.
Существуют и другие бактерии (A. rhizogenes), вызывающие усиленное образование корешков при заражении растений. За этот процесс ответственны содержащиеся в них так называемые Ri- плазмиды (от англ. root inducing — индуцирующий корни). Ri-плаз- миды выгодно отличаются от Ti-плазмид тем, что они служат естественными безвредными векторами, так как трансформированные с их помощью растительные клетки сохраняют способность к морфогенезу и к регенерации здоровых растений. В связи с этим Ri-плазмиды в данный момент рассматриваются как более перспективные векторы.
Промежуточный и бинарный векторы. Эти векторы конструируются на основе Ti-плазмид. Промежуточный вектор получают путем ряда сложных операций. Сначала Т-область с помощью рест- риктаз вырезают из плазмиды, вставляют в вектор для клонирования в клетке Е. coli и размножают. Затем внутрь Т-области встраивают чужеродный ген и вновь размножают. Полученную реком- бинантную плазмиду вводят в клетки A. tumefaciens, несущие полную Ti-плазмиду. В результате двойного кроссинговера между гомологичными участками Т-область рекомбинантной плазмиды, содержащая чужеродный ген, включается в Ti-плазмиду клетки хозяина, заместив в ней нормальную Т-область. Наконец, бактериями, имеющими Ti-плазмиду со встроенными генами, заражают растения, где эти гены встраиваются в геном растительной клетки.
Бинарные векторы представляют собой бактерии, содержащие две разные Ti-плазмиды. Одна из них несет vir-область и обеспечивает интеграцию в геном растительной клетки Т-области, содержащей любые гены другой плазмиды. В этом случае двойной кроссинговер не требуется.
Однако полученные в результате заражения бактериями растительные клетки не способны к регенерации, так как у них подавлена дифференцировка. Трансформированные растительные клетки смогут дифференцироваться, если в гены, блокирующие диффе- ренцировку, ввести мутации или вырезать их из Т-ДНК.
Векторы на основе ДНК-содержащих вирусов растений. Вирусы можно рассматривать как разновидности чужеродной нуклеиновой кислоты, которые реплицируются и экспрессируются в клетках растений. Подавляющее большинство фитовирусов в качестве носителя генетической информации содержат РНК. Только 1 — 2 % чирусов, инфицирующих растения, относятся к ДНК-содержа- щим. Именно эти вирусы удобны для использования в технологии Рекомбинантных ДНК, а также в качестве векторов.
ДНК-содержащие вирусы могут включать одноцепочечную или двухцепочечную ДНК. В качестве представителей первой группы можно назвать вирус золотистой мозаики фасоли (ВЗМФ| или вирус полосатости кукурузы. Наиболее изученный представитель группы вирусов с двухцепечечной ДНК — вирус мозаики цветной капусты (ВМЦК), поражающий в основном растения' семейства крестоцветные.
Обычно фитовирусы реплицируются с образованием большое го числа копий молекул нуклеиновых кислот — 106 и более молекул на зараженную клетку. Например, при репликации вируса табачной мозаики образуется 107 молекул нуклеиновых кислот (РНК) на клетку. Поэтому фитовирусы представляют собой очень эффективные средства для получения хорошей экспрессии чужеродного гена. Кроме высокой копийности вирусной нуклеиновой кислоты вирусные векторные системы имеют еще ряд преимуществ: малый размер генома (возможность легкой манипуляций вирусной ДНК) и сильные промоторы, обеспечивающие эффективную экспрессию чужеродных генов.
Однако вирусы в качестве векторов обладают и существенным^ недостатками: имеют небольшую емкость, патогенны и неспособ* ны встраиваться в хромосомы хозяина. Небольшую емкость мож% но увеличить, если инфицировать вирусом (например, ВМЦК| растительные протопласты, а не клетки. В этом случае инфекция не передается от клетки к клетке, нет необходимости в упаковке ДНК в вирусные частицы. ;
Следовательно, часть вирусного генома, ответственная за упа* ковку в вирусные частицы, может быть удалена и замещена до, полнительной чужеродной ДНК. Другой недостаток — отсутствий способности встраиваться в геном растительной клетки — удается обойти (по крайней мере для ВМЦК) благодаря специальном! методическому приему — агроинфекции. Для этого геном ВМЦ1 встраивают в Т-область Ti-плазмиды и в ее составе интегрируют ядерный геном различных растений.
Методы прямого переноса генов в растение. Эти методы возню* ли благодаря появлению специфического объекта — изолирован ных протопластов, т. е. клеток, лишенных целлюлозной стенки. -
Методы прямого переноса генов довольно многочисленны:
1. Трансформация растительных протопластов. Осуществляете благодаря комбинации методик кальциевой преципитации ДР и слияния протопластов. Для трансформации может быть испол зован практически любой ДНК-вектор. Донорная ДНК может * содержать специальных биологических сигналов (vir-областей, m граничных областей Т-ДНК).
2. Культуру протопластов на начальной стадии ее роста зараж! ют агробактериями, которые используют в качестве векторов.
3. Микроинъекции ДНК. Аналогичен методу микроинъекщ животных клеток. Этот метод можно рассматривать как наибоя универсальный. Эффективность трансформации растительных клй ток — 10 — 20% независимо от типа вектора. Трансформация не видоспецифична, возможен перенос генов в любое растение.
4. Электропорация. Метод основан на повышении проницаемости биомембран за счет действия импульсов высокого напряжения. В результате молекулы ДНК проникают в клетки через поры в клеточной мембране.
5. Упаковка в липосомы. Это один из методов, позволяющих защитить экзогенный генетический материал от разрушения нук- леазами растительной клетки. Липосомы — сферические тельца, оболочки которых образованы фосфолипидами.
Метод биологической баллистики. Это один из самых эффективных методов трансформации однодольных растений. Исходный материал для трансформации — суспензионная культура, каллусная ткань или 4—5-дневные культивируемые незрелые зародыши однодольных.
Метод основан на напылении ДНК-вектора на мельчайшие частички вольфрама, которыми затем бомбардируют клетки. Бомбардировка осуществляется с помощью биолистической пушки за счет перепада давления. Часть клеток гибнет, а выжившие клетки трансформируются, затем их культивируют и используют для регенерации растений.
5.10.2. Применение методов генетической инженерии для улучшения аминокислотного состава запасных белков растений
Решение проблемы создания новых форм растений подразумевает в первую очередь повышение качества синтезируемых растением продуктов, которые определяют его питательную и техническую ценность. В основном это касается запасных белков.
В большинстве случаев запасные белки растений имеют несбалансированный для питания человека и животных аминокислотный состав. Так, запасные белки злаков — проламины — бедны лизином, триптофаном и треонином, что снижает их питательную и кормовую ценность. Улучшение аминокислотного состава белка путем традиционной селекции не дает желательных результатов, поскольку необходимые гены часто сцеплены с нежелательными признаками и наследуются вместе. Например, у мутантов кукурузы и ячменя повышение содержания лизина коррелировало с уменьшением синтеза основных запасных белков — зеи- на и гордеина, а также с уменьшением урожайности.
Генно-инженерные методы более перспективны для создания улучшенных сортов, так как позволяют избирательно вводить в геном растения-реципиента гены искомого признака. Операции по получению трансгенных растений с улучшенным аминокислотным составом белка разделены на ряд этапов: 1) клонирование генов запасных белков; 2) изучение механизмов тканеспецифичной и временной экспрессии белков и выявление последовательностей
ДНК, определяющих данный механизм; 3) целенаправленное изменение последовательностей генов запасных белков для улучшения аминокислотного состава; 4) создание векторов, содержащих измененный ген; 5) введение модифицированных генов в растения.
В настоящее время клонированы 10 генов гордеинов ячменя, гены а- и р-глиадинов и глютенина пшеницы, зеинов кукурузы, легумина бобовых, пататина картофеля и ряд других. Имеются практические результаты трансформации растений. Так, введение в геном пшеницы модифицированного гена проламина привело к активному синтезу модифицированного белка, а также повлияло на состав и уровень соответствующих запасных белков. В итоге улучшилось хлебопекарное качество пшеничной муки.
5.10.3. Повышение эффективности процесса фотосинтеза
Один из возможных способов увеличения фотосинтеза и, следовательно, продуктивности растений состоит в клонировании хлоропластных генов в клетках бактерий и их переносе в растения. Известно, что хлоропласты и прокариотические клетки сходны по ряду признаков. На основании этого возникла симбиотическая гипотеза происхождения хлоропластов, впервые выдвинутая А. С. Фамин- циным (1886). Согласно этой гипотезе, клетки прокариот и хлоропласты сходны. В них присутствуют кольцевые ДНК, 70S-pn6o- сомы; синтез белков начинается с одной и той же аминокислоты — N-формилметионина, а синтез белка подавляется хлорамфенико- лом, а не циклогексимидом, как у эукариот. Позже было показано, что ДНК-зависимая РНК-полимераза Е. coli связывается с определенными участками ДНК хлоропластов шпината.
В клетках Е. coli инициация белкового синтеза частично регулируется доступностью участка связывания рибосом (УСР). Его структура до конца еще не выяснена, но расшифрован участок, известный под названием «последовательность Шайн-Дальгарноя (ШД). Она комплементарна З'-концу 168-рибосомальной РНК, и! инициация белкового синтеза начинается с образования комплементарной пары между этой последовательностью и З'-концом 16S- рибосомальной РНК. Анализ последовательности ДНК хлороплас-i тного гена большой субъединицы основного фермента фотосин-j теза — рибулозодифосфаткарбоксилазы (РДФкарбоксилазы) куп курузы — выявил значительные гомологии с известными промотор рами и последовательностями ШД клеток Е. coli. Все это привело^ к попытке клонирования генов хлоропластов в клетках Е. coli, наш; более часто используемой в генно-инженерных исследованиях, ч
Транскрипционные конструкции могут создаваться двумя nyi тями: во-первых, это установка промотора рядом с УСР, котой рый узнается полимеразой Е. coli, во-вторых, это формирований гибридного УСР, состоящего из прокариотической последователь!
ности ШД и эукариотического или синтетического инициирующего кодона. Первый путь широко применяется для увеличения экспрессии генов Е. coli и хлоропластных генов в клетках Е. coli.
В настоящее время уже клонировано несколько хлоропластных генов: гены синтеза субъединиц РДФкарбоксилазы, белка хлорофилл-белкового комплекса, АТФсинтетазы, цитохрома и др.
5.10.4. Генно-инженерные подходы к решению проблемы усвоения азота
Азот — один из самых необходимых элементов для растений. Его недостаток в почве или питательном субстрате часто приводит растение к гибели, поэтому в первую очередь необходимо внесение в почву азотных удобрений. Однако их производство требует очень больших энергетических затрат, поэтому оно дорогостояще. Стоимость азотных удобрений в 6 раз выше стоимости фосфорных удобрений и в 16 раз выше стоимости калийных удобрений. При этом растения используют только от 30 до 70 % внесенных в почву доступных форм азота, остальное просто вымывается из почвы, загрязняя окружающую среду. Гораздо более естественно и доступно снабжение растений азотом путем его биологической фиксации.
Дата добавления: 2016-02-09; просмотров: 713;
