БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 24 страница
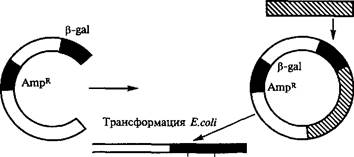
Суммарная активность экспрессируемого гена возрастает с ростом числа копий рекомбинантной ДНК в расчете на клетку. Используя многокопийные плазмиды, можно получить сверхсинтез нужных белковых продуктов. Получены температурно-чувствитель- ные мутантные плазмиды, способные накопить до 1 — 2 тыс. копий на клетку без нарушения жизненно важных функций бактерий. Обычно же используемые плазмидные векторы поддерживался в клетке в количестве 20 — 50 копий. Получение бактериальных штаммов-сверхпродуцентов плазмидных генов — одна из важнейших задач современной биотехнологии в экономическом, медицинском и социальном аспектах.
5.5. КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ ГЕНОВ В РАЗЛИЧНЫХ ОРГАНИЗМАХ
В настоящее время разработаны системы клонирования в бг териях, дрожжах, грибах, растениях и млекопитающих. Особ: интерес с экономической точки зрения представляют систе] клонирования генов в грамположительных бактериях, многие которых являются сверхпродуцентами важнейших химических < единений. Значительных успехов в биоиндустрии удалось досга с клетками Bacillus subtilis, стрептомицетами и Saccharomy cerevisiae.
Векторы для клонирования в таких системах представляют < бой двойные репликоны, способные существовать ив Е. coli, ] той клетке хозяина, для которой они предназначены. С этой 1 лью создают гибридные векторы, содержащие репликон какс либо из плазмид Е. coli и требуемый репликон (из бактерий, дро жей и др.), и первоначально клонируют с последующим отбор требуемых генов в хорошо изученной системе. Затем выделены рекомбинантные плазмиды вводят в новый организм. Такие в< торы должны содержать ген (или гены), придающий клетке-хо: ину легко тестируемый признак.
В. subtilis — непатогенный почвенный микроорганизм. Клеи ная стенка бактерии имеет простую структуру, позволяющую с< ретировать многие белки в культуральную жидкость. В частное 20 различных видов бактерий синтезируют более 40 фермент© внеклеточной локализацией. В этих бациллах обнаружены плазь ды и фаги, генетика которых хорошо изучена. Клонирование а ществляется с помощью так называемых челночных векторов, ] торые способны реплицироваться в клетках нескольких хозяев: subtilis, Е. coli, Staphylococcus aureus. Векторы были получены кс бинацией in vitro фрагментов плазмид St. aureus, Е. coli и хро» сомных фрагментов В. subtilis. Полученные рекомбинантные iirrt мы несут признаки устойчивости к антибиотикам.
Стрептомицеты широко применяют в биотехнологии в ка1 стве продуцентов антибиотиков. Конструирование векторов ^ клонирования в них началось с выделения плазмиды Scp2 Streptomyces coelicolor. На основе этой плазмиды были сконстр] рованы векторы, придающие стрептомицетам устойчивость к J тибиотикам, например к метиленомицину А.
Клонирование в дрожжах. Среди дрожжей наиболее полно и чен вид S. cerevisiae. У этого вида в гаплоидных клетках содержи 17 хромосом, в их составе идентифицировано несколько сой генов. Большинство штаммов дрожжей содержат автономно р| лицирующуюся кольцевую ДНК длиной 2 мкм. Плазмида Scp| cerevisiae содержит около 6300 пар оснований и имеет 50—г^ копий на клетку. Ее гибриды с плазмидами обычно и использу*|
124 }
качестве векторов. Работа с дрожжами облегчается тем, что подобно бактериям они могут расти в жидкой среде и давать колонии на твердой среде, а такие имеют сравнительно короткое время регенерации (несколько часов) вследствие малого размера генома.
Процедура выделения ДНК в клетки дрожжей довольно проста. Обычно целлюлозную клеточную стенку удаляют обработкой ферментами, получая так называемые сферопласты. Их инкубируют с ДНК в присутствии СаС12 и полиэтиленгликоля. Мембрана при этом становится проницаемой для ДНК. Дальнейшая инкубация сферопластов в среде с агаром восстанавливает клеточную стенку. Селекция дрожжевых клонов, трансформированных реком- бинантными плазмидами, основана на применении в качестве клеток-хозяев определенных мутантов, не способных расти на среде, в которой отсутствует тот или иной питательный компонент. Векторная плазмида содержит гены, которые при попадании в клетку-хозяина придают ей этот недостающий признак. Трансформанты легко отбираются по их способности давать колонии на обедненной среде. Применяя приемы, аналогичные использовавшимся при клонировании в бактериях, удается достичь синтеза чужеродных белков в дрожжевых клетках. Эти клетки подобно В. subtilis секретируют большое количество белка во внеклеточную среду, что используется также для секреции чужеродных белков, например интерферона человека (с. 43).
Клонирование в клетках животных. Проблема введения генов в клетки млекопитающих очень важна для исследования функционирования генов высших эукариот.
Предварительно клонированные гены вводят в клетку животных различными путями. Суть одного из них состоит в трансформации клеток требуемым геном, соединенным с одним из генов, для которых осуществляется селекция. Для идентификации и последующего размножения клеток, содержащих интегрированную ДНК, был разработан метод, получивший название метода маркера. Примером может служить метод получения клеток, дефектных по синтезу фермента тимидинкиназы (ТК~-клетки). Такие клетки трансформировались фрагментами ДНК вируса герпеса (HSV), содержащего ген фермента ТК, и после трансформации они приобретали способность к синтезу фермента на селективной среде, т.е. становились ТК+-клетками. Клетки ТК+ легко отличаются от клеток ТК-, поскольку способны расти на средах с ами- ноптерином (ингибитор, блокирующий определенные стадии биосинтеза нуклеотидов), гипоксантином и тимидином. Следовательно, в данном случае для трансформации клеток животных были использованы гибриды бактериальных плазмид с геном ТК из вируса герпеса. Для этого предварительно проводили клонирование и идентификацию генов в клетках Е. coli и затем полученная рекомбинантная плазмида вводилась в ТК~-клетки. Анализ методом бдот-гибридизации подтвердил, что выжившие клетки содержали интегрированный в геном ТК-ген вируса герпеса.
Селективные маркеры дают возможность вводить в клетки млекопитающих любой ген, заранее лигированный с клонированным селективным маркером.
В последние годы сконструировано большое количество так называемых челночных векторов и их рекомбинантных производных, способных к репликации в животной и бактериальной клетках, экспрессирующие клонируемый ген в животной клетке. К числу таких векторов можно отнести векторы из плазмиды pBR322 и интактного района транскрипции ДНК SW-40. Геном SW-40 представляет собой циклическую ДНК длиной 5243 п.о. Однако в вирусах животных размеры несущественных областей малы и в них нельзя внедрить большие фрагменты чужеродной ДНК, например ген дигидрофолатредуктазы мыши размером 42 kb. В большинстве случаев чужеродная ДНК замещает существенные гены, в результате чего рекомбинантные вирусы утрачивают способность к репликации. Для ее функционирования используют «вирусы- помощники», синтезирующие продукты недостающих генов, за счет которых и существует рекомбинантный вирус. Обычно опухолевые вирусы (в том числе SV-40) внедряют свою ДНК в хромосому клетки-хозяина и тем самым убивают ее при своем размножении. Обычно вирус бычьей папилломы в трансформированных клетках существует в виде эписомы (=100 копий на клетку) и используется в качестве основы для конструирования эпи- сомных векторов. Одна из важнейших задач генной инженерии — разработка технологий по созданию векторов, подобных плазми- дам, не убивающим клетку-хозяина и эффективно экспрессирую- щим клонируемый ген в животной клетке.
Представляют немаловажный интерес микроинъекции ДНК непосредственно в ядро клетки. Так, плазмиды, содержащие фрагмент вируса герпеса с геном тимидинкиназы, и плазмиды pBR322 были инъецированы в ТК-клетки, при этом ТК-ген проник в ядра и нормально в них реплицировался.
Трансформация соматических клеток млекопитающих открывает возможность для изучения механизмов регуляции экспрессии генов и целенаправленно модифицировать генетический аппарат клетки животных, в том числе и человека. Культуры клеток млекопитающих могут быть эффективным источником выделения ряда вирусных антигенов с целью получения вакцин для животных и человека.
В настоящее время разработаны способы введения генов в эмбриональные клетки млекопитающих, мух и некоторых растений с целью изменения свойств организма, таких, как скорость роста, устойчивость к заболеваниям и внешним воздействиям. Подобного рода работы были начаты с довольно крупными яйцами амфибий, а затем продолжены с яйцеклетками и эмбрионами мыши.
(его чистоты, концентрации) во многом зависит эффективное!- получения трансгенных животных. Обычно гены транспортирую!, на ранних стадиях развития животного (в большинстве случаев на. стадии зиготы и двухклеточных эмбрионов). Для трансформаций- генов в геном животного используют следующие приемы: микроб инъекцию ДНК в пронуклеус зигот или в каждый бластомер у? двухклеточного эмбриона; введение ДНК с помощью ретрови* русных векторов; получение трансгенных химер из генетически, трансформированных клеток и эмбрионов. В настоящее время наиболее распространенный метод — микроинъекция ДНК. Ее ocy+i ществляют с помощью специальной пипетки (внутренний диаметр ее около 1 мкм), а количество инъецированного раствору ДНК составляет 1 — 2 пкл. После инъекции ДНК эмбрионы куль-; тивируют до момента пересадки реципиентам. Следует отметить^™ что микроинъекция эмбрионов сельскохозяйственных животный значительно сложнее, чем микроинъекция эмбрионов мышей i£ кроликов. *
После небольшого культивирования in vitro проинъецирован4' ные эмбрионы переносят в яйцеводы (хирургическим путем) ре* ципиентов. Каждому реципиенту мыши, кролика и свиньи обь№ но пересаживают 20 — 30 инъецированных зигот, причем у свине$ все эмбрионы трансплантируют в один яйцевод; у мышей и кро* ликов — раздельно по яйцеводам, а у овец, коз и крупного рогатого скота — по 2 —4 эмбриона каждому реципиенту. Используй методы блот-анализа, дот-блот-анализа и ПЦР, можно получит* вполне надежные доказательства интеграции и экспрессии ДНК> трансгенных животных. С этой целью используют ядросодержа- щие клетки тканей или внутренних жидкостей реципиента, иг которых выделяют ДНК. .
Для исследования у трансгенных животных выделяют РНК а тех тканей, в которых предполагается наиболее высокий уровень экспрессии. Качественный и количественный анализы экзоген ных белков позволяют судить об уровне трансляции инъецированного генного материала.
Генетический анализ родившихся трансгенных животных Я полученного от них потомства показал, что, несмотря на инъек цию ДНК на ранних стадиях, в трансгенных линиях могут появ ляться так называемые мозаики. К мозаикам относят животных происходящих из одной зиготы, но имеющих разные генотипй Помимо клеточных линий, содержащих трансген, они имеют ещ и нетрансгенные клеточные линии. Подсчитано, что около 30 Я первичных трансгенных животных, полученных методом микр(| инъекции ДНК, — мозаики, что затрудняет создание чистых траЩ генных линий животных. Этим объясняется тот факт, что трансге! не передается потомству с ожидаемой в соответствии с закона» Менделя частотой 50 %. Часть мозаиков вообще не может дать на чало трансгенным линиям, так как у них отсутствует передача трансгена по наследству.
Одна из важнейших задач сельскохозяйственной биотехнологии — выведение трансгенных животных с улучшенной продуктивностью и более высоким качеством продукции, резистентностью к болезням, а также создание так называемых животных-био- реакторов — продуцентов ценных биологически активных веществ. Каковы же успехи биотехнологии в этом направлении? С генетической точки зрения особый интерес представляют гены, кодирующие белки каскада гормона роста: непосредственно гормон роста (ГР), рилизинг-фактор гормона роста (РФ) и инсулинпо- добный фактор ГР (ИФГР).
В конце 70-х годов XX в. на основе технологии рекомбинантной ДНК получили гормон роста микробного происхождения. Было показано, то ГР оказывает такое же стимулирующее действие на лактацию и рост животного, как и гипофизарный ГР. Гормон роста, полученный с помощью методов генетической инженерии, при крупномасштабном применении вызывал увеличение удоев на 23 — 31 % при дозе 13 мг в день. Разработаны формы препарата пролонгированного действия, позволяющие использовать его один раз в две недели и даже в месяц. При ежедневной инъекции ГР молодняку крупного рогатого скота, свиней и овец удалось увеличить суточные привесы на 20 — 30% при значительном сокращении расхода кормов на единицу прироста. У молодняка свиней с ускорением роста увеличивалось содержание белка и уменьшалось содержание жира в тканях, что повышало качество мясопродуктов.
Первые трансгенные мыши с геном ГР были получены в 1982 г. У них отмечалось повышение скорости роста и увеличение конечной живой массы. Однако у трансгенных свиней с геном ГР (1989) увеличение роста не наблюдалось.
По данным Л. К.Эрнста (1996), у трансгенных свиней с геном рилизинг-фактора гормона роста (РФ ГР) конечная живая масса была на 15,7 % выше по сравнению с контрольными животными. У потомства трансгенных свиней, получавших модифицированный кормовой рацион с повышенным содержанием белка (18% сырого протеина) и с дополнительным количеством лизина, отмечались более высокие среднесуточные привесы (на 16,5 %).
У трансгенных овец с генами ГР и РФ ГР, несмотря на повышенный уровень ГР, скорость роста не увеличивалась. Вместе с тем, по данным большинства исследователей, у трансгенных свиней наряду с повышением содержания белка наблюдалось двукратное уменьшение толщины шпика (7 — 8 мм у трансгенных против 18 —20 мм у контрольных животных); аналогичные показатели отмечены у трансгенных овец (25 — 30 % жира у контрольных животных против 5 —7% у трансгенных овец).
■J
Рассматривается возможность уменьшения лактозы в моло^ путем создания животных, у которых присутствует специфически для молочной железы промотор, соединенный с геном фермеш Р-галактозидазы, катализирующей распад лактозы. Молоко таки животных, не содержащее лактозы, могут использовать люди, которых не синтезируется (3-галактозидаза. Ведутся работы по ввс дению генных конструкций в организм трансгенных животньс вырабатывающих антитела, предотвращающие маститы.
Другая важная задача — выведение трансгенных животныз устойчивых к заболеваниям. Потери в животноводстве, вызванны различными болезнями, достаточно велики, поэтому все бол« важное значение приобретает селекция животных по резистенч ности к болезням, вызываемых микроорганизмами, вирусам! паразитами и токсинами. Пока результаты селекции на устойч* вость животных к различным заболеваниям невелики, но обнада живающи. В частности, созданы популяции крупного рогатого скот с примесью крови зебу, устойчивые к некоторым кровепараз! тарным заболеваниям. Установлено, что защитные механизмы < инфекционных заболеваний обусловлены либо препятствием btoj жению возбудителя, либо изменением рецепторов. Вторженй возбудителей, равно как и их размножению, препятствуют в о< новном иммунная система организма и экспрессия генов главш го комплекса гистосовместимости. Одним из примеров гена рез! стентности у мышей служит ген Мх. Этот ген, обнаруженный модифицированной форме у всех видов млекопитающих, выраб) тывает у Мх+-мышей иммунитет к вирусу гриппа А. Ген Мх+ бь выделен, клонирован и использован для получения трансгенщ свиней, экспрессирующих ген Мх на уровне РНК. Однако даннь о трансляции Мх-протеина, обусловливающего устойчиво^ трансгенных свиней к вирусу гриппа А, пока не получены. Веду ся исследования в целях получения трансгенных животных, рез! стентных к маститу за счет повышения содержания белка лакп ферина в тканях молочной железы. На культуре клеток из поч« трансгенных кроликов было показано, что клеточные линии, о держащие трансгенную антисмысловую РНК, имели резистен ность против аденовируса Н5 (Ad5) более высокую на 90 — 98? по сравнению с контрольными линиями клеток. Л.К.Эрнст пр демонстрировал также устойчивость трансгенных животных с t ном антисмысловой РНК к лейкозу крупного рогатого скота, заражению вирусом лейкоза. !
Показана возможность конструирования системы внутриклетО ной иммунизации против инфекционных вирусов с участием М тационных форм эндогенных вирусных белков, защищающих; соответствующих вирусов. Так, получены трансгенные куры, устй| чивые к лейкозу, у которых в клетках присутствовал белок вир| ной оболочки. ■ ются, содержание их сравнительно дешево, что делает этих вотных хорошими продуцентами разнообразных белков с низкое стоимостью. В России группой ученых под руководством JI. К. Эрнс|, получены трансгенные овцы с геном химозина, в 1 л молока кс торых содержится 200 — 300 мг химозина — основного компонец, та для производства сыра. Стоимость его будет в несколько pft ниже продукта, получаемого традиционным способом из сычуга молочных телят и ягнят. Приведены данные, свидетельствующщ о высокой эффективности производства сыра с использование" химозина молока трансгенных овец. Так, из 3 л молока трансгер ной овцы можно получить достаточное количество химозина д/ производства 1 т сыра из коровьего молока.
5.7. ПОЛУЧЕНИЕ ИНСУЛИНА НА ОСНОВЕ МЕТОДОВ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
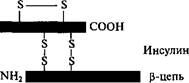
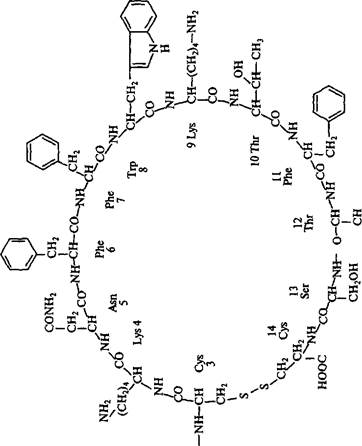
Инсулин — гормон поджелудочной железы, регулирующц| углеводный обмен и поддерживающий нормальный уровень сазд pa в крови. Недостаток этого гормона в организме приводит.) одному из тяжелейших заболеваний — сахарному диабету, коте» рый как причина смерти стоит на третьем месте после сердечн'* сосудистых заболеваний и рака. Инсулин — небольшой глобуля| ный белок, содержащий 51 аминокислотный остаток и состой щий из двух полипептидных цепей, связанных между собой двум дисульфидными мостиками. Синтезируется он в виде одноцепс чечного предшественника — препроинсулина, содержащего koi, цевой сигнальный пептид (23 аминокислотных остатка) и 35-зве£ ный соединительный пептид (С-пептид). При удалении сигналг ного пептида в клетке образуется проинсулин из 86 аминокислот ных остатков, в котором А и В-цепи инсулина соединены C-nei тидом, обеспечивающим им необходимую ориентацию при 3$ мыкании дисульфидных связей. После протеолитического отщег ления С-пептида образуется инсулин.
Известно несколько форм сахарного диабета. Самая тяжел» форма, для лечения которой больному необходим инсулин (инс линзависимая форма заболевания), вызвана избирательной гиб лью клеток, синтезирующих этот гормон (клетки островков Ла| герганса в поджелудочной железе). Форма сахарного диабета, д» лечения которой инсулин не требуется, распространена чаще, ней удается справляться с помощью соответствующих диет и ре:> ма. Обычно поджелудочная железа крупного рогатого скота и свш- не используется в мясной и консервной промышленности и поста ляется в вагонах-рефрижераторах на фармацевтические предпрй тия, где проводят экстракцию гормона. Для получения 100 г кр! таллического инсулина необходимо 800—1000 кг исходного сырЙ
Синтез обеих цепей и соединение их дисудьфидными связями для получения инсулина были проведены в 1963 и 1965 гг. тремя коллективами исследователей в США, Китае и ФРГ. В 1980 г. датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека путем замещения 30-го остатка аланина в цепи В на остаток треонина. Оба инсулина не различались по активности и времени действия.
Работы по генно-инженерному получению инсулина начались около 20 лет назад. В 1978 г. появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках Е. coli (рис. 5.11). Каждый из полученных синтетических генов подстраивался к З'-концу гена фермента (3-галактозидазы и вводился в векторную плазмиду (pBR322). Клетки Е. coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные) белки, состоящие из фрагмента р-галактози- дазы и А или В пептида инсулина, присоединенного к ней через остаток метионина. При обработке химерного белка бромцианом пептид освобождается. Однако замыкание дисульфидных мостиков между образованными цепями инсулина происходило с трудом.
В 1981 г. синтезирован ген-аналог проинсулина — мини-С-про- инсулин, в котором 35-звенный С-пептид был заменен на сегмент из шести аминокислот: арг-арг-гли-сер-лиз-арг и показана его экспрессия в Е. coli.
В 1980 г. У.Гилберт с сотрудниками выделили мРНК инсулина из опухоли Р-клеток поджелудочной железы крысы и с помощью обратной транскриптазы получили с нее кДНК. Полученную кДНК встроили в плазмиду pBR322 Е. coli, в среднюю часть гена пенициллиназы. Рекомбинантная плазмида содержала информацию о структуре проинсулина. В результате трансляции мРНК в клетках синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина, который выщепляли из такого белка трипсином.
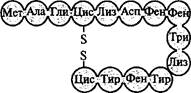
В 1978 г. сотрудниками Института биоорганической химии под руководством акад. Ю. А. Овчинникова был осуществлен синтез двух структурных генов, кодирующих синтез нейропептидов: лейцин- энкефалина и брадикинина. Синтезированный ген лейцин-энкефа- лина имел два «липких» конца:
5-------------------------------------------------------------- 3'
«липкий» ААТХц AT ГТАТ Г Г Т Г Г Ц Т Т ТЦ Т Г ТА А <'™пкий>>™ конец EcoRI ■ ■ ?ТАЦАТАццАцц?ааа?аЦАТТЦТАГ ®amHI
Полученный синтетический ген был встроен вместе с фрагментом природной ДНК, содержащим промотор и проксимальную часть гена белка Р-галактозидазы кишечной палочки Е. coli, в плазмиду-
Ген проинсулина
 СООН
СООН
|

CP - галактозидазный S гибридный белок S
|
ИИОЕ!
JcNBr
|
| Проинсулин |
|
| Ферментативное расщепление |
| А-цепь |
| Рис. 5.11. Схема синтеза инсулина |
вектор pBR322 и обработан смесью рестриктаз — EcoRI и BamHI Полученная рекомбинантная плазмида рЕк была трансформиро; вана в клетки Е. coli. В результате экспрессии встроенного ген бактерия начала продуцировать гибридный (химерный) белок, cqf держащий на N-конце участок Р-галакгозидазы, а на С-конце последовательность нейропептида. С помощью бромциана химер ный белок расщепляли in vitro и получали активный лейцин-энк4 фалин. На рис. 5.12 представлены схема клонирования синтетиче^ кого гена лейцин-энкефалина и его экспрессия в клетках кише<|| ной палочки. и
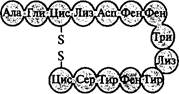
Аналогичным путем был синтезирован соматостатин — гормон гипоталамуса (рис. 5.13). Молекула соматостатина состоит из 14 аминокислотных остатков. Соматостатин подавляет выделение инсулина и гормона роста человека. В Национальном медицинском центре «Хоуп» (Калифорния) был осуществлен химико-ферментативный синтез гена длиной в 42 нуклеотида, способного кодировать соматостатин. Участок ДНК, кодирующий гормон соматостатин, получен путем соединения тринуклеотидов. Из 52 н. п. синтетического гена 42 пары составляли структурный ген гормона, а остальные служили для присоединения синтетического гена к плазмиде pBR322,
H2N -Тир- Гли • Гли • Фен-Лей(ОН)-Лейцин-энкефалин
Химико-ферментативный синтез гена Мет^ Тир Гли Гли^ Фен Лей Stop
-3'
ДАТТЦДТГТАТГГТГГЦТТТЦТГТАА ■ •• •• •••• ••• • •«« • •• ••
«липкии» конец
/ ГТАЦАТАЦЦАЦЦГАААГАЦАТ [ГЦТАГ, .
«липкий» конец BamHI
| /V |

| (р-галактозидаза) |
•он >
\ Ч
Рекомбинантная плазмида
1. Трансформация в E.coli
|
| EcoRI EcoRI |
| Плазмида |
| ______ Н г, ^ BamHI Vя Р / I |
| t Э Т4 ДНК-лигаза |
2. Синтез белка in vivo
Фрагмент
H2N р^галаето"- Мет-ТирТлиТли-Фен-Лей(ОН) зидазы
Гибридный белок
/ Расщепление У BrCN in vitro
Фрагменты Активный лейцин-энкефалин р-галактозидазы
Рис. 5.12. Схема синтеза гибридного и активного лейцин-энкефалина
|
| и о |
<4 li.
i f
83-
X ж и—о I
я
а также к сегменту лактозного оперона (lac) из генома Е. coli или к (3-галактозидазному гену. Такую синтетическую чужеродную ДНК встраивали непосредственно за бактериальным геномом (или внутри его) после расщепления ДНК рестрикционными эндонуклеаза- ми с образованием в результате трансляции гибридного белка.
Основные этапы генно-инженерного синтеза соматостатина показаны на рис. 5.14. Синтетический ген соматостатина был встроен в плазмиду pBR322 Е. coli вблизи конца гена, кодирующего фермент (3-галактозидазу. Между двумя генами был помещен кодон метионина. После выделения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибрид-
| Ген р-галактозидазы E.coli |
| Синтетический ген соматостатина |

|

|
| 1ATGGCTGGTTGTAAGAACTTC1 |
| 'ЗШШттШтт G^TAGTTGTGCTTCACTTTCAG |
in VIVO
|
ДНК-плазмида pBR 322
г^г^г^г^г^г^гл
|
| Расщепление бромцианом |
| Фрагмент Р-галактозидазы |
| Активный соматостатин |
Рис. 5.14. Схема синтеза соматостатина в бактериальной системе
ный белок. Часть его (соматостатин) затем отщепляли от Р-галак-? тозидазы BrCN. Такой сложный способ получения гормона был необходим, так как соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 г. Бойером. Выход гормона составил 10000 молекул на одну клетку. Из 100 г биомассы Е. coli, выращенной в ферментере объемом 8 л, удалось выделить 5 мг соматостатина, т.е. столько, сколько можно его выделить из 100 г овечьих мозгов.
5.8. СИНТЕЗ СОМАТОТРОПИНА
Соматотропин (или гормон роста человека ГРЧ) секретирует- ся передней долей гипофиза. Впервые он был выделен и очищен в 1963 г. из гипофиза. Его недостаток приводит к заболеванию — гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Основные производители — Швеция, Италия, Швейцария и США. Молекула ГРЧ состоит из 191 аминокислотного остатка.
Препарат из трупного материала представляет собой смесь из нескольких форм, из которых пять имеют 22 кДа, другие являются димерами, а остальные — фрагментами, образующимися при протеолизе. Это приводило к тому, что у 30 % больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
Принимая во внимание это обстоятельство, в настоящее время ГРЧ синтезируют методами генетической инженерии в специально сконструированных клетках бактерий. Будучи синтезированным в клетках Е. coli, ГРЧ содержит дополнительный остаток метиони- на на Н2ТЧ-конце молекулы. Биосинтез ГРЧ из 191 аминокислотного остатка был осуществлен в 1979 г. Д. Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путем расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот, — с фен (—NH2) до лей (23), и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связыва-i ния рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл( культуры, что составляет 100 000 молекул гормона на клетку; Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной биологической активностью. С 1984 г. после серьезных клинических испытаний на токсичность компанией «Генетек» (Сан-Франциско) было начато широкомасштабное производство бактериального со- матотропина.
Дата добавления: 2016-02-09; просмотров: 940;
