Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
4.1. Формулировка третьего начала термодинамики
В 1912 году М. Планк высказал постулат: при абсолютном нуле энтропия правильно образованного кристалла чистого вещества равна нулю.
Справедливость постулата Планка, называемого третьим началом термодинамики, следует из экспериментальных данных о зависимости теплоемкости кристаллических веществ от температуры, а также из статистического характера второго начала термодинамики. При абсолютном нуле данное макросостояние кристалла чистого вещества, кристаллическая решетка которого не имеет каких-либо дефектов, предельно упорядочено и может быть реализовано единственным способом. Следовательно, термодинамическая вероятность при абсолютном нуле равна 1:
S = k ln 1 S = 0. (4.1)
На основании постулата Планка можно вычислить абсолютное значение энтропии. Если 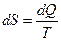 , а
, а 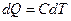 , то
, то 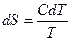 , где С – молярная теплоемкость данного вещества.
, где С – молярная теплоемкость данного вещества.
Интегрируя последнее уравнение в пределах от абсолютного нуля до Т, получим:
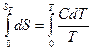 (4.2)
(4.2)
или
ST =  . (4.3)
. (4.3)
4.2. Абсолютные и стандартные значения энтропии
Энтропию ST называют абсолютной энтропией. Она численно равна изменению энтропии при равновесном переходе 1 моля кристаллического вещества от абсолютного нуля до данной температуры.
Вычисление абсолютной энтропии по уравнению (4.3) возможно лишь в том случае, если известна зависимость теплоемкости данного вещества от температуры.
Абсолютную энтропию тела в стандартном состоянии при данном Т называют стандартной энтропией и обозначают через S0T; чаще всего Т=298.15 °К и ее обозначают через S0298:
S0298 =  . (4.4)
. (4.4)
Зная стандартную энтропию, можно вычислить значение абсолютной энтропии данного вещества при любой температуре Т:
ST = S0298 + 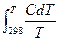 . (4.5)
. (4.5)
Таблицы стандартных значений энтропий играют существенную роль при расчетах констант химических реакционных равновесий и определении направления протекания химических реакций и других процессов.
Необходимо подчеркнуть, что третье начало термодинамики дает возможность вычислить абсолютное значение энтропии различного рода веществ при данном состоянии, тогда как для других термодинамических функций (U, H) могут быть определены только их изменения при переходе данной системы из одного состояния в другое.
4.3. Расчеты изменения энтропии в различных процессах
Методов непосредственного измерения энтропии не существует, но можно рассчитать изменение этой функции при различного рода процессах, пользуясь математическим выражением второго начала термодинамики для обратимых процессов. Так как энтропия является функцией состояния, то ее изменение при переходе системы из начального состояния в конечное будет одним и тем же независимо от того, совершается ли этот переход обратимым или необратимым путем.
Дата добавления: 2016-02-09; просмотров: 1298;
