ПРАВИЛО ФАЗ ГИББСА.
ВЫВОД И АНАЛИЗ.
Для выражения состава двухкомпонентной системы достаточно знать долю одного компонента в системе, а содержание второго компонента будет вполне определенным.
Для системы, в состав которой входят два и более компонентов, можно ограничиться содержанием (К-1) компонентов. Если, например, в стакане чая содержится 3 компонента (вода, чай, сахар), а сахара содержится 0,7%, чая 0,3%, то естественно, что остальное приходится на воду, то есть достаточно знать содержание двух компонентов – на один меньше состава системы.
При распределении этих компонентов в Ф фазах потребуется Ф(К-1) данных для описания состава системы. Когда состав системы изменяется в зависимости от внешних параметров (например, температуры, давления), число которых составляет n, общее число данных о составе системы равно Ф(К-1)+n.
ЧИСЛО УРАВНЕНИЙ, СВЯЗЫВАЮЩИХ РАВНОВЕСНОЕ СОСТОЯНИЕ К-КОМПОНЕНТОВ В Ф-ФАЗАХ.
Напомню, что равновесное состояние характеризуется отсутствием изменений энергии Гиббса или энергии Гельмгольца ΔG=0 или ΔF=0.
Условием равновесия фаз в гетерогенной многокомпонентной системе является равенство химических потенциалов любого компонента во всех фазах. Тогда число уравнений, связывающих равновесное состояние К компонентов в Ф фазах равно:
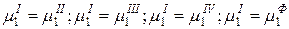 Всего (Ф-1) уравнений
Всего (Ф-1) уравнений
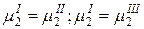 …………………….. (Ф-1) уравнений
…………………….. (Ф-1) уравнений
.
.
.
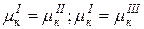 …………………….. (Ф-1) уравнений
…………………….. (Ф-1) уравнений
| К(Ф-1) – общее число уравнений |
Для характеристики фазового состояния системы введено понятие о числе степеней свободы.
Число степеней свободы равновесной термодинамической системы – это число параметров (например температура, давление, концентрация для многокомпонентной системы), которые можно произвольно менять без изменения числа и вида фаз.
Число степеней свободы обозначается через С.
Напомню, что общее число параметров системы выражается как Ф(К-1)+n. Но не все компоненты Ф(К-1)+n, определяющие состав системы, независимы друг от друга. Число степеней свободы С равно общему числу данных о составе системы за вычетом числа связей между ними К(Ф-1):
С=Ф(К–1)+ n–К(Ф–1) или
С = К– Ф + n *
В пределах Земли все системы находятся в одинаковых условиях, и воздействие гравитационного, магнитного, электрического и других полей можно не учитывать. К числу внешних параметров, учитываемых для конденсированных систем (жидкость, твердое тело), относятся температура, n=1, а для неконденсированных систем (газ) – ещё и давление, т.е. n=2. Таким образом, уравнение * С = К– Ф + n принимает вид:
С = К–Ф+1 ** С = К–Ф+2 ***
(Т) (Т, Р)
Все три уравнения выражают правило фаз Гиббса, которое формулируется следующим образом:
Число степеней свободы равновесной термодинамической системы, на которую влияют n внешних факторов, равно числу независимых компонентов системы минус число фаз плюс n.
С – число степеней свободы.
К – число независимых компонентов.
Ф – число фаз системы.
n – число внешних параметров, влияющих на систему.
n=2 (Т,Р) ; n=1 (Т или Р)
|
С=1-1+2=2
Дата добавления: 2016-02-02; просмотров: 683;
