УСЛОВИЯ РАВНОВЕСИЯ В ГЕТЕРОГЕННОЙ СИСТЕМЕ.
ФАЗОВОЕ РАВНОВЕСИЕ.
Фундаментальные представления химической термодинамики применимы для характеристики фазового равновесия и фазовых переходов.
Фазовое равновесие означает одновременное существование термодинамически равновесных фаз в гетерогенной системе.
Например, жидкость со своим насыщенным паром (система жидкость-газ), вода и лед при температуре плавления (система жидкость-твердое тело), две несмешивающиеся жидкости (система жидкость-жидкость) и т.д.
Фазовое равновесие в зависимости от состава и параметров системы определяется правилом фаз Гиббса.
Система
/ \
гомогенная(однофазная) гетерогенная(многофазная)
Фаза–гомогенная часть гетерогенной системы, обладающая определенным набором физических и химических свойств и отделенная от других фаз поверхностью раздела.
Компонент–часть системы, которая может быть выделена из неё и существовать вне этой системы.
Например, раствор NaCl: компоненты NaCl и вода.
Число независимых компонентов (параметров) равно общему числу компонентов (параметров) минус число уравнений, связывающих их.
ФАЗОВЫЕ ПЕРЕХОДЫ.
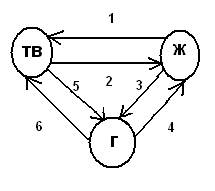
1) кристаллизация(ΔH<0)
2) плавление(ΔH>0)
3) испарение(ΔH>0)
4) конденсация(ΔH<0)
5) сублимация (возгонка)(ΔH>0)
6) десублимация(ΔH<0)
УСЛОВИЯ РАВНОВЕСИЯ В ГЕТЕРОГЕННОЙ СИСТЕМЕ.
Возможность T1≠T2 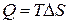
Направление T1>→T2< 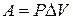
Предел T1=T2 T, P – факторы интенсивности
Для определения возможности, направления и предела протекания процессов в гетерогенных системах можно воспользоваться выражением 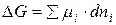 (µi – химический потенциал) – фактор интенсивности фазового перехода.
(µi – химический потенциал) – фактор интенсивности фазового перехода.
На рисунке представим схему перехода некоторого малого количества компонента i из фазы I в фазу II.
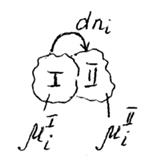
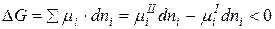
µiI >µiII
Возможность фазового перехода определяется химическим потенциалом.
1) Возможность процесса: µiI ≠ µiII
2) Направление процесса:если µiI >µiII , тоI → II
3) Предел процесса: µiI = µiII
Если, например, жидкость находится в равновесии со своим паром, то химический потенциал является одним и тем же для пара и жидкости (µiж = µiп). При повышении температуры химический потенциал компонента в газовой среде снижается и становится ниже его химического потенциала в жидкой среде. Тогда в соответствии с условием µiж > µiп часть жидкости будет самопроизвольно испаряться до тех пор, пока не произойдет выравнивание химических потенциалов сопряженных фаз.
Влияние внешних параметров на фазовое равновесие и фазовые переходы определяется правилом фаз Гиббса.
Дата добавления: 2016-02-02; просмотров: 995;
