Химическое сродство. При решении задач этого раздела см
При решении задач этого раздела см. табл. 5-7.
Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре проходит с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации), к уменьшению Н; с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением, а вторая – с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией.
Энтропия S, так же как внутренняя энергия U, энтальпия И, объем V и др., является свойством вещества, пропорциональным его количеству. S, U, H, V обладают аддитивными свойствами, т.е. при соприкосновении системы суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п., – ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение (DS) зависит только от начального (S1) и конечного (S2) состояния и не зависит от пути процесса:
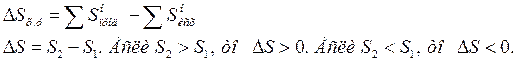 (2)
(2)
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка »ТDS. Энтропия выражается в Дж/(моль • К). Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS). При р = const и Т = const общую движущую силу процесса, которую обозначают DG, можно найти из соотношения:
DG = (Н2 – Н1) – (TS2 – TS1); DG = DН – ТDS.
Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль энергии Гиббса (DG), которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому
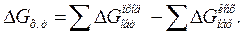 (3)
(3)
Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения DG. Если DG < 0, процесс принципиально осуществим; если DG > 0, процесс самопроизвольно проходить не может. Чем меньше DG, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором DG = 0 и DН = ТDS.
Из соотношения DG = DН – ТDS видно, что самопроизвольно могут протекать и процессы, для которых DН > 0 (эндотермические). Это возможно, когда DS > 0, но |ТDS| > |DН|, и тогда DG < 0. С другой стороны, экзотермические реакции (DН < 0) самопроизвольно не протекают, если при DS < 0 окажется, что DG > 0.
Таблица 6.
Дата добавления: 2016-02-02; просмотров: 1028;
