Стандартные теплоты (энтальпии) образования DHо298 некоторых веществ
| Вещество | Состояние | DHо298, кДж/моль | Вещество | Состояние | DHо298, кДж/моль |
| С2H2 | г | +226,75 | CO | г | -110,52 |
| CS2 | г | +115,28 | CH3OH | г | -201,17 |
| NO | г | +90,37 | C2H5OH | г | -235,31 |
| C6H6 | г | +82,93 | H2O | г | -241,83 |
| C2H4 | г | +52,28 | H2O | ж | -285,84 |
| H2S | г | -20,15 | NH4Cl | к | -315,39 |
| NH3 | г | -46,19 | CO2 | г | -393,51 |
| CH4 | г | -74,85 | Fe2O3 | к | -822,10 |
| C2H6 | г | -84,67 | Ca(OH)2 | к | -986,50 |
| HCl | г | -92,31 | Al2O3 | к | -1669,80 |
Пример 2. Реакция горения этана выражается термохимическим уравнением
C2H6(г) + 3½O2 = 2 CO2(г) + 3H2O (ж); DHх.р = -1559,87 кДж
Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж) (табл. 5).
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоты образования относят к стандартному состоянию, т.е. 25оС (298 К) и 1,013×105 Па, и обозначают через DHо298. Так как тепловой эффект с температурой изменяется незначительно, то здесь и в дальнейшем индексы опускаются, и тепловой эффект обозначается через DН. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид:
2С (графит) + 3Н2(г) = С2Н6(г); DН = ?
исходя из следующих данных:
а) С2Н6(г) + 3 ½О2(г) = 2СО2(г) + 3Н2О(ж); DН = -1559,87 кДж
б) С (графит) + О2(г) = СО2(г); DН = -393,51 кДж
в) Н2(г) + ½О2 = Н2О(ж); DН = -285,84 кДж
На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (а) – на 3, а затем сумму этих уравнений вычесть из уравнения (а):
С2Н6 = 3 ½О2 – 2С – 2О2 – 3Н2 – 3/2О2 = 2СО2 + 3Н2О – 2СО2 – 3Н2О
DН = -1559,87 – 2(-393,51) – 3(-285,84) = +84,67 к Дж;
DН = -1559,87 + 787,02 + 857,52; С2Н2 = 2С + 3Н2;
DН = +84,67 кДж
Так как теплота образования равна теплоте разложения с обратным знаком, то 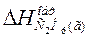 = -84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
= -84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса:

Учитывая, что теплоты образования простых веществ условно приняты равными нулю:
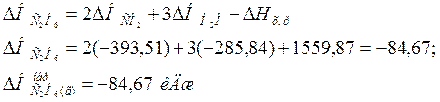
Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением:
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); DН = ?
Вычислите тепловой эффект реакции, если известно, что мольная (молярная) теплота парообразования С2Н5ОН(ж) равна +42,36 кДж и известны теплоты образования: С2Н5ОН(г); СО2(г); Н2О(ж) (см. табл. 5).
Решение. Для определения DН реакции необходимо знать теплоту образования С2Н5ОН(ж). Последнюю находим из данных:
С2Н5ОН(ж) = С2Н5ОН(г); DН = +42,36 кДж.
+42,36 = -235,31 – 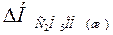 ;
;
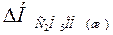 = -235,31 – 42,36 = -277,67 кДж.
= -235,31 – 42,36 = -277,67 кДж.
Вычисляем DН реакции, применяя следствия из закона Гесса:
DНх.р = 2(-393,51) + 3(-285,84) + 277,67 = -1366,87 кДж.
Контрольные вопросы
81.Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж.
82.Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: -45,76 кДж.
83.Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO(к) + СО(г) = Fe(к) + СО2(г); DН = -13,18 кДж.
СО(г) + ½О2(г) = СО2(г); DН = -283,0 кДж.
Н2(г) + ½О2(г) = Н2О(г); DН = -241,83 кДж.
Ответ: +27,99 кДж.
84.При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: +65,43 кДж.
85.Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются СН4(г) и Н2О(г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж.
86.Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO, исходя из следующих термохимических уравнений:
4NH3(г) + 5O2(г) = 4NO(г) + 6 H2O(ж); DН = -1168,80 кДж.
4NH3(г) + 3O2(г) = 2N2(г) + 6 H2O(ж); DН = 1530,28 кДж.
Ответ: 90,37 кДж.
87.Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
88.Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
Н2(г) + 1/2О2(г) = Н2О(ж); DН = -285,84 кДж.
С(к) + О2(г) = СО2(г); DН = -393,51 кДж.
СН4(г) + 2О2(г) = 2Н2О(ж) + СО2(г); DН = -393,51 кДж.
Ответ: -74,88 кДж.
89.Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са(к) + 1/2О2(г) = СаО(к); DН = -635,60 кДж.
Н2(г) + 1/О2(г) = Н2О(ж); DН = -285,84 кДж.
СаО(к) + Н2О(ж) = Са(ОН)2(к); DН = -65,06 кДж.
Ответ: -986,50 кДж.
90.Тепловой эффект какой реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6(ж). Ответ: +49,03 кДж.
91.Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
92.При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
93.Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН(ж) + 3/2О2(г) = СО2(г) + 2Н2О(ж); DН = ?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования СН3ОН(ж) равна +37,4 кДж. Ответ: -726,62 кДж.
94.При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ:
-277,67 кДж/моль.
95.Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 71/2О2(г) = 6СО2(г) +ЗН2О(г); DН = ?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна +33,9 кДж. Ответ: -3135,58 кДж.
95. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моль этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж.
97. Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3O2(г) = 2N2(г) + 6Н20(ж); DН = -1530,28 кДж.
Вычислите теплоту образования NH3(г). Ответ: -46,19 кДж/моль.
98.При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS. Ответ: -100,26 кДж/моль.
99.При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н2 (г). Ответ: 226,75 кДж/моль.
100. При получении эквивалентной массы гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: -635,6 кДж.
Дата добавления: 2016-02-02; просмотров: 3152;
