Чем лучше в данном растворителе растворяется данный адсорбат, тем хуже он адсорбируется; чем хуэе растворяется - тем лучше из него адсорбируется.
Избирательная адсробцияподчиняется правилу:
На поверхности данного адсорбента преимущественно адсорбируются те ионы, которые могут достраивать кристаллическую решетку этого адсорбента.
Значение адсорбции :окрашивание гистологических срезов и др. гисто-хим. Анализов, гетерогенный катализ, пищеварительные процессы, гемодиализ. В пр. фотосинтеза, питания, обмена веществ во многом определяется поверхностными явлениями, в частности адсорбции.
Адсорбция лежит в основе ряда методов лечения:Адсорбционная терапия( удаление токсинов ЖКТ), хемосорбции() ; иониты используют в медицине для выделения и очистке аминокислот, для консервирования крови.
24.Дисперсной называют систему, состоящую из дисперсной фазы – совокупности раздробленных частиц и непрерывной дисперсионной среды, в которой во взвешенном состоянии находятся эти частицы.
Степень дисперсности(δ) величина обратная среднему диаметру частиц d(м-1)
δ = 1/d
Классификация дисперсных систем.
По степени дисперсности все системы можно разделить на грубодисперсные,коллоиднодисперсные,молекулярнодисперсные и ионнодисперсные.
а) Грубодисперсные системы (размер частиц 10ˉ5 – 10ˉ3 см) – это суспензии, эмульсии, пены.
Суспензии – гетерогенные системы, в которых частицы твердой дисперсной фазы распределены в жидкой дисперсионной среде. Это, например, взвесь крахмала в воде, раствор кофе, известковый и цементный раствор.
Эмульсии образуются двумя несмешивающимися жидкостями. Примерами эмульсий служат молоко, майонез, маргарин, эмульсия бензола в воде.
Пены состоят из ячеек заполненных газом и отделенных друг от друга жидкими или твердыми пленками. Это мыльная пена, пемза, пенопласты.
Грубодисперсные системы видны в обычный микроскоп и даже невооруженным глазом. Могут задерживаться бумажным фильтром. Из-за больших размеров частиц эти системы неустойчивы и со временем дисперсная фаза отделяется от дисперсионной среды.
б)Коллоиднодисперсные системы (коллоидные растворы). Размер частиц дисперсной фазы составляет 10ˉ7 – 10ˉ5 см, а размер частиц дисперсионной среды 10ˉ8 см. Степень дисперсности в коллоидах выше, чем в грубодисперсных системах. Коллоидные частицы не оседают под действием силы тяжести, проходят через бумажные фильтры; но они невидимы в обычный микроскоп. Коллоидные растворы обычно называют золями. В зависимости от природы дисперсионной среды золи называют гидрозолями – дисперсионная среда – жидкость, аэрозолями – дисперсионная среда воздух.
в)Молекулярнодисперсные и ионнодисперсные системы (истинные растворы).Размеры частиц составляют 10ˉ8 см, т.е. равны размерам молекул и ионов. В таких системахгетерогенность исчезает - системы становятся гомогенными, образуются истинные растворы. К ним относятся растворы сахара, спирта, неэлектролитов, электролитов и слабых электролитов. По размерам дисперсных частиц коллоидные растворы занимают промежуточное положение между грубодисперсными системами и истинными растворами.
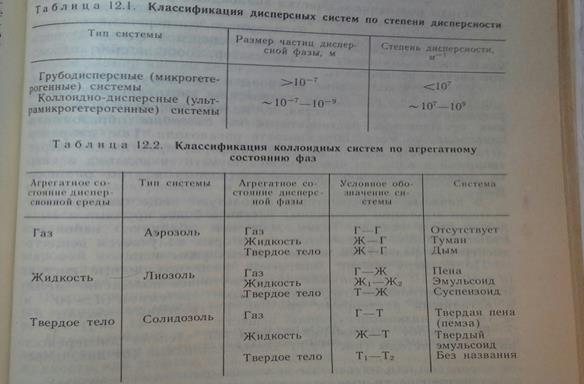
Классификация по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсной средой:
1)Системы со слабым взаимодействием между д. фазой и д. средой лиофобными коллоидами (золями). Лиофобные коллоиды являются не обратимыми( после удаления дисперсионной среды они самопроисвольно не способны диспергироваться и давать золь).
2)С сильными взаимодействиями – лиофильными. Лиофильные являются обратимыми системами( способны самопроизвольно растворяться ).
Если дисперсионной средой является вода, то системы называются – гидрофобные и гидрофильные.
Природа коллоидного состояния. коллоидное состояние вещества имеет два основных признака – дисперсность и гетерогенность. Особенностью высокодисперсных систем является их неустойчивость, связанная с большим запасом свободной поверхностной энергии вследствие большой поверхности раздела фаз. Для дисперсных систем характерны самопроизвольные процессы, снижающие избыточную поверхностную энергию за счёт укрупнения частиц дисперсной фазы. Обеспечение относительной устойчивости системы достигается созданием на поверхности частиц дисперсной фазы защитных слоёв – двойного электрического слоя, обеспечивающего электростатическое отталкивание частиц, и адсорбционно-сольватного слоя, препятствующего соприкосновению и слипанию частиц. Стабилизирующие слои возникают в результате адсорбции ионов или молекул.
25.
Суспензии (от позднелат. suspensio-подвешивание), дисперсные системы. в которых твердые частицы дисперсной фазы -находятся во взвешенном состоянии в жидкой дисперсионной среде (другой часто применяемый термин-взвеси).
Получение суспензий. Два основных способа - смешение сухих порошков с жидкостью или измельчение твердых тел в жидкости (методы диспергирования) и выделение твердой фазы из жидкой среды (методы конденсации).
Эму́льсия (новолат. emulsio; от лат. emulgeo — дою, выдаиваю) — дисперсная система, состоящая из микроскопических капель жидкости (дисперсной фазы), распределенных в другой жидкости (дисперсионной среде). Эмульсии образуются двумя путями:
13) путём дробления капель.
Этот метод осуществляется путём медленного прибавления диспергируемого вещества в дисперсную систему в присутствии эмульгаторапри непрерывном и сильном перемешивании.
· путём образования плёнок и их разрыва на мелкие капли.
Жидкость, образующая дисперсную фазу (например, масло), при медленном прибавлении к дисперсионной среде образует плёнку. Эта плёнка разрывается пузырьками воздуха, выходящими из отверстия трубки, которые находятся на дне сосуда. Образуются мелкие единичные капли. Одновременно пузырьки воздуха энергично размешивают всю жидкость и этим самым способствуют дальнейшему эмульгированию
Коллоидные системы занимают промежуточное положение между грубодисперсными системами и истинными растворами, то их можно получать двумя различными путями: из грубодисперсных систем путем дробления – это методы диспергирования; или из истинных растворов в результате объединения атомов и молекул в агрегаты коллоидной степени дисперсности – методы конденсации.
Диализ- удаление с помощью мембран низкомолекулярных соединений из коллоидных растворов и растворов ВМС. При этом используют свойство мембран пропускать молекулы и ионы малого размера и задерживать коллоидные частицы и макромолеулы. Жидкость, подвергаемую диализу, отделяют от чистого растворителя соответствующей мембраной. Малые молекулы и ионы диффундируют через мембрану в растворитель и при его частой замене почти нацело удаляются из диализируемой жидкости.
Электродиализ – используют для увеличения скорости диализа низкомолекулярных электролитов. С этой целью в диализаторе создают постоянное электрическое поле с падением потенциала 20-250 В/см. Проведение диализа в электрическом поле позволяет ускорить очистку коллоидного раствора в несколько десятков раз.
Ультрафильтрация- применяется для очистки систем содержащих частицы коллоидных размеров (золи, ВМС, взвеси бактерий и вирусов). В основе метода лежит продавливание разделяемой смеси через фильтры с порами, пропускающих только молекулы и ионы низкомолекулярных веществ. Широко используется для очистки воды, белков, нук. Кислот. И т.д.
Дата добавления: 2016-02-02; просмотров: 1648;
